宫颈癌筛查质量控制技术规范(DB11/T 2137—2023)

首都医科大学附属北京妇产医院/北京妇幼保健院. 宫颈癌筛查质量控制技术规范(DB11/T 2137—2023)[J]. 中华肿瘤杂志, 2024, 46(4): 269-273. DOI:10.3760/cma.j.cn112152-20231202-00345.
一、范围
本文件规定了宫颈癌筛查的基本要求、筛查流程、筛查技术要求和质量控制要求。
本文件适用于医疗机构开展宫颈癌筛查。
二、规范性引用文件
下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 20470 临床实验室室间质量评价要求
WS 375.22 疾病控制基本数据集 第22部分:宫颈癌筛查登记
三、术语和定义
本文件没有需要界定的术语和定义。
四、基本要求
(一)制度
应建立健全并落实:(1)岗位职责及操作规程;(2)专业技术人员培训计划及考核制度;(3)可疑及异常病例登记、转诊、随访及管理制度;(4)质量控制管理制度;(5)信息管理及信息安全制度。
(二)人员
1. 宫颈癌筛查工作人员包括妇科检查、人乳头瘤病毒核酸检测、宫颈细胞学检查、阴道镜检查、组织病理学检查人员及管理人员。工作人员每年应参加继续教育专业培训,掌握筛查流程、相关专业技术规范及管理规范。
2. 妇科检查人员应具备妇产科执业医师资质,具有医师或以上职称,具有3年及以上妇科临床经验。
3. 人乳头瘤病毒核酸检测人员应具备执业资质,涉及基因扩增技术者,应具备临床基因扩增检验技术上岗证。
4. 宫颈细胞学阅片初筛人员应具有医学学历,具有1年及以上宫颈细胞学阅片工作经验,经培训考核合格。细胞病理学人员应具备临床执业医师资质,并对报告负责。
5. 阴道镜检查人员应具备妇产科执业医师资质,具有3年及以上妇产科临床工作经验,具有1年及以上阴道镜专业技术实践经验,每年应至少完成100例阴道镜检查。
6. 组织病理学诊断人员应具备临床执业医师资质。出具病理学诊断报告的医师宜具备中级及以上病理学资质。
7. 管理人员应了解筛查工作流程及管理规范,具备管理经验。
(三)设施设备及耗材
1. 仪器设备应定期清洁、维护、校准,并建立档案。
2. 标本保存液、检测试剂、耗材应是有效期内的合格产品。
(四)管理要求
1. 应按照信息管理制度进行信息采集录入、汇总分析及报表报送,应每年对筛查工作进行总结。个案完整率、个案填写错误率应符合附录宫颈癌筛查质量控制关键指标的要求。
2. 应成立质量控制管理小组,由管理及筛查相关专业技术人员组成,每月开展现场质量控制。
3. 应对质量控制结果进行反馈,并形成书面反馈报告。
五、筛查流程
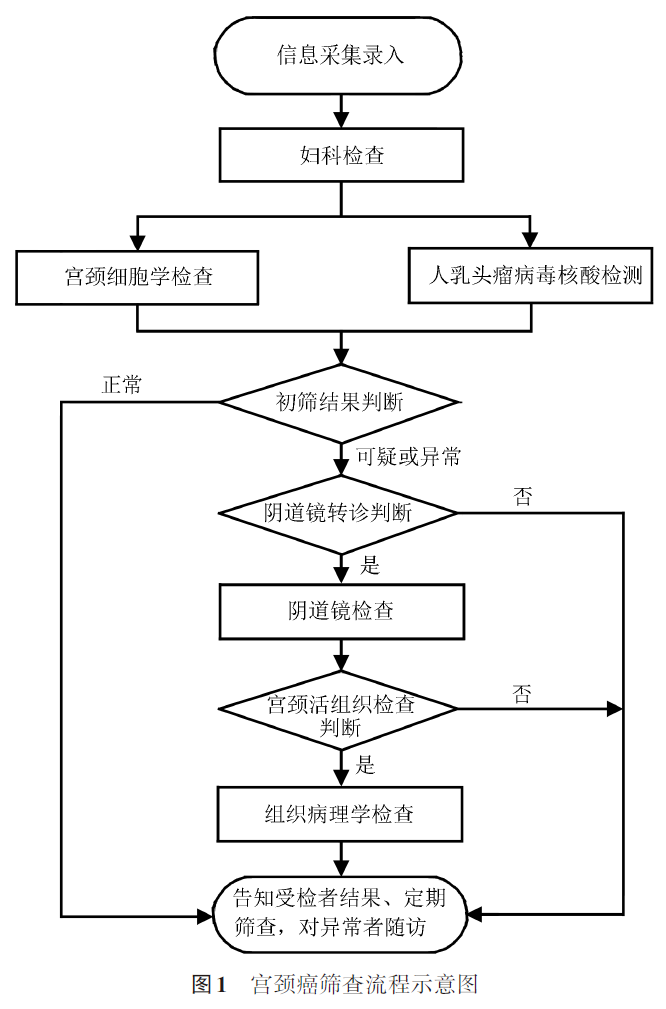
1. 宫颈癌筛查包括妇科检查、人乳头瘤病毒核酸检测和/或宫颈细胞学检查等初筛检查服务,以及对于检出的可疑异常患者进行阴道镜检查、组织病理学检查等转诊服务。
2. 依据筛查需求,确定筛查方法。图1为宫颈细胞学检查和人乳头瘤病毒核酸检测联合应用的筛查流程。
六、筛查技术要求
(一)妇科检查
1. 观察外生殖器,规范进行阴道检查、宫颈标本取材、双合诊检查,记录检查结果。
2. 应规范进行宫颈标本采集,取材应在宫颈外口鳞-柱交接转化区及宫颈管内,用宫颈刷旋转刷取2~3周。在取材时如发现宫颈及阴道任何肉眼可见的可疑区域,应同时取材。
3. 取材后立即将标本转移至保存液中,所有标本均应清晰标记,检查申请单应填写准确、完整。
4. 根据保存液说明书要求对标本进行保存、送检。
5. 宫颈癌筛查采集信息应符合WS 375.22要求。
6. 每位妇科检查人员每天检查人数不宜超过100人次。
(二)人乳头瘤病毒核酸检测
1. 标本处理
(1)应具有标本采集前准备、标本采集、保存、运送、签收的标准操作程序。
(2)应按照试剂盒说明书的要求进行标本处理。
2. 检测
(1)应按照试剂盒说明书形成检验项目的标准操作程序,并严格执行。
(2)应有相应的实验记录。
(3)应对所开展的项目进行检验方法和程序的分析性能验证,有程序评估并确认分析性能符合预期用途。更换试剂批号或检测系统发生可能影响结果的变更时,应进行质量评估或验证。
(4)应制定并落实防止核酸污染的工作流程和预案,建立检测后的清洁流程及发生实验室污染的措施。
3. 报告
(1)宜在收到标本后5个工作日内出具报告,最长不超过10个工作日。
(2)应经报告医师和审核医师共同签字后发出。
4. 标本与资料保存
(1)实验室应明确检测后标本的保存要求,保存应符合生物安全要求。
(2)资料记录完整,应规范保存。
(三)宫颈细胞学检查
1. 制片
宫颈液基细胞学制片应符合附录中宫颈液基细胞学制片技术要求及质量要求。
2. 染色
宫颈细胞学涂片巴氏染色应符合附录中宫颈细胞学涂片巴氏染色技术要求及质量要求。
3. 阅片
(1)每人每天阅片数量不宜超过100张。
(2)应采用贝塞斯达(the Bethesda system,TBS)宫颈细胞学报告系统分类判读。
4. 报告
(1)宜在收到标本后5个工作日内出具报告,最长不超过10个工作日。
(2)阳性细胞学涂片报告应由初筛人员和审核医师共同签名后发出。
5. 标本与资料保存
(1)阴性细胞学涂片应至少保存1年,阳性细胞学涂片保存15年。
(2)应建立标本接收、制片、染色、阅片质量管理记录,并规范保存。
(四)转诊判断
妇科检查人员依据宫颈癌初筛结果判断:(1)对于初筛结果正常者,应告知受检者结果并定期筛查;(2)对于初筛结果为可疑或异常者,应依据阴道镜转诊指征判断是否进行阴道镜检查。
(五)阴道镜检查
1. 检查指征
确认受检者具有阴道镜检查指征。
2. 检查准备
告知受检者阴道镜检查注意事项。应全面采集病史,签署知情同意书。
3. 操作流程
(1)检查外阴和肛周、阴道、宫颈有无异常。
(2)评估宫颈鳞-柱交接可见性及转化区类型。
(3)规范进行醋酸试验、复方碘染色试验。
(4)识别和评估宫颈、阴道、外阴、肛周病变的位置、大小、范围、程度。
(5)根据阴道镜下上皮及血管等图像特点做出阴道镜诊断。
4. 取材
(1)应先确认是否进行宫颈活组织检查。
(2)宫颈活组织检查的取材方式和部位应符合以下要求:①对宫颈或阴道所有可见的不相连续异常区域进行2~4个点位定位活检,应选择在病变最为严重的位置进行活检,必要时需行宫颈管搔刮术;②如果宫颈细胞学检查TBS报告结果为不典型鳞状上皮细胞—不除外鳞状上皮内高度病变及以上者而阴道镜下未见异常区域的病例,宜在宫颈四象限内分别行随机活检及宫颈管搔刮术。
5. 报告
(1)宜在检查当天出具报告。
(2)应使用国际子宫颈病理与阴道镜联盟推荐的阴道镜检查术语,报告中至少保存2张图像。
(3)报告应经检查医师签字后发出。
6. 结果一致性评估
检查后应对宫颈癌筛查结果、阴道镜诊断以及宫颈活检组织的病理检查结果进行一致性评估,制定适宜的进一步管理方案。
(六)组织病理学检查
1. 标本处理
(1)取得的标本应放入装有4%中性甲醛溶液的标本瓶中。
(2)对于锥形切除的宫颈标本,标本离体后宜在6点或12点处标记,应测量记录其锥高/长度、宫颈外口切缘最大径以及宫颈管外口直径。取材前宜先用墨汁标记宫颈内口切缘、基底切缘及宫颈外口切缘,按顺时针方向依次标记标本块。
2. 制片
(1)标本块包埋方向应充分显示宫颈内口、外口、黏膜面及基底面。
(2)切片厚度一般为4 μm,应避免皱折、裂隙和刀痕。
(3)染色技术稳定,切片组织色彩鲜明,染色核质分明,红蓝适度,透明洁净,封裱无气泡。
3. 报告
(1)应在收到标本后5个工作日内出具报告。
(2)报告经由出诊医师阅片,并经诊断医师审核后发出。
4. 标本与资料保存
(1)病理切片和蜡块至少保存15年。
(2)应建立质量管理记录,至少保存2年。病理档案保存期限按照病历管理规定执行。
七、质量控制要求
(一)妇科检查
1. 现场随机观察妇科检查人员完成5例妇科检查全过程。
2. 妇科检查规范率应符合附录中宫颈癌筛查质量控制关键指标的要求。
(二)人乳头瘤病毒核酸检测
1. 室内质量控制
(1)应建立室内质量控制标准操作程序,明确质控品来源、质量控制规则及失控的处置流程。
(2)应依据检测方法设置阴性和弱阳性室内质控品,弱阳性质控品通常为检出限的1.5~3倍,宜在一定检测周期内覆盖所有型别。
(3)室内质控品宜参与全过程质量控制。
(4)每月对室内质量控制结果进行统计分析,制定并落实对失控的持续改进措施。
2. 室间质量评价
(1)应符合GB/T 20470的要求。
(2)所有开展人乳头瘤病毒核酸检测的实验室均应按照检验项目参加相应的室间质量评价,对于未开展室间质量评价的项目进行室间比对。
(3)应建立室间质量评价的程序文件,保留参加室间质量评价的原始记录。
(4)对于室间质量评价或室间比对结果未通过的项目,应进行原因分析,并评估对于已发放的临床检验结果的影响,采取纠正措施并持续改进。
(5)室间质量评价项目合格率应符合附录中宫颈癌筛查质量控制关键指标的要求。
(三)宫颈细胞学检查
1. 室内质量控制
(1)报告发出前应对细胞学涂片进行质量控制,质量控制应符合以下要求:①对阴性细胞学涂片至少抽取10%进行复查;②对高危型人乳头瘤病毒核酸检测结果阳性且有临床症状或体征病例的阴性细胞学涂片100%复查;③初筛阳性细胞学涂片报告由初筛人员和审核医师共同签名发出;④审核后不能确定诊断的疑难细胞学涂片经会诊后发出报告。
(2)每月统计并分析宫颈细胞学标本满意率、总体阳性率、各级病变发生率、未明确意义的不典型鳞状上皮细胞与鳞状上皮内病变比率,并留有原始记录。
2. 室间质量评价
(1)应对工作环境及设备、人员资质、工作流程、标准操作程序、标本储存、质量控制记录、阅片能力等开展质量评估。
(2)应抽查5%阴性细胞学涂片及20%阳性细胞学涂片,由质量控制人员进行质量评估。
(3)宫颈细胞学标本满意率、宫颈细胞学阳性(未明确意义的不典型鳞状上皮细胞及以上)涂片复查符合率、宫颈细胞学阴性涂片复查符合率应符合附录中宫颈癌筛查质量控制关键指标的要求。
(四)阴道镜检查
1. 质量控制人员观察阴道镜检查人员完成5例阴道镜检查的操作、诊断、处理、建议及图文报告书写。
2. 随机调阅既往阴道镜检查病例,查看病例处理及报告的规范性。
3. 阴道镜拟诊符合率、阴道镜异常检出率、阴道镜检查拟诊高级别病变与病理结果符合率应符合附录中宫颈癌筛查质量控制关键指标的要求。
(五)组织病理学检查
1. 室内质量控制
(1)建立并落实病理诊断差错的识别、纠错及持续性改进的程序。
(2)每月随机抽取20份活检切片进行复核。
2. 室间质量评价
(1)应对工作环境及设备、人员资质、工作流程、标准操作程序、标本储存、质量控制记录、阅片能力等开展质量评估。
(2)病理检查结果符合率应符合附录中宫颈癌筛查质量控制关键指标的要求。
(3)质量评价结果不合格时,应及时查找原因,采取纠正措施,并详细记录。
附录
(规范性)
宫颈癌筛查质量控制要求
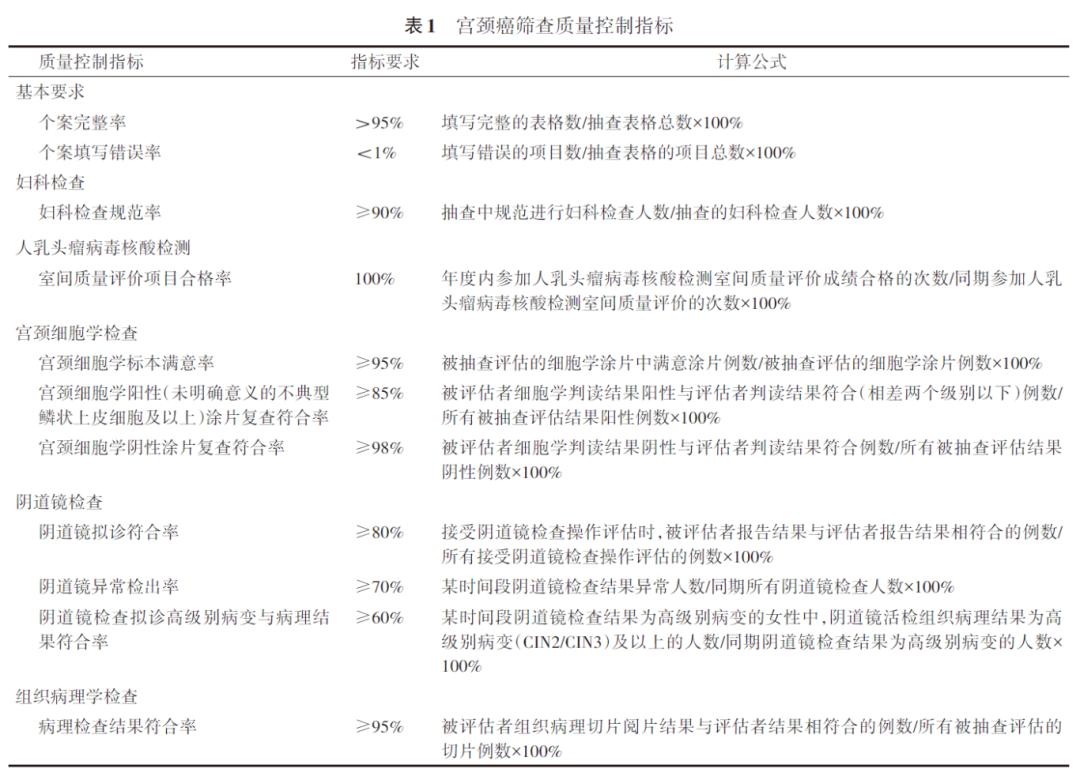
一、宫颈癌筛查质量控制关键指标
宫颈癌筛查质量控制关键指标应符合表1的规定。
二、宫颈液基细胞学制片技术要求及质量要求
(一)技术要求
1. 充分将取材器上的标本转移到细胞保存液容器内。
2. 应在标本保存期内完成制片。
3. 应严格遵守制片操作规程。
4. 去除标本中过多的血液和黏液。
5. 充分混匀标本。
6. 制好的涂片立即用95%乙醇固定。
7. 保留剩余标本液至报告发放后2周。
8. 液基制片机应定期维护并保留维护记录。
(二)质量要求
1. 成比例的提取,涂片中细胞成分齐全。
2. 几乎没有或很少有血液和黏液覆盖上皮细胞。
3. 细胞均匀分布、单层平铺不重叠。
4. 鳞状细胞数量符合宫颈细胞学TBS报告系统标本质量要求。
三、宫颈细胞学涂片巴氏染色技术要求及质量要求
(一)技术要求
1. 巴氏染色前涂片应使用95%乙醇充分固定。
2. 苏木素染色前后应用水清洗涂片。
3. 桔黄G和EA50染色前后均应用95%乙醇清洗涂片。
4. 需严格掌握桔黄G染色时间。
5. 每次出染液或洗液都应将染色架液体滴干。
6. 染色时间长短应根据室内温度、水温的变化及染液所染过的片子数量多少而变化。
7. 应保持盖玻片清洁无杂质。
8. 应立即用盖玻片和树胶封固染好后的涂片,避免在乙醇中过度停留。如未及时封固,则不应将涂片暴露在空气中。
9. 应保持染液新鲜,应定期更换染液、乙醇洗液和二甲苯液,一般500 ml染液及洗液仅能染500~600张涂片。
10. 应密闭盛染液及洗液的容器。
(二)质量要求
1. 染色不宜过深或过浅。
2. 细胞质和细胞核着色分明,细胞结构清晰,易于辨认。
3. 涂片背景中无杂质。
4. 封片无死角,无气泡。
本文件按照GB/T 1.1—2020《标准化工作导则 第1部分:标准化文件的结构和起草规则》的规定起草。
本文件由北京市卫生健康委员会提出并归口。
本文件由北京市卫生健康委员会组织实施。
本文件起草单位:首都医科大学附属北京妇产医院/北京妇幼保健院 。
本文件主要起草人:韩历丽、沈洁、吴青青、毕蕙、潘秦镜、张瑞、安美静、梁燕、张妍、张月、高丽丽、马亮、耿力、魏巍、何淑蓉、刘从容、张询、金玉兰、鲍成臻、窦紫岩、赵艳霞、沈艺。
链接:http://www.lewenyixue.com/2024/05/15/%E5%AE%AB%E9%A2%88%E7%99%8C%E7%AD%9B%E6%9F%A5%E8%B4%A8%E9%87%8F%E6%8E%A7%E5%88%B6%E6%8A%80%E6%9C%AF%E8%A7%84%E8%8C%83%EF%BC%88DB11-T/