中性粒细胞膜工程人参根来源的外泌体负载 miRNA182-5p靶向NOX4/Drp-1/NLRP3信号通路以减轻脓毒症急性肺损伤
中性粒细胞膜工程人参根来源的外泌体负载miRNA 182-5p 靶向 NOX4/Drp-1/NLRP3 信号通路以减轻脓毒症急性肺损伤:实验研究

引用格式:Ma C, Liu K, Wang F, et al. Neutrophil membrane-engineered Panax ginseng root-derived exosomes loaded miRNA 182-5p targets NOX4/Drp-1/NLRP3 signal pathway to alleviate acute lung injury in sepsis: experimental studies. Int J Surg. 2024;110(1):72-86. Published 2024 Jan 1. doi:10.1097/JS9.0000000000000789
摘要
研究的目的是制备中性粒细胞膜工程人参根源性外泌体(N-exo)并研究N-exo-miRNA 182-5p在脓毒症引起的急性肺损伤(ALI)中的作用机制。
通过差速离心分离人参根来源的外泌体,对其进行中性粒细胞膜工程,从而得到N-exo。通过电穿孔技术将miRNA182-5p转入N-exo中,得到N-exo-miRNA 182-5p,采用脂多糖LPS建立脓毒症ALI体内外模型,评价N-exo-miRNA 182-5p的抗炎作用。结果显示:与exo相比,N-exo中miRNA182-5p的水平显着增加。,实验结果表明,N-exo-miRNA 182-5p通过体内外靶点调节NOX4/Drp-1/NLRP3信号通路显着改善ALI。
总之,研究制备了一种新型工程化外泌体(N-exo和N-exo-miRNA 182-5p),通过靶向调控NOX4/Drp-1/NLRP3信号通路,显着改善脓毒症中的ALI,为脓毒症的ALI治疗提供了新的思路和方法。
背景
脓毒症是宿主对感染反应失调引起的一种多器官功能障碍,严重威胁人类健康。当脓毒症发生多器官衰竭时,肺部非常容易受到损伤。引起ALI的原因有很多,包括感染、血管疾病、药物作用、休克、嗜酸性粒细胞性肺炎、免疫介导的肺出血和血管炎、放射性肺炎等。虽然目前的支持治疗、呼吸机和适当的抗生素可以在一定程度上缓解病情进展,但临床死亡率仍高达25%~40%。因此,寻找治疗脓毒症ALI的有效方法非常重要。
MicroRNA(miRNA)是一类内源基因,参与动植物转录后基因表达的调控。MicroRNA通过三种方式作用于靶基因,一是切断靶基因的mRNA分子,二是抑制靶基因的翻译,第三是结合抑制。有文献研究表明miRNA182-5p是脓毒症及其并发症的重要调节因子,它也是脓毒症早期诊断的生物标志物。
外泌体(exo)具有独特的形态和组成特征,其中携带了母细胞的蛋白质、脂质、DNA、非编码RNA等特征生物分子,具有天然的生物学特性和良好的生物相容性。近年来,外泌体的研究发展迅速,但植物外泌体的研究还处于初步阶段,有研究表明人参因其抗癌、抗炎、抗氧化等药理作用,关于人参根中皂苷、多糖等成分的研究较多,但这些成分的生物利用度很低。为了解决这一问题,在植物制剂的研究中,逐渐将重点放在新型药物递送系统的开发上,如脂质体、外泌体、纳米颗粒等。因此,本研究的目的是制备中性粒细胞膜工程人参根源性外泌体(N-exo)并研究N-exo-miRNA 182-5p对ALI的影响。
结果
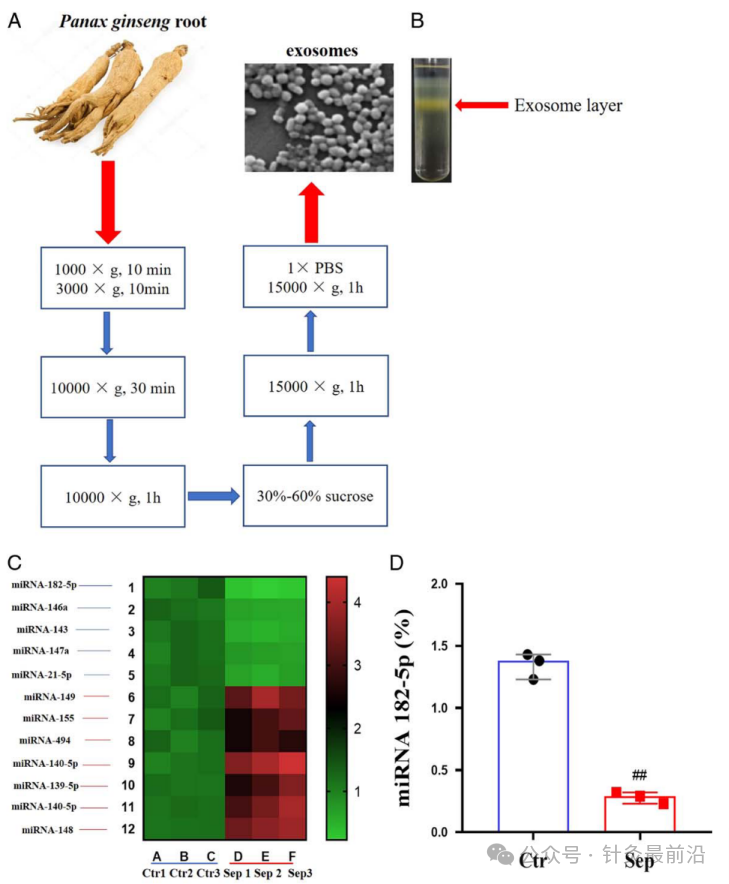
3.1脓毒症患者与健康人血浆miRNA差异分析
为了利用miRNA芯片检测ALI脓毒症患者与健康人血浆miRNA的差异。首先从人参根中提取并分离出外泌体(图1A、B)。之后检测了12个在ALI脓毒症患者和健康人中差异表达的miRNAs,其中miRNA182-5p则显著下调水平最高。因此,miRNA 182-5P是此次研究的重点(图1C)。为进一步证实ALI脓毒症患者血浆中miRNA182-5p的表达下调,采用聚合酶链式反应技术检测了ALI脓毒症患者和健康人血浆中miRNA182-5p的表达。结果表明,ALI脓毒症患者血浆中miRNA182-5p的表达明显低于正常人(图1D)。
图1
3.2 搜索 miRNA 182-5p 靶基因
首先使用miRBase和Targetscan软件进行生物信息学分析,在NOX4 mRNA中发现了miRNA 182-5p的潜在靶标(图2A)。
继续为了验证NOX4 mRNA水平的变化,分别研究了ALI脓毒症患者、LPS诱导的MLE-12细胞和LPS诱导的ALI小鼠中NOX4基因的表达,结果发现,ALI脓毒症患者、LPS处理的MLE-12细胞和LPS诱导的ALI小鼠中NOX4 mRNA水平皆显著升高(图2B-D)。
之后验证了在不同条件下的miRNA182-5p表达水平,NOX4-wt + miRNA 182-5p的双荧光素酶活性显着降低,突变体组的双荧光素酶活性没有显著变化(图2E-G)。
进一步检测NOX4的表达,结果显示ALI脓毒症患者、LPS处理的MLE-12细胞和LPS诱导的ALI小鼠中NOX4的水平显着升高(图2H-J)。通过以上数据,表明miRNA 182-5p的表达与NOX4的表达呈负相关(图2K-M)。
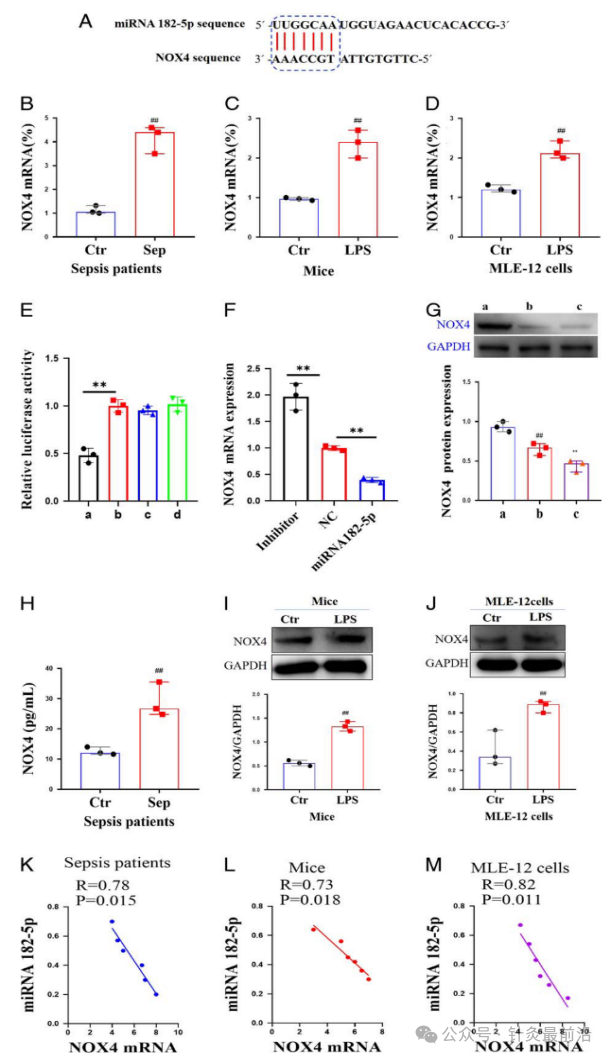
图2
Drp-1是调节线粒体功能的重要蛋白质,通过免疫沉淀检测实验证实确认NOX4和Drp-1蛋白之间的相互结合作用(图3A-B)。
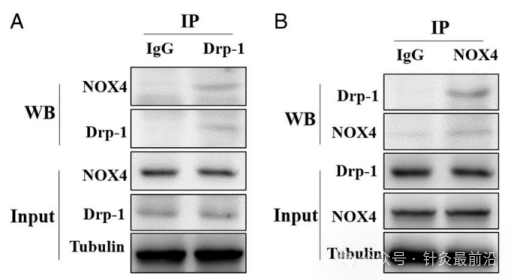
图3
3.3 N-exo与exo的对比
两者之间的对比主要是从表征、标记蛋白、两者中的miRNA对 fMLP趋化因子(N-甲酰基-l-甲硫酰基-l-亮氨酰-l-苯丙氨酸)响应结果三个方面来进行分析。
首先通过TME观察对比N-exo和exo的表征结构(图4A),通过NTA粒径分析N-exo的纳米粒子追踪分析(图4B)。之后通过western blot检测exo标记蛋白的表达,结果显示CD63、CD9和TSG101高表达,发现N-exo与exo表面标志物的特征一致(图4C)。最后分别检测了添加以及未添加fMLP情况下,N-Exo-miRNA182-5p 和 Exo-miRNA182-5p的反应,结果表明未添加fMLP时发现两者之间没有显著差异 (图4D)。但是添加fMLP时发现miRNA 182-5p的水平显着高于没有fMLP的水平 (图4E)。
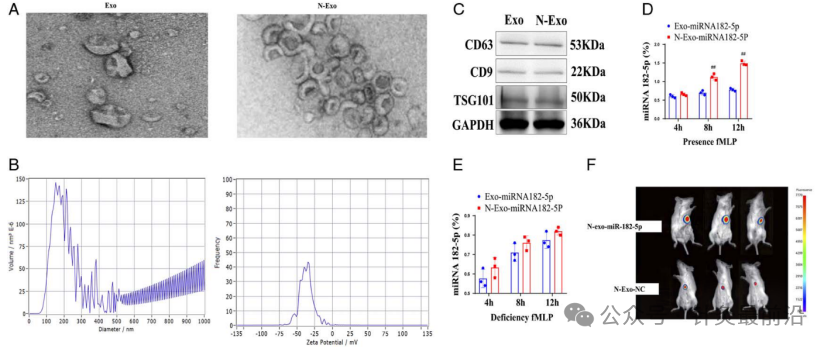
图4
3.4 N-exo-miRNA 182-5p 对脓毒症ALI小鼠氧化应激的影响
为了继续验证N-exo-miRNA 182-5p 对脓毒症ALI小鼠的机制,分别测量了肺干湿比测量(w/d)、活性氧 (ROS)、髓过氧化物酶(MPO) 、丙二醛(MDA)、超氧化物歧化酶(SOD)以及谷胱甘肽过氧化物酶(GSH-px)的检测指标。
与LPS组相比,N-exo-NC和N-exo-miRNA 182-5p显着降低了w/d、ROS和MPO的水平。而与 N-exo-NC 相比,N-exo-miRNA 182-5p 更显着降低 w/d、ROS 和 MPO 水平(图5A-D)。
同样,与LPS组相比,N-exo-NC 和 N-exo-miRNA 182-5p 显着降低了MDA 水平,并增加了 SOD 和 GSH-px 的水平。而与N-exo-NC相比,N-exo-miRNA 182-5p更显着降低血清和肺中的MDA水平并增加SOD和GSH-px水平(图5E-J)。
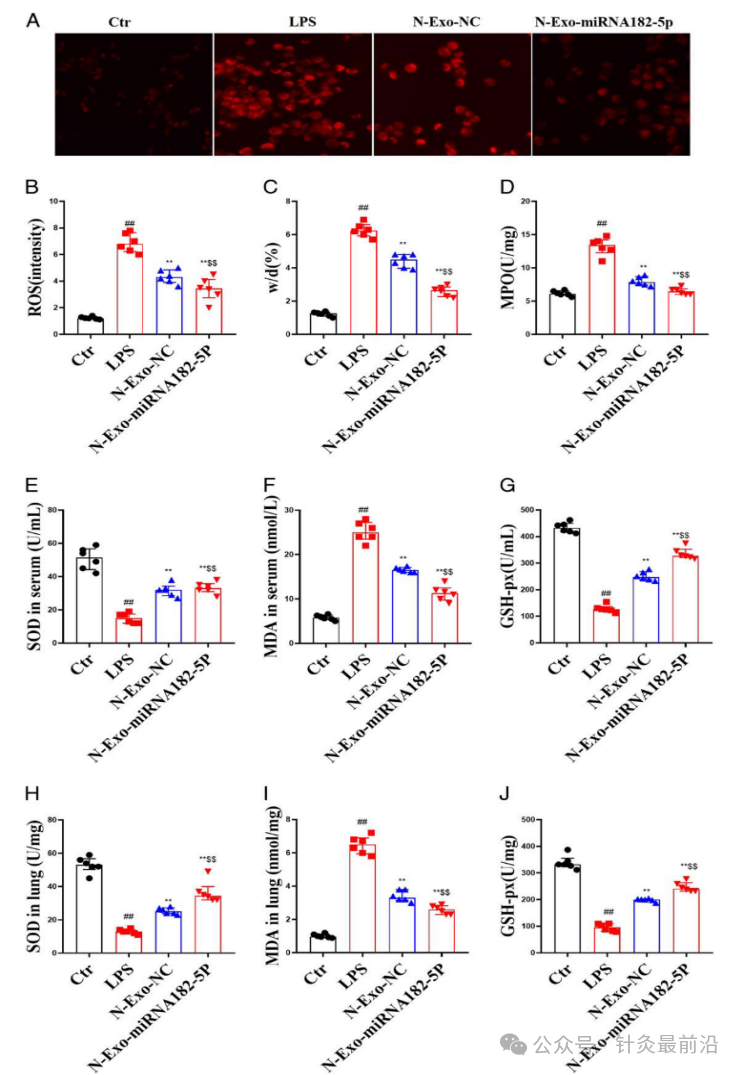
图5
3.5 N-exo-miRNA 182-5p 对脓毒症 ALI 小鼠肺组织病理学和肺部炎症的影响
病理评估是脓毒症ALI的金指标,采用HE染色评估肺部病理变化(图6A)。与LPS组中的肺部炎症变化相比,N-exo-NC和N-exo-miRNA 182-5p显著改善了肺部炎症变化,并且与N-exo-NC相比,N-exo-miRNA 182-5p更显著改善炎症变化。
为了评价炎症反应,分别检测了脓毒症ALI小鼠血清中(图6B-D)以及肺中炎性细胞因子(TNF-α、IL-1β和IL-6)(图6E-G)。与对照组相比,脓毒症ALI小鼠血清中和肺中的TNF-α、IL-1β、IL-6水平升高。与LPS组相比,N-exo-NC和N-exo-miRNA 182-5p显著降低血清和肺组织中TNF-α、IL-1β、IL-6的水平。而与N-exo-NC相比,N-exo-miRNA 182-5p也显著降低了血清和肺中TNF-α、IL-1β、IL-6的水平。
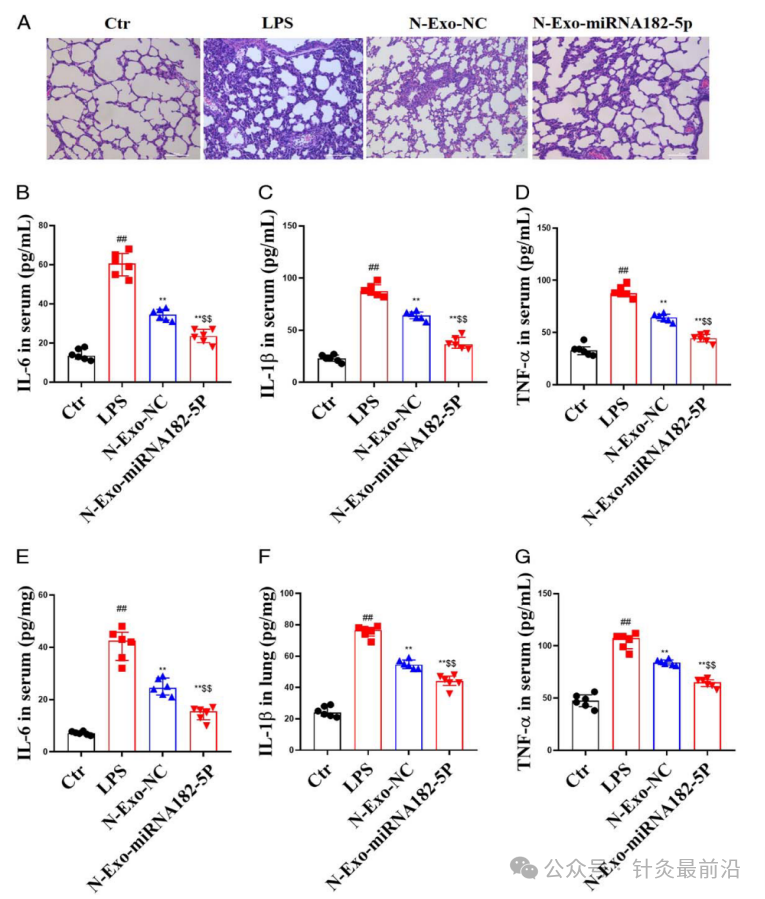
图6
3.6 N-exo-miRNA 182-5p对脓毒症小鼠NOX4/Drp-1/NLRP3通路的影响
对于N-exo-miRNA 182-5p对脓毒症小鼠NOX4/Drp-1/NLRP3通路的影响,主要测定了NADPH 氧化酶4(NOX4)、动力蛋白相关蛋白 1(p-Drp-1)、NOD样受体热蛋白结构域相关蛋白3(NLRP3)、凋亡相关斑点样蛋白(ASC)、含半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1)和白介素-1β(IL-1β)的水平。
与对照组相比,LPS组NOX4、p-Drp-1、NLRP3、ASC、Caspase-1和IL-1β水平升高;与LPS组相比,N-exo-NC和N-exo-miRNA 182-5p显著降低NOX4、p-Drp-1、NLRP3、ASC、Caspase-1和IL1β的水平。而与N-exo-NC相比,N-exo-miRNA 182-5p更显著降低NOX4、p-Drp-1、NLRP3、ASC、Caspase-1和IL-1β的水平(图7A-G)。同样在肺中 NOX4 的免疫组织化学实验中,N-exo-NC和N-exo-miRNA 182-5p显着降低了脓毒症ALI小鼠中NOX4的水平。而与N-exo-NC相比,N-exo-miRNA 182-5p更显着地降低了NOX4的水平(图7H)。
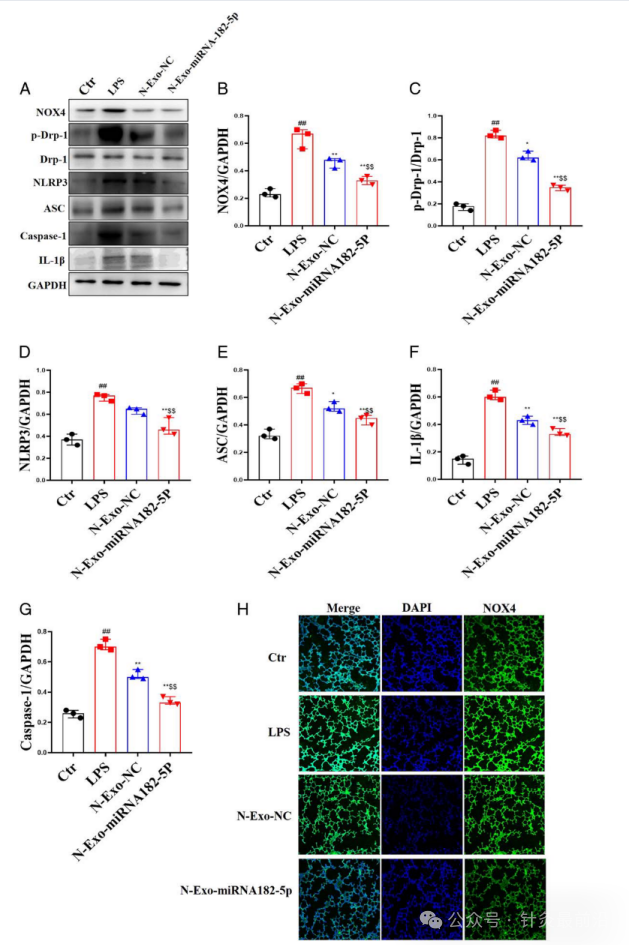
图7
3.7 N-exo-miRNA 182-5p对LPS 处理的MLE-12细胞氧化应激和细胞因子的影响
N-exo-miRNA 182-5p对LPS 处理的MLE-12细胞氧化应激方面主要测定了MDA(丙二醛)和GSH-px(谷胱甘肽过氧化物酶)。与对照组相比,LPS组MDA水平升高,SOD和GSH-px水平显着降低;与LPS组相比,N-exo-NC 和 N-exo-miRNA 182-5p 显着降低 MDA 水平,增加 SOD 和 GSH-px 水平;与N-exo-NC相比,N-exo-miRNA 182-5p更显着降低LPS处理的MLE-12细胞中MDA的水平并增加SOD和GSH-px的水平(图8A-C)。
N-exo-miRNA 182-5p 对 LPS 处理的 MLE-12 细胞中细胞因子方面主要测定了TNF-α、IL-1β、IL-6(肿瘤坏死因子α、白介素-1β、白介素-6)的炎性水平。与对照组相比,LPS组升高了TNF-α、IL-1β、IL-6的水平;与LPS组相比,N-exo-NC和N-exo-miRNA 182-5p显著降低LPS处理的MLE-12细胞中TNF-α、IL-1β、IL-6的水平;与N-exo-NC相比,N-exo-miRNA 182-5p 更显著降低 LPS 处理的 MLE-12 细胞中 TNF-α、IL-1β、IL-6 的水平(图8D-F)。
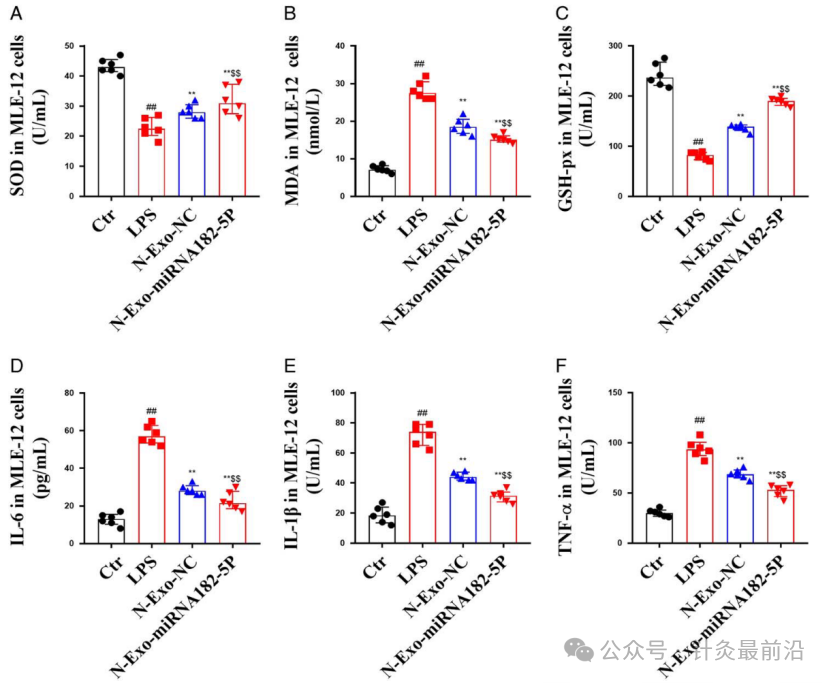
图8
3.8 N-exo-miRNA 182-5p 对 LPS 处理的 MLE-12 细胞中 NOX4/Drp-1/NLRP3 通路的影响
对于N-exo-miRNA 182-5p 对 LPS 处理的 MLE-12 细胞中 NOX4/Drp-1/NLRP3 通路的影响,主要测定了NOX4、p-Drp-1、NLRP3、ASC、Caspase-1和IL-1β的水平。
与对照组相比,LPS组NOX4、p-Drp-1、NLRP3、ASC、Caspase-1和IL-1β水平显着升高。与LPS组相比,N-exo-NC和N-exo-miRNA 182-5p显著降低了NOX4、p-Drp-1、NLRP3、ASC、Caspase-1和IL-1β的水平。与N-exo-NC相比,N-exo-miRNA 182-5p 更显著降低 NOX4、p-Drp-1、NLRP3、ASC、Caspase-1 和 IL-1β 的水平(9A-G)。在肺中NOX4的免疫荧光实验中,与LPS组相比,N-exo-NC和N-exo-miRNA 182-5p显著降低了NOX4的水平;与N-exo-NC相比,N-exo-miRNA 182-5p更显著地降低了NOX4的水平(图9H)。
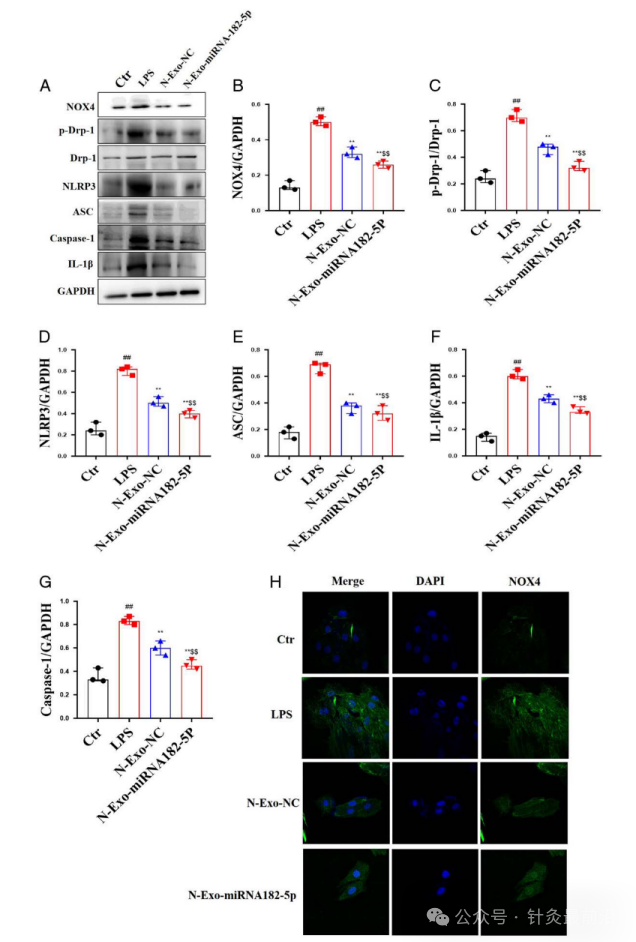
图9
3.9 N-exo-miRNA 182-5p对 LPS 处理的 MLE-12 细胞线粒体功能的影响
N-exo-miRNA 182-5p对 LPS 处理的 MLE-12 细胞线粒体功能的影响,主要测定了线粒体的耗氧率(OCR)、线性形态、线粒体膜电位(MMP)三个方面。
在线粒体OCR方面,与对照组相比,LPS刺激降低了MLE-12细胞的OCR;与LPS组相比,N-exo-NC和N-exo-miRNA 182-5p显著增加了LPS处理的MLE-12细胞的OCR;与N-exo-NC相比,N-exo-miRNA 182-5p更显着地增加了LPS处理的MLE-12细胞的OCR(图10A-B)。
在用共聚焦显微镜观察线粒体形态方面,与对照组相比,内毒素组大鼠肝细胞线粒体百分率明显增加;与LPS组相比,N-exo-NC和N-exo-miRNA182-5p显著增加线粒体线性形态;与N-exo-NC相比,N-exo-miRNA182-5p更显著地增加了线粒体线性形态(图10C)。
在线粒体MMP方面,与对照组相比,LPS组MMP显着升高;与LPS组相比,N-exo-NC和N-exo-miRNA 1825p显著降低MMP;;与N-exo-NC相比,N-exo-miRNA 182-5p更显著降低MMP(图10D)。
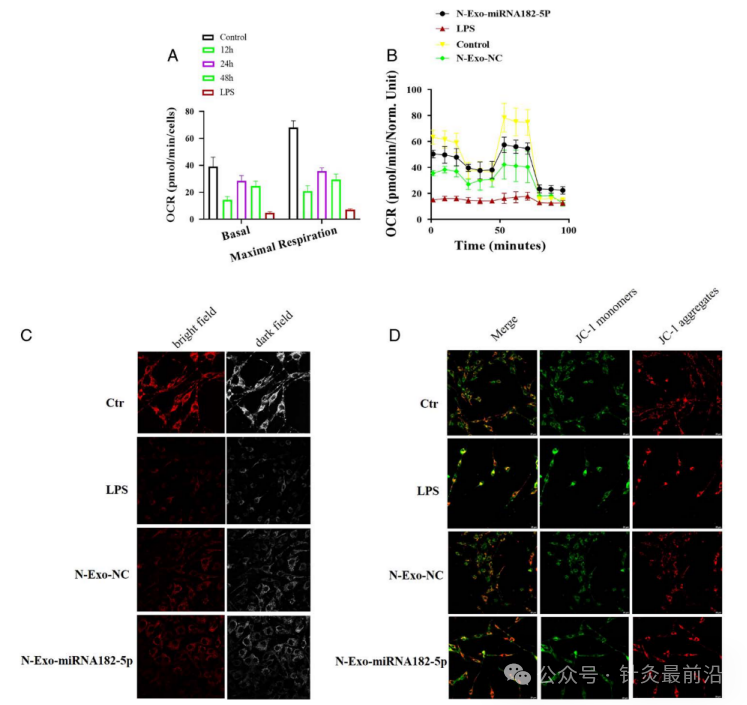
图 10
结果与讨论
脓毒症中ALI的病理机制较为复杂,目前,脓毒症ALI的有效防治策略仍然是当前的重点和难点问题。在这项研究中,制备了一种新型工程外泌体 (N-exo) 和 N-exo-miRNA 182-5p 来治疗脓毒症中的 ALI。发现N-exo-miRNA182-5p通过抑制Nox4/Drp-1/NLR3信号通路显着改善脓毒症中的ALI。该研究为脓毒症ALI的临床治疗提供了一种新的治疗方法。
但本研究存在一定局限性:(1)ALI脓毒症患者样本量较小,后期需要大规模研究。(2)本研究仅建立了LPS诱导的脓毒症ALI模型,未建立盲肠结扎诱导的脓毒症ALI模型。(3)本研究未对脓毒症ALI中的NOX4进行敲除和沉默。
编辑:李昕洋
排版:郑雅蔓
初审:陈波
审核:郭永明
链接:http://www.lewenyixue.com/2024/05/15/%E4%B8%AD%E6%80%A7%E7%B2%92%E7%BB%86%E8%83%9E%E8%86%9C%E5%B7%A5%E7%A8%8B%E4%BA%BA%E5%8F%82%E6%A0%B9%E6%9D%A5%E6%BA%90%E7%9A%84%E5%A4%96%E6%B3%8C%E4%BD%93%E8%B4%9F%E8%BD%BD%20/