
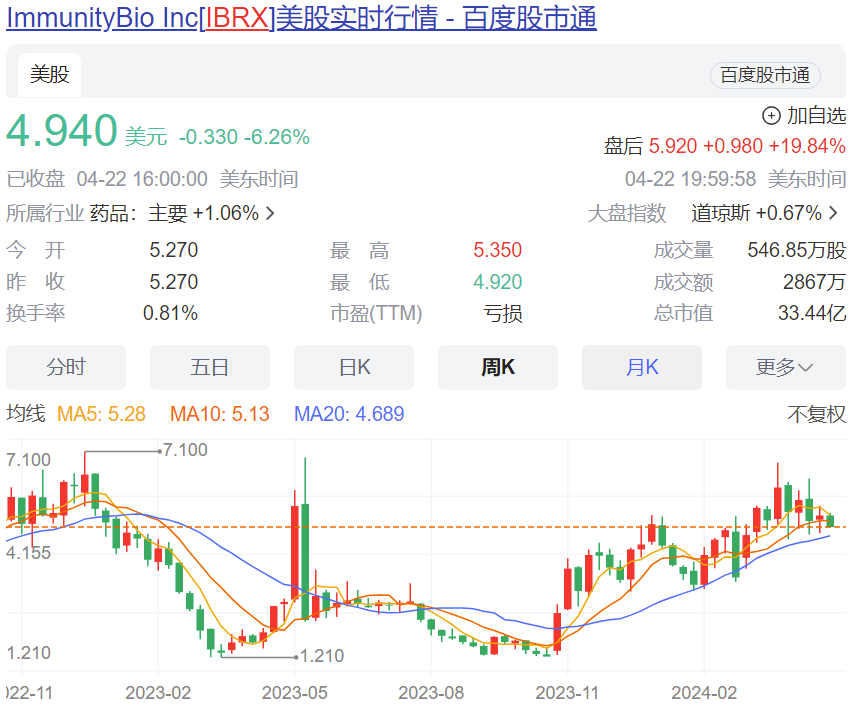
4月22日, ImmunityBio 宣布其 IL-15 细胞因子药物 Nogapendekin alfa inbakicept-pmln (商品名 Anktiva, 分子名 N-803 )已被 FDA 批准与卡介苗(BCG)联用,用于治疗卡介苗单用无应答的非肌肉浸润性膀胱癌伴原位癌( NMIBC ),伴或不伴乳头状肿瘤。
受此消息鼓舞,ImmunityBio 公司的股价在盘后暴涨 20%,市值超过 40亿美元。
至此,停滞近30年的肿瘤细胞因子免疫疗法终于迎来重大突破。而下一个尽在咫尺、值得期待的肿瘤细胞因子疗法的突破,可能要看 Philogen S.p.A 公司开发多年的免疫因子组合(IL-2-L19+TNF-α-L19)在黑色素瘤中的数据是否能得到 FDA 认可了。( 推荐阅读: 免疫细胞因子疗法在实体肿瘤中迎来新突破,三期临床试验达到主要终点! )
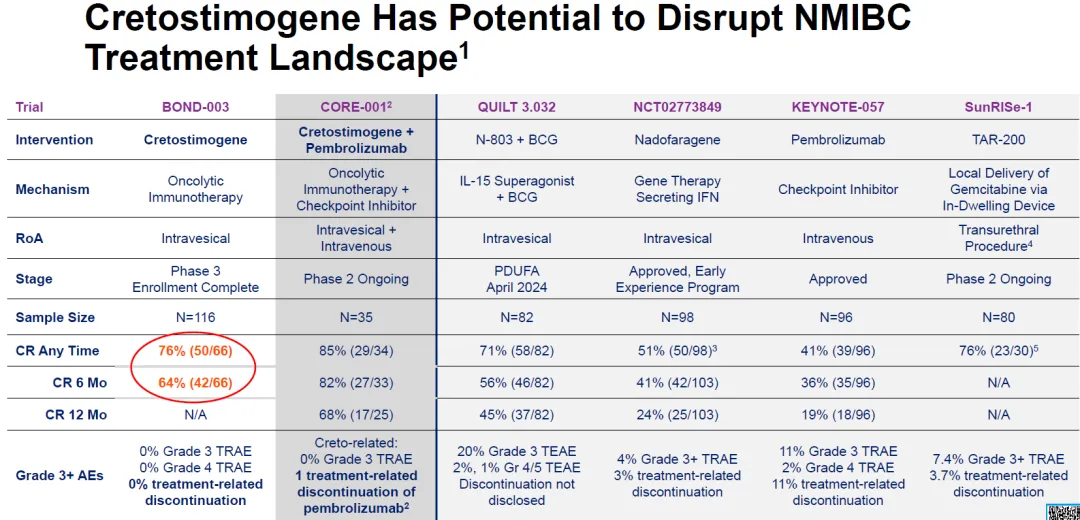
此次 FDA 的批准是基于 QUILT-3.032 试验 (NCT0302285) 的结果。在这项单臂、多中心临床研究中,研究人员评估了 77例经尿道切除术后伴有或不伴有 Ta/T1乳头状病变的 BCG 无反应性、高风险 NMIBC 原位癌患者对联合疗法的治疗响应。
在这项试验中,患者接受 Anktiva 诱导治疗,并通过膀胱内灌注卡介苗,然后进行长达 37个月的维持治疗。
研究人员每 3个月通过膀胱镜检查和尿液细胞学检查评估肿瘤状态,持续时间长达 2年。此外,在开始治疗后的前 6个月内,需要随机或膀胱镜指导下的活检。随后采用患者所在社区的医疗标准对患者进行评估。
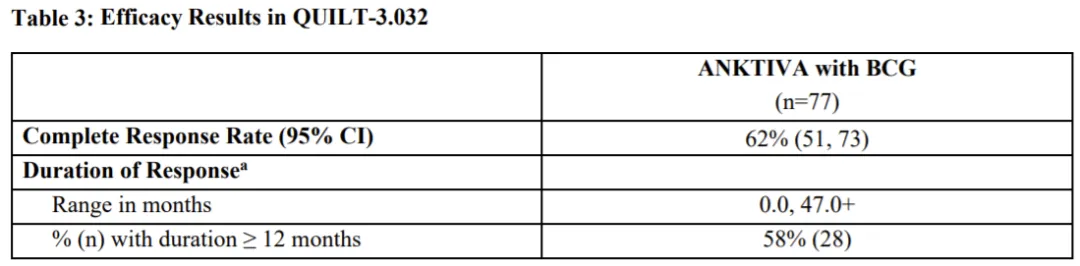
QUILT-3.032 试验的主要疗效指标之一是任何时候的完全缓解 (CR),定义为膀胱镜检查 (如适用) 和尿细胞学检查 (如适用) 阴性。反应持续时间 (DOR) 则是另一个主要疗效指标。
该试验的完全缓解率(CR)为 62% (95% CI, 51%-73%)。值得注意的是,58% 的 CR 患者 DOR 至少维持了 12个月,40% 的患者 DOR 至少维持了 24个月。

最常见的不良反应(发生在至少 15%的患者中),包括排尿困难、肌酐水平升高、血尿、尿急、尿频、钾水平升高、尿路感染、寒战、肌肉骨骼疼痛和发热。
根据 FDA 发布的消息, Anktiva 的推荐剂量为 400微克 (400 μg),每周 1次与卡介苗一起膀胱内灌注,连续 6周作为 诱导治疗 。如果在第 3个月 CR 未达到,则可进行第二次诱导周期。诱导治疗后的维持可包括 400 μg Anktiva 与 BCG 一起 膀胱内灌注 ,在第4、7、10、13 和 19个月,每周 1次,持续 3周,共15次。
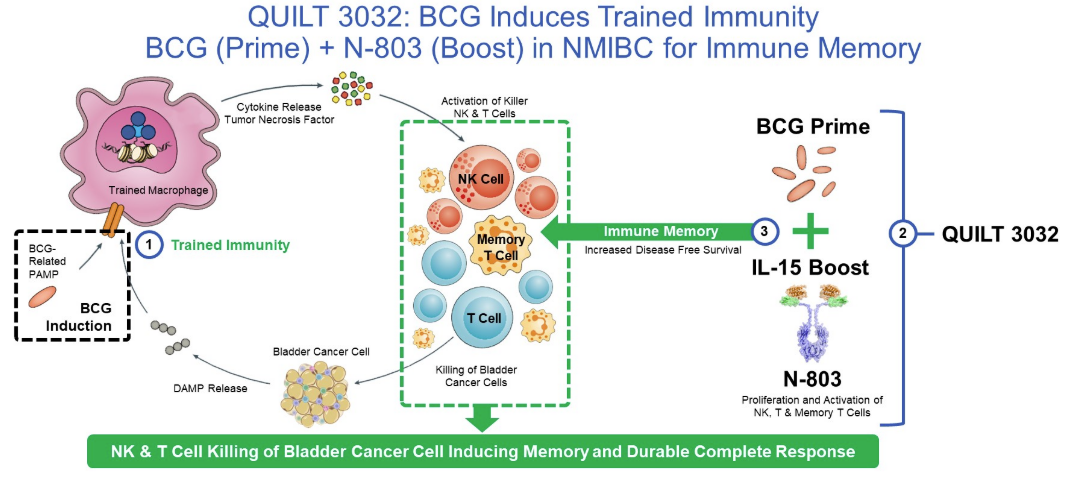
临床QUILT 3032给药方案:采用卡介苗预激给药,N-803继续治疗(局部给药,膀胱内给药)的临床方案。
对于 25个月后出现持续 CR 的患者,可在第 25、31和 37个月每周进行一次卡介苗维持注射,持续 3周,最多可进行 9次额外注射。根据 FDA 的规定,如果在第二次诱导后疾病仍然存在、不可接受的毒性或疾病复发或进展,则应停止治疗, Anktiva 的最长治疗时间为 37个月。
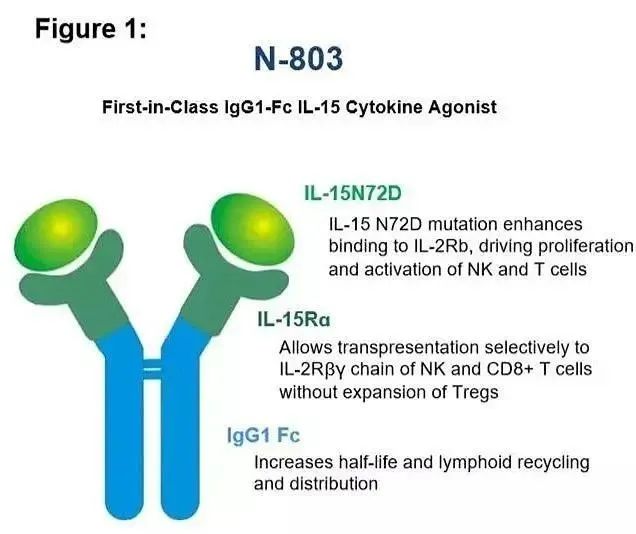
Nogapendekin alfa inbakicept-pmln ( Anktiva ) 是一种白细胞介素-15 (IL-15) 受体的超级激动剂,由 IL-15 活性增强突变体和 IL-15Rα-Fc 高特异性结合而形成复合物。也就是说, N-803 的结构为 IL-15/IL-15Rα-Fc 融合蛋白。结构中的 IL-15/IL-15Rα 负责激动 NK、CD8+ T 细胞,Fc 负责延长 Anktiva 的半衰期。
根据处方信息, Anktiva 适用于卡介苗联合的剂量为 400 μg/0.4 mL,为透明至微乳白色和微黄色的单剂量小瓶溶液。虽然 Anktiva 没有禁忌症,但有一个警告,指出延迟膀胱切除术可能导致转移性膀胱癌。
ImmunityBio 执行主席兼全球首席科学和医疗官 Patrick Soon-Shiong 医学博士在 2024年4月22日的新闻发布会上说: “FDA 批准 Anktiva 标志着我们推出了超越检查点抑制剂的下一代免疫疗法”。
“Anktiva 不仅可以增殖激活患者自身的 NK 细胞和 CD8+ 杀伤性 T 细胞,还可以激活 CD4+ T 辅助细胞,从而增强记忆性杀伤性 T 细胞的增殖。”
“这种新的作用机制,模拟了树突状细胞的生物学过程,启动了免疫疗法的进化,而不仅仅是 T 细胞。”
Soon-Shiong博士补充说:“我们相信,通过协调固有和适应性免疫系统并推动长期完全缓解, Anktiva 有潜力在未来几年作为多种肿瘤类型的免疫治疗超越检查点发挥关键作用。”
细胞因子是免疫细胞系统的重要交流系统之一,多种细胞因子可以帮助免疫细胞的成熟、激活和扩增,从而建立起有效的抗感染和抗肿瘤免疫反应。
IFN 和 IL-2 等细胞因子很早就被科学家发现,并在动物模型种被证明具有显著的抗肿瘤效应。在基因工程技术技术成熟之后,重组细胞因子的出现终于允许人体临床试验的开展,并很快催生了第一代免疫疗法的获批——IFNα 和 IL-2 在90年代相继被 FDA 批准用于转移性肾癌和黑色素瘤等肿瘤治疗。
但是 IFN-α 和 IL-2 的抗肿瘤疗效都依赖于极高的给药剂量,这种高剂量依赖性也伴随着多种严重的副反应。由于治疗窗口狭窄、副作用严重、响应率亦不如新兴的免疫疗法,因此 IFN-α 和 IL-2 高剂量疗法已经逐步淡出临床肿瘤治疗的主流方法。
本次 N-803 的获批,可以说是肿瘤领域细胞因子疗法的一次"复苏",也代表着细胞因子疗法在 局部给药方法路线 上的成功。结合 Philogen S.p.A 公司已经完成III期临床试验的免疫因子组合(IL-2-L19+TNF-α-L19)在黑色素瘤中的疗效数据,或许可以预期未来 局部给药途径 还会迎来更多的好消息。
不过 N-803 的上市也是一波三折。2022年7月,N-803 首次递交上市申请,2023年5月,却因为第三方合同生产问题收到 FDA 的完全回复函拒绝批准。2023年10月,N-803 在解决生产问题之后重新递交上市申请,此番终于顺利通过 FDA 日益严格的审核而获批上市。
值得一提的是,2024年1月,ImmunityBio 完成来自 Oberland Capital 的 3.2亿美元 RIPA 投资,即 Royalty Finance 模式。一期出资 2亿美元,获得 Anktiva 3-7% 的销售分成权益,二期出资 1亿美元,执行后将获得 4.5-10% 的销售分成。此外,还对公司进行 2000万美元股权投资。
总之,N-803的获批成为肿瘤细胞因子疗法赛道的一个里程碑事件,代表着 局部给药路径 在肿瘤细胞因子疗法领域的巨大临床价值。此外,NMIBC 这种允许局部给药的肿瘤类型也成为新型免疫疗法的热门赛道。除细胞因子外,CG Oncology 的溶瘤病毒疗法 CG0070 取得了更加优异的临床数据, FDA 同时授予其突破疗法认证和快速通道资格,乐普生物此前引进 CG0070 的大中华区权益。
在 IL-15 赛道中,还有多家企业在快速跟进。国外企业包括 Pfizer、SOTIO Biotech等,国内包括恒瑞医药(SHR-1501)、荣昌生物 (RC198)等。随着 N-803 取得决定性的成功,其他公司和所开发的分子应该都会按下加速键了。
1. FDA approves nogapendekin alfa inbakicept-pmln for BCG-unresponsive non-muscle invasive bladder cancer. News release. FDA. April 22, 2024. Accessed April 22, 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-nogapendekin-alfa-inbakicept-pmln-bcg-unresponsive-non-muscle-invasive-bladder-cancer
2. Nogapendekin alfa inbakicept-pmln. Altor BioScience, LLC. April 2024. Accessed April 22, 2024. https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/761336s000lbl.pdf
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/04/26/%E8%82%BF%E7%98%A4%E7%BB%86%E8%83%9E%E5%9B%A0%E5%AD%90%E7%96%97%E6%B3%95%E5%81%9C%E6%BB%9E%E8%BF%9130%E5%B9%B4%E5%90%8E%E8%BF%8E%E6%9D%A5%E9%87%8D%E5%A4%A7%E8%BF%9B/









