Nature|神经元与脑瘤“对话”新发现:镇静药物或加速脑瘤生长
高分级胶质瘤(HGGs)是脑癌相关死亡的首要原因,其中弥漫性中线胶质瘤(DMG)尤其凶险。这类肿瘤多发生于儿童脑干、丘脑等中线结构,携带H3K27M基因突变,患者中位生存期仅11-13个月,且治疗选择极为有限。
过去的研究发现,神经元活动可通过释放谷氨酸等信号分子促进胶质瘤生长。然而,另一种常见的神经递质——γ-氨基丁酸(GABA,通常起抑制作用)是否参与这一过程,此前尚不明确。
近日,斯坦福大学 Michelle Monje 团队在 Nature 发表题为 GABAergic neuron-to-glioma synapses in diffuse midline gliomas 的重磅研究, 首次揭示了DMG中存在功能性GABA能神经元-肿瘤突触,与谷氨酸能突触类似,GABA能突触同样能够促进DMG的生长和增殖。研究同时也发现常用镇静药劳拉西泮(Lorazepam)可能加速这类肿瘤的生长。

研究者获取的肿瘤细胞源于DMG患者的肿瘤组织(携带H3K27M突变)以及IDH野生型半球性胶质瘤组织。单细胞RNA测序显示,DMG细胞高表达GABA受体亚基(如α3、β3、γ2)及突触后蛋白(如gephyrin),而IDH野生型胶质瘤中这些基因表达极低。通过免疫电镜和共聚焦显微镜观察这些蛋白结构,GABA能神经元的突触前标记(如VGAT)与DMG细胞的突触后标记(如GABRG2、gephyrin)直接对接,形成结构性突触。在形态和特征上,这种结构都与正常神经元之间的突触相似。

DMG 中结构性 GABA 能神经元 - 胶质瘤突触
至于GABA能神经元促进肿瘤生长的机制,研究者们认为是 刺激GABA能神经元可在40%的DMG细胞中诱发去极化反应(类似“激活”效应),进而促进肿瘤增殖。 DMG细胞能高表达NKCC1氯离子转运蛋白,让DMG细胞内维持高浓度的氯离子水平。电生理数据显示,DMG细胞的GABA电流反转电位为-25.0±3.7 mV和-20.7±4.9 mV(IDH细胞为-61.3±7.9 mV),根据Nernst方程,推断出DMG细胞内的氯离子浓度约为51 mM和60 mM,远高于IDH细胞(约13 mM)。而且在使用NKCC1抑制剂后,DMG细胞的EGABA发生了显著变化,从-25.0±3.7 mV变为-57.2±7.4 mV。
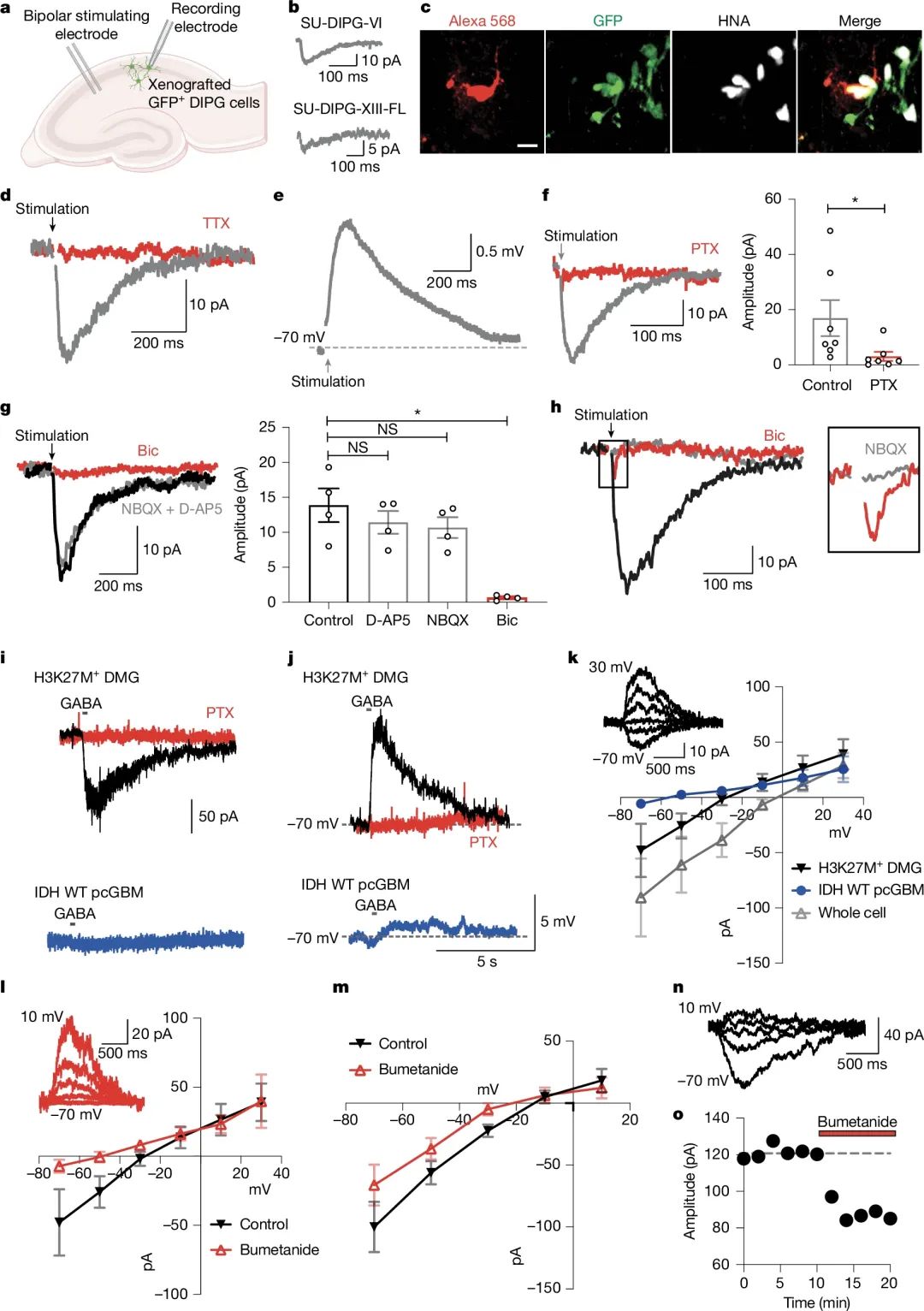
DMG 中去极化的 GABA 能神经元 - 胶质瘤突触
这说明开发 GABA 通路抑制剂(如 NKCC1 阻断剂)有望成为致命性脑肿瘤治疗药物的新方向。当然,鉴于带有H3K27M突变DMG细胞和IDH细胞在实验中表现完全不一样,药物的研发还需要区分肿瘤分子不同的亚型。
动物模型实验中,研究者还发现劳拉西泮(一种常见的镇静药物,能够与GABAA受体的β亚基结合,会增强GABA受体敏感性)存在剂量依赖性,高剂量(8mg/kg)下会使DMG细胞增殖率增加2倍,小鼠的生存期显著缩短(P=0.0495,Mantel-Cox检验);而IDH野生型胶质瘤对此无反应。
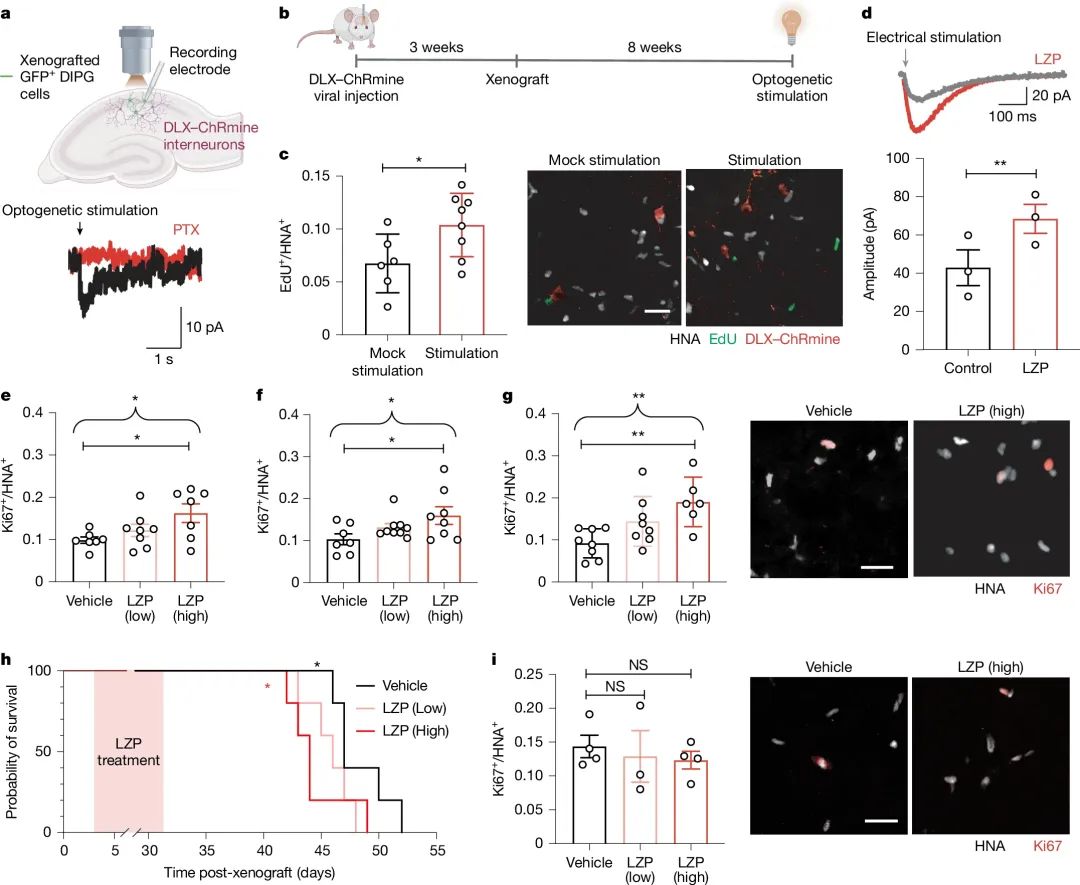
GABA 能信号驱动 DMG 增殖
这对脑瘤患者的临床用药具有重要指导意义。尤其对于 DMG 患儿,在非必需情况下避免高剂量使用或用其他药物替代。
神经元与脑瘤细胞基于电信号的复杂“沟通”方式,也再次证实,脑瘤并非孤立生长,而是会因地制宜,利用周边正常的细胞环境为自己“铺路搭桥”。后续研究者们可能会顺着这个方向去探索其他亚型的脑瘤组织是否具有相似机制,或者继续深入挖掘GABA信号调控肿瘤细胞周期的细节。
本次研究不仅揭示了DMG生长的新型神经生理机制,为致命性儿童脑瘤提供了全新的治疗靶点,还强调了胶质瘤亚型特异性在用药策略制定中的重要性。 对于临床工作者而言,可能需要重新评估某些常用药物(如苯二氮䓬类药物)的使用风险。人生有涯,而对抗癌症的征程漫漫,每个细胞级别的突破看似微小,但我们要相信总有一次突破会成为攻克癌症的关键。
撰文

责编

制作
排版 | Sheila 校对 | uu
延伸阅读
脑瘤调控癌细胞和神经元之间“对话”的新机制
DMG肿瘤细胞调节它们与神经元相互作用的内在机制
▼滑动查看更多▼
High-grade gliomas (HGGs) are the leading cause of brain cancer-related death. HGGs include clinically, anatomically and molecularly distinct subtypes that stratify into diffuse midline gliomas (DMGs), such asH3K27M -altered diffuse intrinsic pontine glioma, and hemispheric HGGs, such as IDH wild-type glioblastoma. Neuronal activity drives glioma progression through paracrine signalling 1,2 and neuron-to-glioma synapses 3,4,5,6 . Glutamatergic AMPA receptor-dependent synapses between neurons and glioma cells have been demonstrated in paediatric 3 and adult 4 high-grade gliomas, and early work has suggested heterogeneous glioma GABAergic responses 7 . However, neuron-to-glioma synapses mediated by neurotransmitters other than glutamate remain understudied. Using whole-cell patch-clamp electrophysiology, in vivo optogenetics and patient-derived orthotopic xenograft models, we identified functional, tumour-promoting GABAergic neuron-to-glioma synapses mediated by GABA A receptors in DMGs. GABAergic input has a depolarizing effect on DMG cells due to NKCC1 chloride transporter function and consequently elevated intracellular chloride concentration in DMG malignant cells. As membrane depolarization increases glioma proliferation 3,6 , we found that the activity of GABAergic interneurons promotes DMG proliferation in vivo. The benzodiazepine lorazepam enhances GABA-mediated signalling, increases glioma proliferation and growth, and shortens survival in DMG patient-derived orthotopic xenograft models. By contrast, only minimal depolarizing GABAergic currents were found in hemispheric HGGs and lorazepam did not influence the growth rate of hemispheric glioblastoma xenografts. Together, these findings uncover growth-promoting GABAergic synaptic communication between GABAergic neurons andH3K27M -altered DMG cells, underscoring a tumour subtype-specific mechanism of brain cancer neurophysiology.
DOI: 10.1038/s41586-024-08579-3
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2025/03/26/Nature%EF%BD%9C%E7%A5%9E%E7%BB%8F%E5%85%83%E4%B8%8E%E8%84%91%E7%98%A4%E2%80%9C%E5%AF%B9%E8%AF%9D%E2%80%9D%E6%96%B0%E5%8F%91%E7%8E%B0/
THE END








赶快来坐沙发