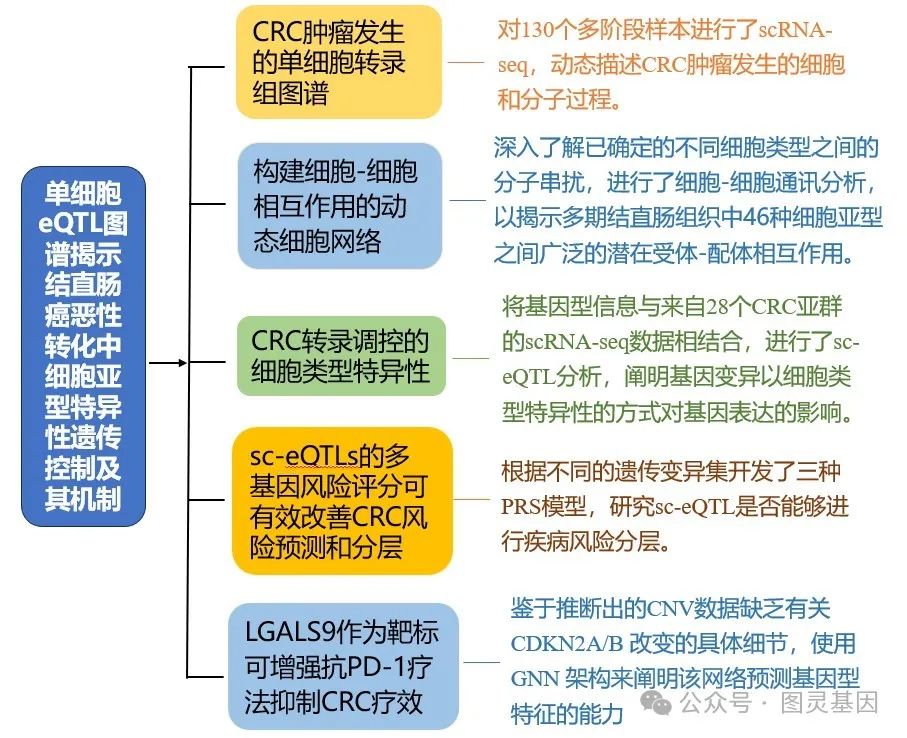
Cancer Dis | 单细胞eQTL图谱揭示结直肠癌恶性转化中细胞亚型特异性遗传控制及其机制
撰文:图图
IF : 29.7
推荐度:
亮点:
本研究分析了来自 142 个多阶段样本的 751531 个单细胞转录组、空间转录组和 snMultiomes ,揭示了 CRC 发展过程中的细胞和分子改变以及细胞间的动态串联,通过动态单细胞图谱和强大的 CRC sc-eQTL 图谱,并阐明了肿瘤微环境中细胞类型的特异性调控和细胞类型之间的重要串扰机制,为 CRC 肿瘤发生和靶向治疗提供了深刻的见解。
近日,武汉大学公卫学院院长缪小平教授课题组研究人员在《 Cancer Discov 》上发表了题为 “Single-cell eQTL mapping reveals cellsubtype-specific genetic control and mechanism in malignant transformation ofcolorectal cancer” 的研究论文。
结直肠癌( CRC )是一种异质性疾病,通过逐步积累而发展,但单细胞分辨率的潜在机制仍不清楚。本研究分析了来自 142 个多阶段样本的 751531 个单细胞转录组、空间转录组和 snMultiomes ,揭示了 CRC 发展过程中的细胞和分子改变以及细胞间的动态串联。此外还绘制了一张 CRC sc-eQTL 图谱,在 28 种细胞亚型中识别出 16,833 对重要的 sc-eQTLs 对,其中 76% 以上的 sc-eQTLs 是细胞类型特异性的,而在大数据集中可检测到的 sc-eQTLs 不到 15% 。从 sc-eQTLs 得出的多基因风险评分( PRS )大大提高了对 CRC 风险的预测。
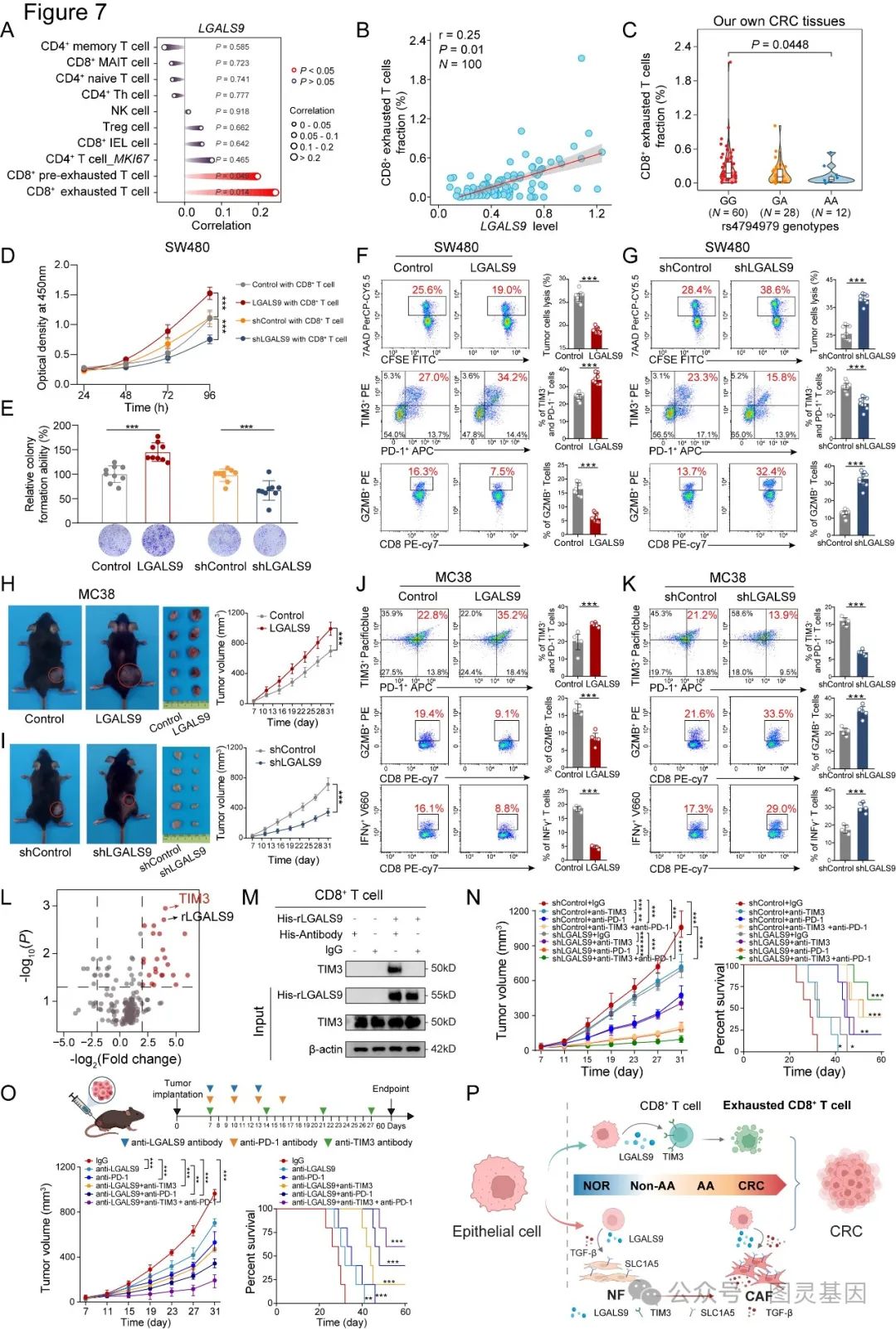
研究优先选择了 rs4794979 ,它通过促进 ELK1 介导的 LGALS9 表达,与 CRC 风险增加有关。上皮中升高的 LGALS9 与成纤维细胞上的 SLC1A5 相互作用,促进转化为癌相关成纤维细胞( CAFs ),同时通过 LGALS9-TIM3 轴诱导 CD8+T 细胞衰竭,从而促进 CRC 的发展。阻断 LGALS9-TIM3 轴可增强抗 PD-1 疗法,从而抑制 CRC 的发展。
研究设计
本研究分析了来自 142 个多阶段样本的 751531 个单细胞转录组、空间转录组和 snMultiomes ,揭示了 CRC 发展过程中的细胞和分子改变以及细胞间的动态串联。此外还绘制了一张 CRC sc-eQTL 图谱,在 28 种细胞亚型中识别出 16,833 对重要的 sc-eQTLs 对,其中 76% 以上的 sc-eQTLs 是细胞类型特异性的,而在大数据集中可检测到的 sc-eQTLs 不到 15% 。
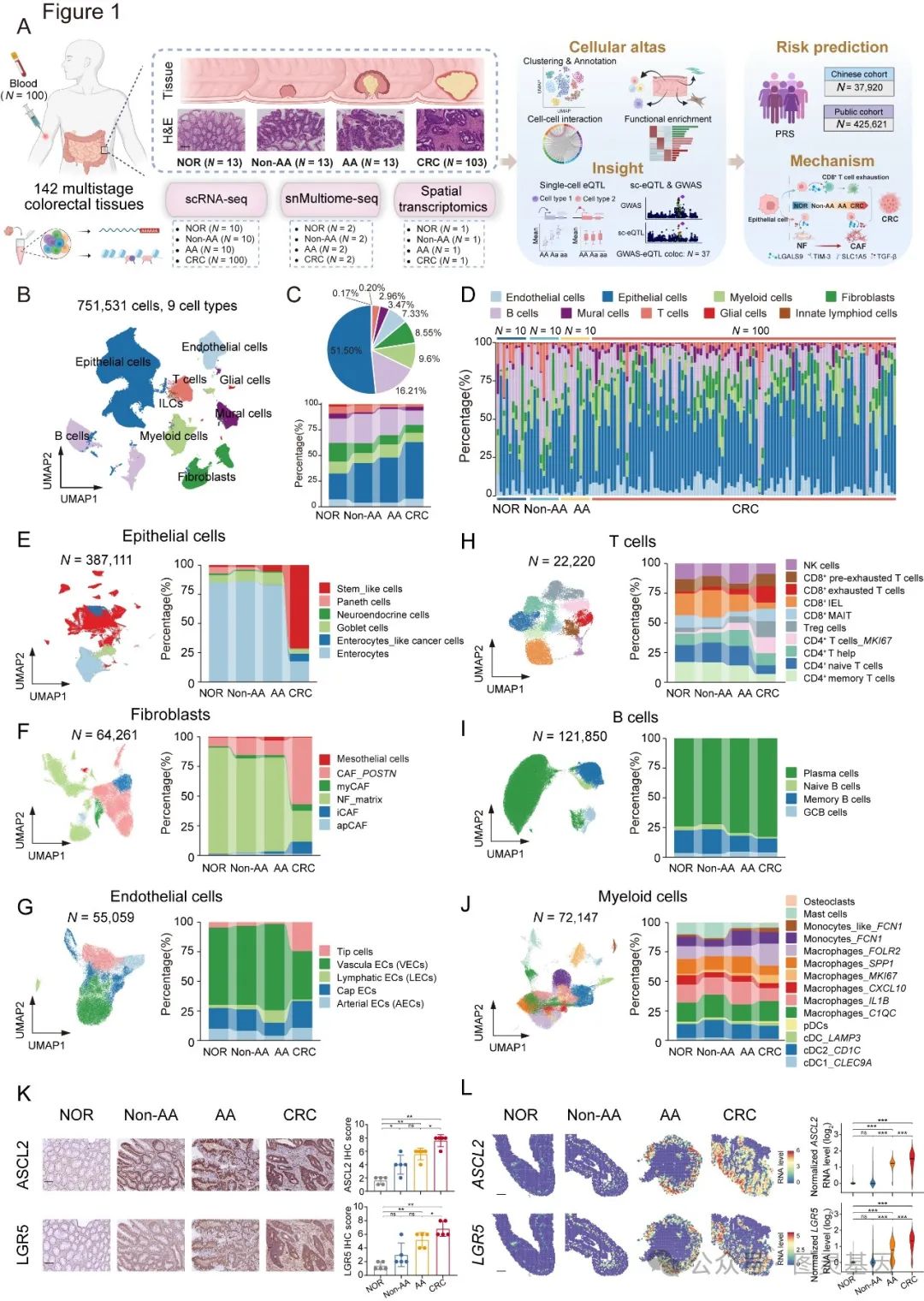
1. 横跨多阶段 CRC 肿瘤发生的单细胞转录组图谱
为了动态描述 CRC 肿瘤发生的细胞和分子过程,对 130 个多阶段样本进行了 scRNA-seq ,包括 10 个正常样本( NOR )、 10 个非晚期腺瘤样本( Non-AA )、 10 个晚期腺瘤样本( AA )和 100 个癌症样本( CRC )(图 1 )。将 751531 个高质量单细胞完全归类为按典型标记表达注释的九大细胞系的组成在不同疾病阶段有所不同(图 1 )。系统地描述了这些亚群的特征,并揭示了 CRC 多阶段病理条件下的细胞和分子偏好,为深入了解恶性肿瘤连续过程中的动态变化提供了有价值的信息。
上皮细胞内的免疫组化( IHC )分析和空间转录组学突出表明, AA 和 CRC 组织中的干样细胞标记物 ASCL2 和 LGR5 水平显著升高,与 NOR 和非 AA 样本中的明显减少形成鲜明对比(图 1 ),从而加强了这一观察结果。因此研究认为 CRC 中的干样细胞很可能代表了“癌症”干细胞群。与 NOR 相比,干样细胞的程序得分显著增加,尤其是在 AA 和 CRC 中。
图 1. 多阶段 CRC 肿瘤发生的单细胞转录组图谱
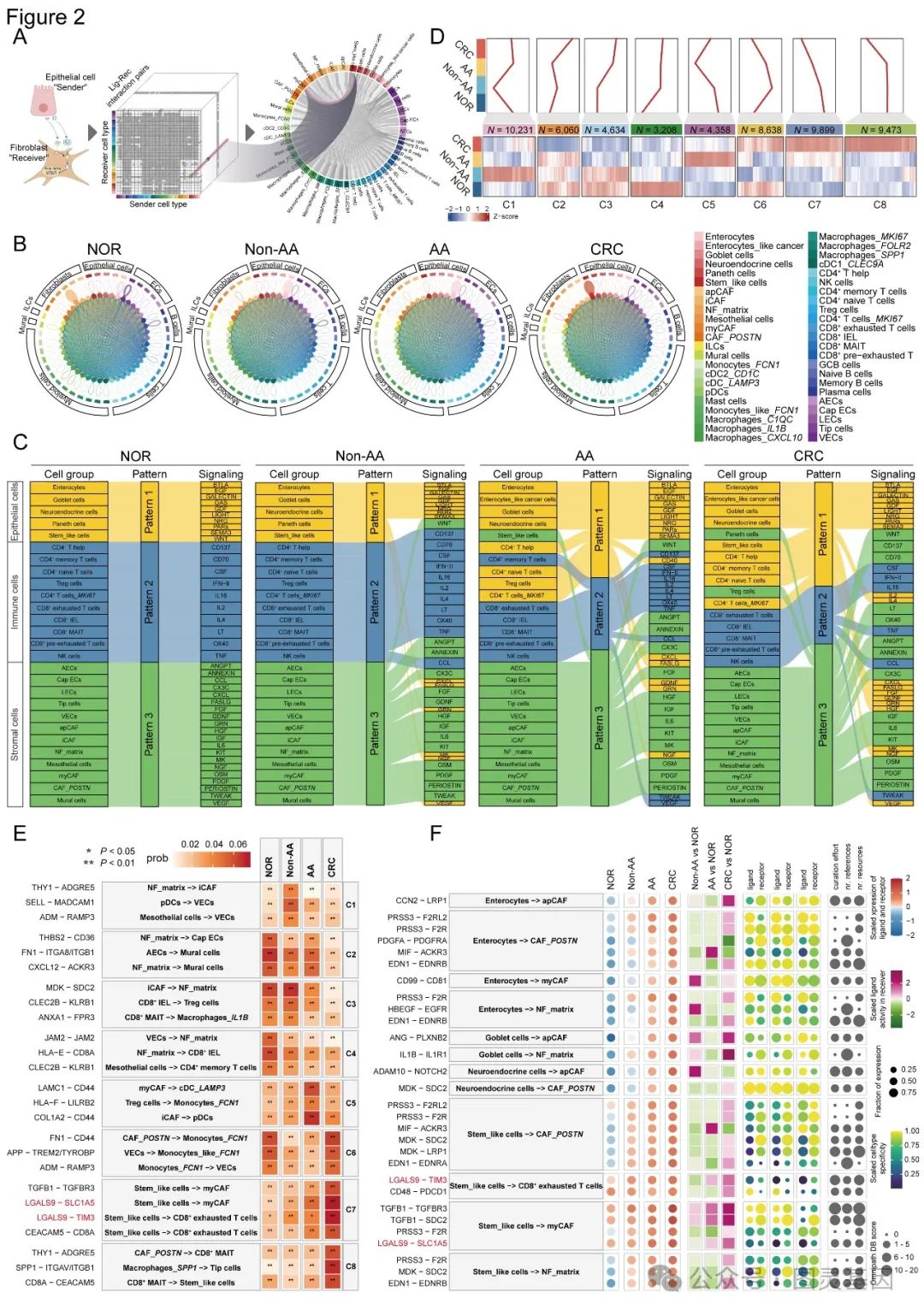
2. CRC 进展过程中细胞 - 细胞相互作用的动态细胞网络
为了深入了解已确定的不同细胞类型之间的分子串扰,进行了细胞 - 细胞通讯分析,以揭示多期结直肠组织中 46 种细胞亚型之间广泛的潜在受体 - 配体相互作用(图 2A )。结果发现在从 NOR 到非 AA 、 AA 再到 CRC 的恶性肿瘤连续体中,相互作用网络的复杂性逐渐增加,这与之前在多种癌症类型中报道的细胞动态一致。具体来说发现这些相互作用在每个阶段都表现出细胞类型偏好。
为了进一步了解细胞信号传导和调控,进一步分析了不同组织间的通讯模式。有趣的是,在癌前病变和 CRC 组织中,不同细胞类型和信号通路之间的通讯模式发生了很大变化(图 2C )。通过 K-means 聚类,划分出了从 NOR 、 Non-AA 和 AA 到 CRC 的八种不同的细胞相互作用模式(图 2D ),突显了癌症进展过程中细胞间通讯的复杂性和失调。
总之研究结果表明细胞与细胞之间的相互作用动态,支持了以下观点,即疾病进展是各种类型细胞之间相互作用的结果。
图 2. CRC 肿瘤发生过程中细胞间相互作用的动态细胞网络
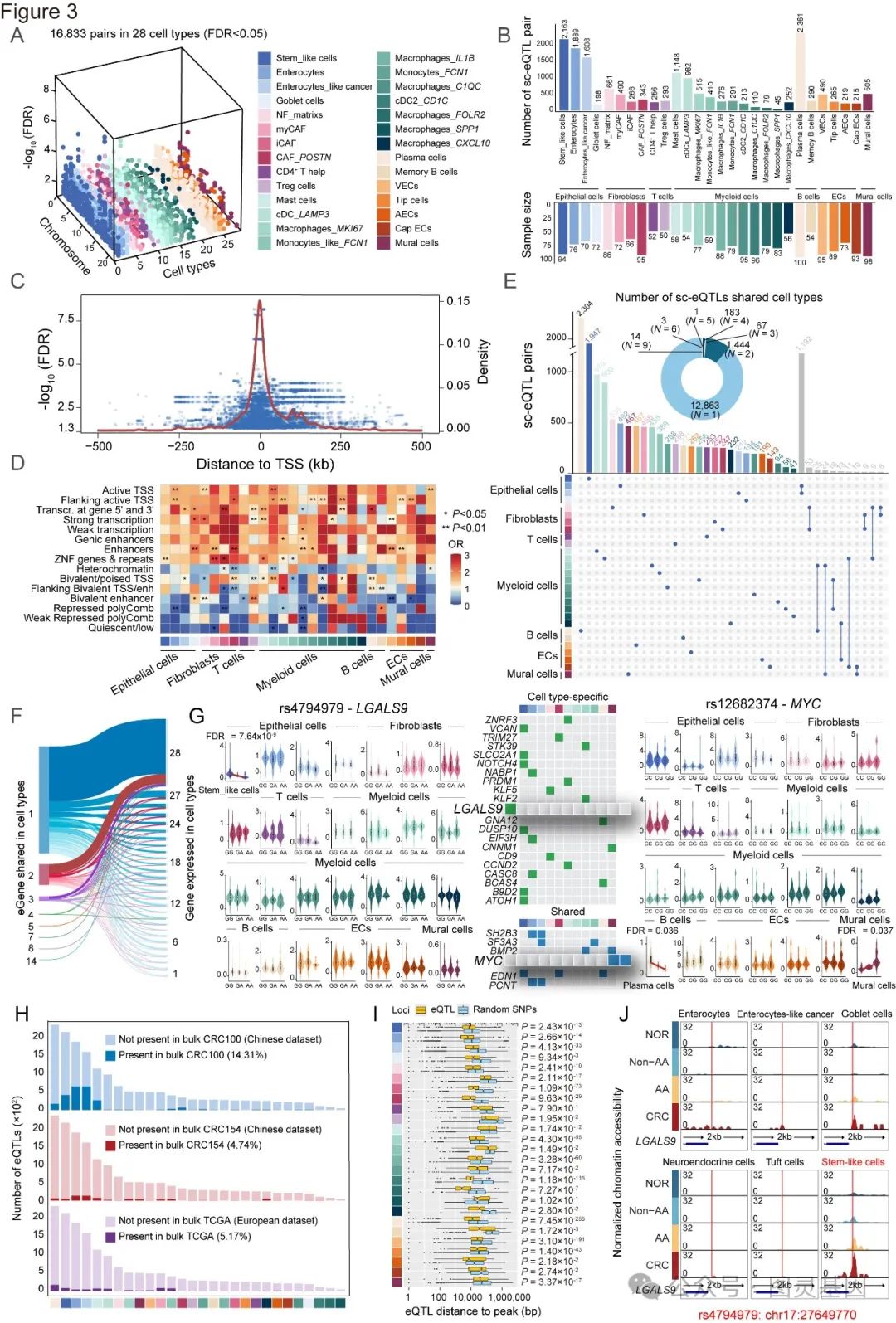
3. CRC 转录调控的细胞类型特异性
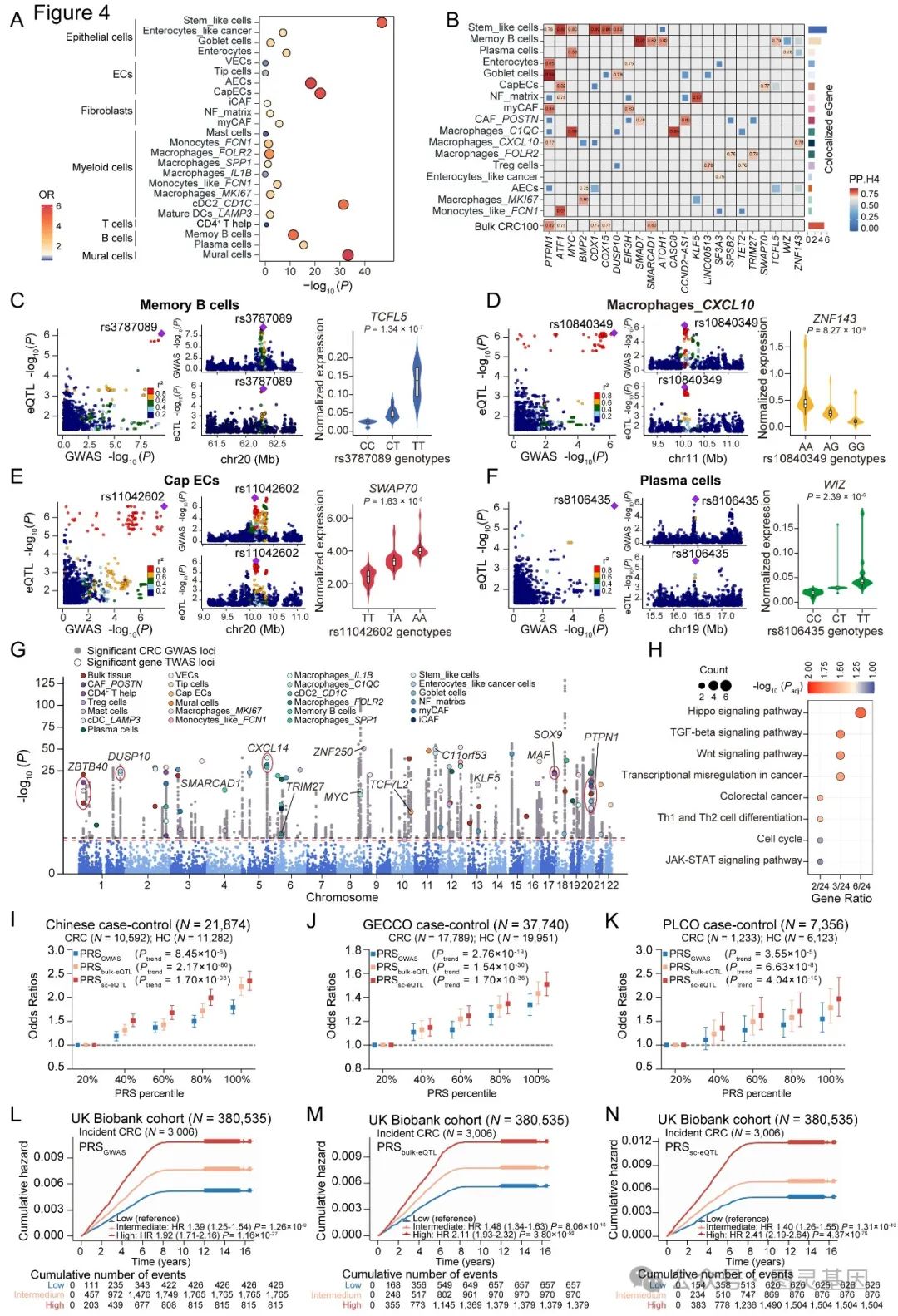
为了阐明基因变异以细胞类型特异性的方式对基因表达的影响,将基因型信息与来自 28 个 CRC 亚群的 scRNA-seq 数据相结合,进行了 sc-eQTL 分析,所有这些数据都通过了严格的质量控制流程(方法)。结果总共发现了 16,833 个显著的 sc-eQTL 对,涉及 13,135 个 sc-eQTL 和 2,429 个 eGenes ,范围从巨噬细胞 _SPP1 中的 45 个到浆细胞中的 2,361 个(图 3A-B )。
观察到 sc-eQTL 的丰度与样本大小、每种细胞类型的细胞数之间存在正相关。还描述了这些 sc-eQTL 的基因组特性,发现 sc-eQTL 在转录起始位点( TSS )周围有预期的富集(图 3C )。同样结果发现 sc-eQTLs 在转录结合位点( TFBS )和活性组蛋白标记中显著富集,而在抑制性组蛋白修饰区域则明显减少。综上所述,这些结果在单细胞分辨率上展示了一个独特的 CRC 患者 eQTL 图谱,为 sc-eQTLs 的调控特性提供了令人信服的证据。
图 3. 绘制并表征 CRC 组织中跨细胞亚型的 sc-eQTLs
4. 来自 sc-eQTLs 的多基因风险评分可有效改善 CRC 风险预测和分层
鉴于 sc-eQTL 在 CRC 风险定位中的良好表现,试图研究 sc-eQTL 是否能够进行疾病风险分层。为此根据不同的遗传变异集开发了三种 PRS 模型: 224 个已知的 CRC 风险变异( PRSGWAS )、 552 个独立的成块 eQTL 变异( PRSbulk-eQTL )和来自 28 个细胞亚型的 746 个独立的成块 sc-eQTL 变异( PRSsc-eQTL )。
随后在由 447,495 人组成的大规模多种群中评估了这些 PRS 的预测性能,其中包括在病例对照和前瞻性队列设置中的评估。结果观察到从 sc-eQTLs 导出的 PRS 以剂量反应的方式显示了对 CRC 风险的显著预测能力, PRS 顶部 20% 的个体与底部 20% 的个体相比, CRC 风险增加了 1.34 倍。更重要的是注意到 PRSsc-eQTL 在预测 CRC 风险方面的表现优于其他两个 PRS 模型,其次是批量 eQTL 衍生的 PRS ,这突出表明将功能变异纳入 PRS 模型可提高预测效率(图 4I )。
图 4. 通过 sc-eQTLs 剖析 CRC GWAS 基因位点并进行风险预测
5. 将 LGALS9 作为靶标可增强抗 PD-1 疗法抑制 CRC 的疗效
鉴于 LGALS9-TIM3 相互作用对 CD8+T 细胞衰竭的影响削弱了抗 CRC 免疫反应,研究了靶向 LGALS9 是否能提高抗 PD-1 疗法的疗效。为此用对照组或 LGALS9 敲除组( shLGALS9 )处理 MC38 合成肿瘤模型,同时进行或不进行抗 TIM3 或抗 PD-1 治疗。正如预期的那样,结果显示,与对照组相比,敲除 LGALS9 能显著抑制 MC38 异种移植的生长,而与单独敲除 LGALS9 相比, shLGALS9 与抗 PD1 或抗 TIM3 的下载结合能显著增强抑制 CRC 生长的功效。
值得注意的是, shLGALS9 加抗 TIM3 和抗 PD1 的三联疗法与其他疗法相比具有最强的生长抑制效果。同时还观察到, shLGALS9 、抗 TIM3 和抗 PD1 抗体联合治疗的效果更好。这些结果表明,靶向 LGALS9 能增强抗 PD-1 治疗的效果,为提高 CRC 抑制率提供了一种有前景的生物标记物(图 5 )。
图 5. LGALS9 通过 LGALS9-TIM3 轴促进 CD8+T 细胞衰竭,从而促进 CRC 生长
6. 讨论与结果
结直肠癌是一种病因异质性疾病,其特点是遗传和分子畸变的逐步积累,这些畸变促进了结直肠癌从 NOR 到 Non-AA ,再到 AA ,最终发展为 CRC 的过程。本研究对来自 142 个多阶段样本的 751,531 个单细胞转录组、 snMultiomes 和空间转录组的高质量数据集进行了分析,揭示了恶性肿瘤连续过程中细胞和分子成分的时空动态,并推动了早期关键事件的发现。此外在全球范围内揭示了 TME 内错综复杂的细胞间串联和细胞 - 细胞间相互作用的改变,为从机制上理解 CRC 病理生理学提供了重要见解。
为了进一步阐明基因表达遗传调控的细胞类型特异性,在 CRC 患者的 28 个细胞亚型中构建了独特的 sc-eQTL 图谱。值得注意的是,超过 76% 的 sc-eQTLs 表现出细胞类型特异性,与大量 eQTLs 相比,表现出不同的调控结构。重要的是,由 sc-eQTLs 衍生的 PRS 模型在预测和分层 CRC 风险方面优于传统的 GWAS 衍生模型和基于大量 eQTL 的 PRS 模型,有助于将遗传学转化为临床应用。最终优先选择了与 CRC 风险增加相关的最重要的 sc-eQTL rs4794979 ,以揭示细胞类型特异性致病机制。
简而言之,研究结合了单细胞基因组和功能分析,全面剖析了 CRC 进展的基因、分子和细胞驱动因素,促进了对 CRC 发展和个性化治疗的理解。
教授介绍
缪小平,教授,博士生导师,是国务院颁发政府特殊津贴专家、国家杰出青年基金获得者和国家重点研发计划首席科学家。现任武汉大学公卫学院院长,第十四届全国人大代表。主要从事环境与肿瘤的分子流行病学研究,在遗传易感性及分子机制、基因 - 环境交互作用和肿瘤风险预测模型等方面取得了较突出的成绩。
参考文献
Chen C, Cai Y, Hu W, Tan K, Lu Z, Zhu X, Liu Z, He C, Xu G, Zhang R, NingC, Ruan S, Gao J, Yang X, Wei Y, Zhu X, Li X, Wang F, Wang F, Li J, Jin M, LiB, Zhu Y, Tian J, Miao X. Single-cell eQTL mapping reveals cellsubtype-specific genetic control and mechanism in malignant transformation ofcolorectal cancer. Cancer Discov. 2025 Mar 4.
链接:http://www.lewenyixue.com/2025/03/26/Cancer%20Dis%20%7C%20%E5%8D%95%E7%BB%86%E8%83%9EeQTL/








赶快来坐沙发