Nat Genet | 何厚胜/Paul C. Boutros合作绘制前列腺癌m6A调控网络,揭示肿瘤异质性与治疗新靶点
前列腺癌是全球男性最常见的恶性肿瘤之一,其高度异质性和复杂微环境使得精准诊疗面临巨大挑战。近年来, RNA 表观遗传修饰 —— 尤其是 N6- 甲基腺苷 ( m 6 A ) —— 作为基因表达的 “ 暗物质 ” ,在肿瘤发生发展中逐渐崭露头角。然而, m 6 A 在前列腺癌中的全局调控网络及其临床意义仍是一团迷雾。
2025 年 3 月 24 日,多伦多大学 何厚胜 团队以及 加州大学洛杉矶分校 Paul C. Boutros 团队合作在 Nature Genetics 发表文章 The Landscape of N 6 -Methyladenosine in Localized Primary Prostate Cancer 。 该研究 首次系统绘制了局限性前列腺癌的 m6A 全景观图谱,揭示了 m 6 A 修饰如何通过遗传变异、肿瘤缺氧和微环境重塑驱动临床异质性,并鉴定出关键致癌靶点 VCAN 。研究为前列腺癌的分子分型、预后评估及靶向治疗提供了全新视角 (图 1 ) 。

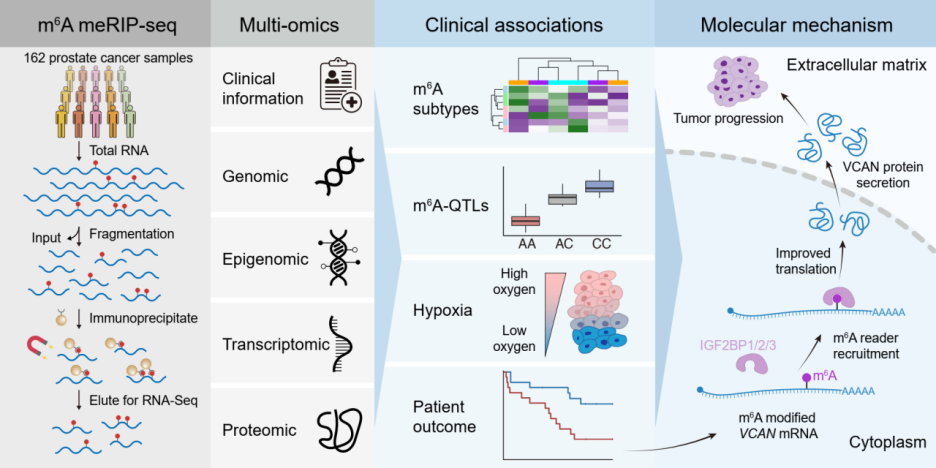
通过对 162 例局限性前列腺癌样本的 m 6 A 测序 ( meRIP-seq ) 及多组学整合分析,研究团队鉴定出 5 种 m 6 A 分子亚型。这些亚型与肿瘤侵袭性 (如病理 T 分期、 IDC/CA 亚型) 、基因组不稳定性及术后复发风险显著相关。
这项研究的另一个突破是证明了肿瘤缺氧可以直接改变 m 6 A 修饰模式。研究发现,突变较少的亚型表现出更接近正常氧水平的 m 6 A 修饰模式,为肿瘤生物学提供了新的见解。进一步探索这些缺氧与 m6A 相互作用的机制,可能为其功能作用和潜在治疗意义提供重要线索。
并且 ,研究团队通过识别全基因组 m 6 A 数量性状位点 ( m6A-QTL ) 评估了遗传风险,揭示了活跃 m 6 A 位点的等位基因失衡,并发现了与前列腺癌风险及临床结果相关的 m 6 A-QTL ,包括驱动基因的 RNA 和蛋白质丰度变化。 例如, rs4951018 位点通过调控 SLC45A3 的 m 6 A 修饰, 与其 RNA 和蛋白丰度 显著相关。值得注意的是,这些发现支持并扩展了早期关于 m 6 A-QTL 在人类疾病中存在及其重要性的报道。
最后, 通过生存分析和功能验证,研究锁定 VCAN 基因 mRNA 上 的 m 6 A 修饰为关键预后标志物。携带 m 6 A 修饰的 VCAN mRNA 通过 招募 IGF2BP 家族 的阅读 蛋白 来稳定其 mRNA 并增强翻 译,显著促进前列腺癌细胞增殖、迁移和转移 (图 2 ) 。 利用可编程的 dCasRx/ METTL3 工具靶向增强 VCAN 的 m 6 A 修饰后,癌细胞侵袭能力显著提升,为基于 m 6 A 编辑的精准干预提供了直接证据。

VCAN m 6 A 修饰通过 IGF2BP 蛋白增强 mRNA 稳定性与翻译 从而促进肿瘤
本研究不仅构建了首个前列腺癌 m 6 A 调控网络,还开发了创新算法 HistogramZoo ,实现了跨样本 m 6 A 峰的高精度整合。结合单碱基分辨率测序技术 ( SAC-seq ) ,团队验证了 m 6 A 修饰在肿瘤异质性中的核心地位。
总之,该 研究标志着我们对前列腺癌表观转录组景观的理解迈出了重要一步。研究结果强调了靶向 m 6 A 介导的基因调控作为治疗该疾病的新方法的潜力。然而,仍需进一步研究以全面阐明 m 6 A 修饰的机制及其对前列腺癌生物学的影响。未来的研究应致力于在更大规模的队列中验证这些发现,并探索靶向 m 6 A 修饰在前列腺癌中的治疗意义。
何厚胜教授表示: “ m 6 A 如同基因表达的 ‘ 调音师 ’ ,在前列腺癌中谱写了复杂的分子乐章。未来,我们将扩大队列验证 m 6 A 标志物的跨种族普适性,并探索基于 m 6 A 编辑的个体化治疗策略。 ”
多伦多大学 玛格丽特公主 癌症 中心 何厚胜 教授和 美国加州大学洛杉矶分校大卫 ·格芬医学院 Paul C. Boutros 教授为这篇文章的共同通讯作者。 副研究员 许 鑫 , 博士生 Helen Zhu , 博士后 Rupert Hugh-White 和 Julie Livingstone 为共同第一作者。
原文链接 :
https://doi.org/10.1038/s41588-025-01687-6
链接:http://www.lewenyixue.com/2025/03/26/Nat%20Genet%20%7C%20%E4%BD%95%E5%8E%9A%E8%83%9C-Paul/




 时事|全国药政工作会议安排部署2025年重点任务
时事|全国药政工作会议安排部署2025年重点任务
赶快来坐沙发