JCMM | AI驱动的病理学揭示CDKN2A在头颈癌中的预测能力
在一项新的研究中,河南大学和中国第四军医大学的研究人员开发了一种新的人工智能( AI )驱动的病理学方法,以提高 CDKN2A 预测头颈部鳞状细胞癌( HNSCC )患者预后的能力。
验证研究表明,这种从病理图像中提取有价值信息来预测基因表达水平的新方法,可以通过提高 CDKN2A 的预后价值来改善临床决策。
“ CDKN2A 表达的评估可以通过提供更准确的预后来显著影响治疗决策和患者预后。 CDKN2A 的高表达与生存率的提高有关,指导临床医生更有效地制定治疗计划。这可能会导致对干预措施的积极性和靶向治疗的潜在使用做出更明智的决定,最终提高患者的生存率和生活质量。”该研究的通讯作者 Junpeng Luo 博士说。
该报告发表在《 Journal ofCellular and Molecular Medicine 》上,文章题为“ Prognosticvalue of CDKN2A in head and neck squamous cell carcinoma via pathomics andmachine learning ”。
HNSCC 约占全球所有头颈部肿瘤的 90% 。尽管手术技术和辅助治疗取得了进步,但 HNSCC 患者的总体预后仍然很差, 5 年生存率很低。
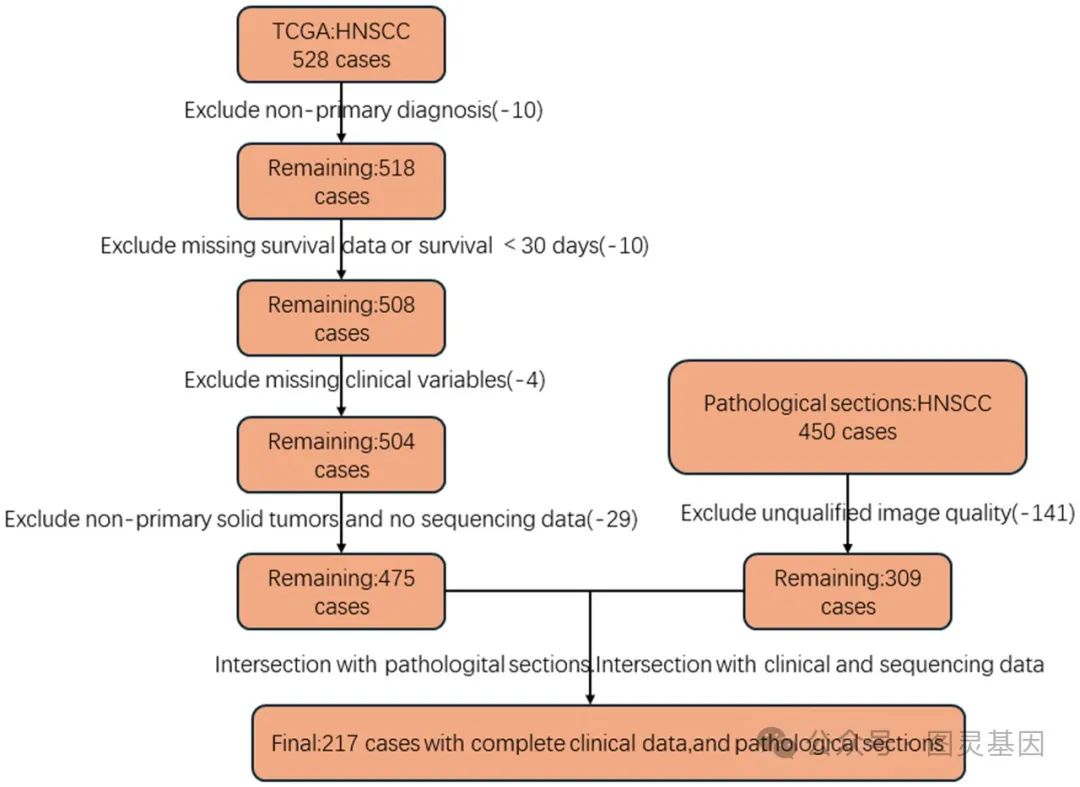
头颈部鳞状细胞癌病例选择和数据过滤过程
CDKN2A 基因以其在细胞周期调控中的作用而闻名,已成为包括 HNSCC 在内的各种癌症的潜在预后标志物。然而,目前评估 CDKN2A 表达的方法受到成本、侵袭性和可靠性等因素的限制。本研究旨在通过开发一种新的、人工智能驱动的方法来分析病理图像中 CDKN2A 的表达,从而解决这些局限性,有可能会提供一种更易获得且更准确的预后工具。
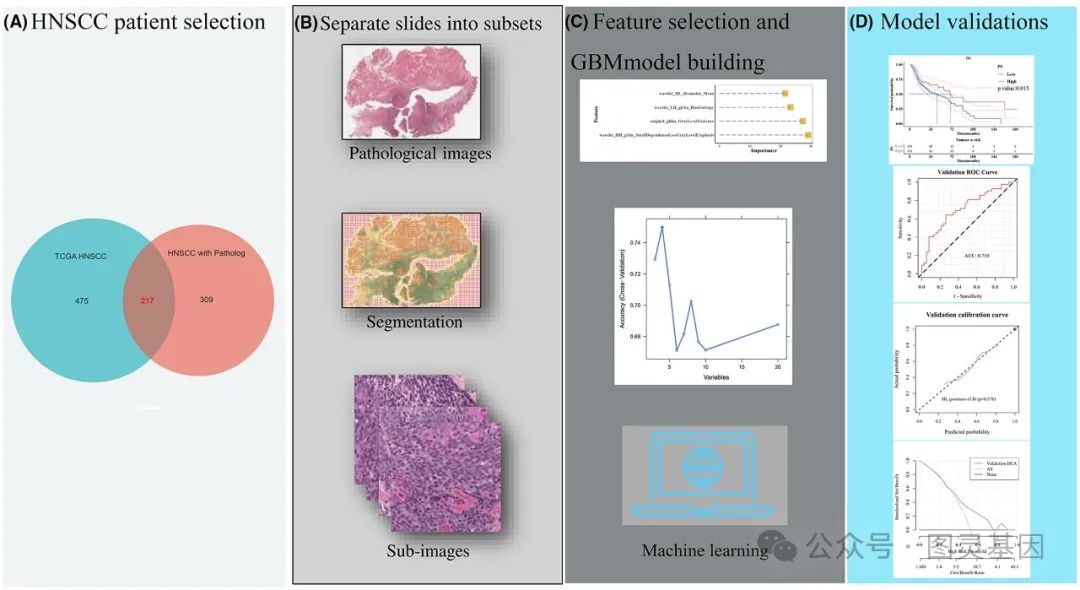
HNSCC 患者数据分析工作流程:从选择到模型验证
“ HNSCC 的不良预后激发了对新的预后标志物的探索。利用人工智能驱动的病理学提供了一种有前景的非侵入性解决方案,通过将 CDKN2A 表达与患者预后精确地联系起来,从而增强预后预测。” Luo 博士指出。
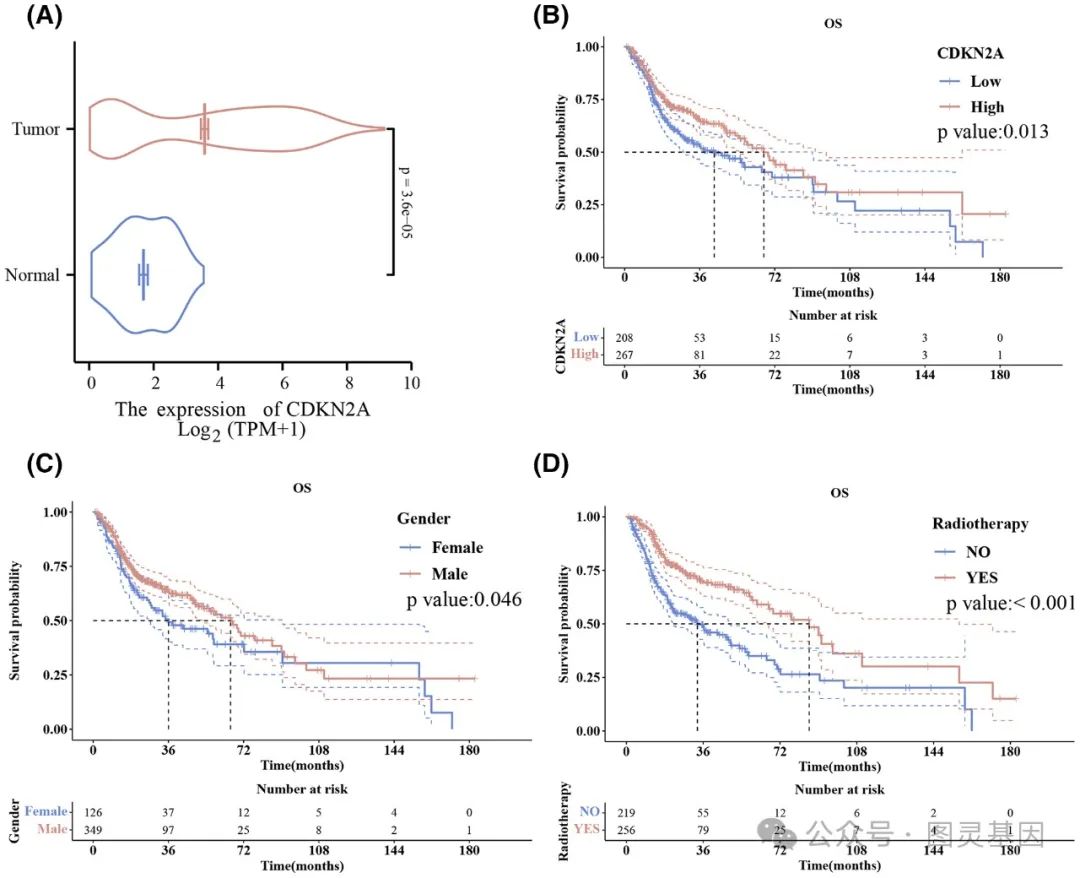
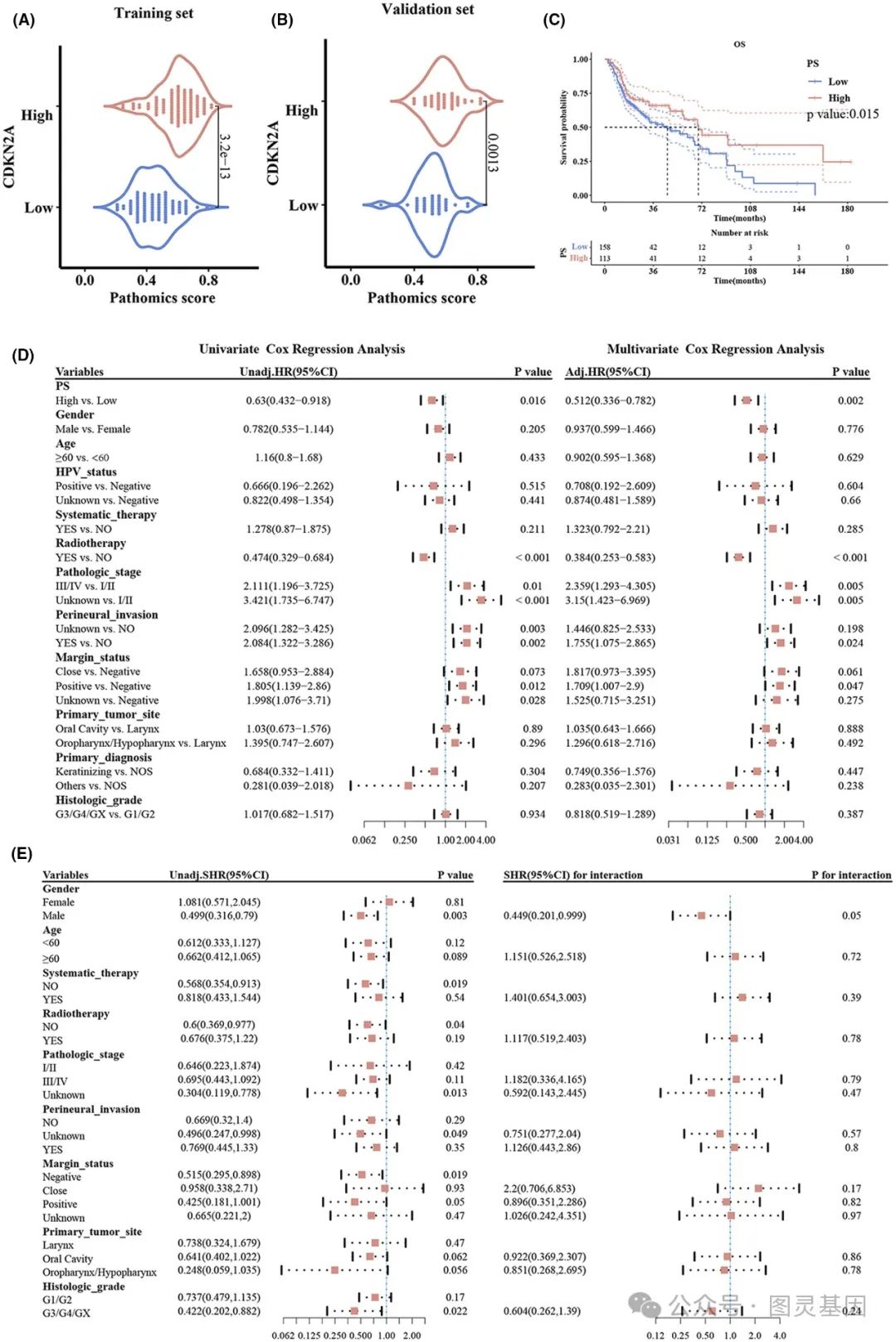
基于性别和放疗的 CDKN2A 表达和生存结果
研究人员分析了癌症基因组图谱( TCGA )数据库中 475 名 HNSCC 患者的数据。选择这些病例是为了确保全面的临床和转录组学数据的可用性。然后,研究小组根据预先确定的表达阈值将患者分为 CDKN2A 高表达组和 CDKN2A 低表达组。
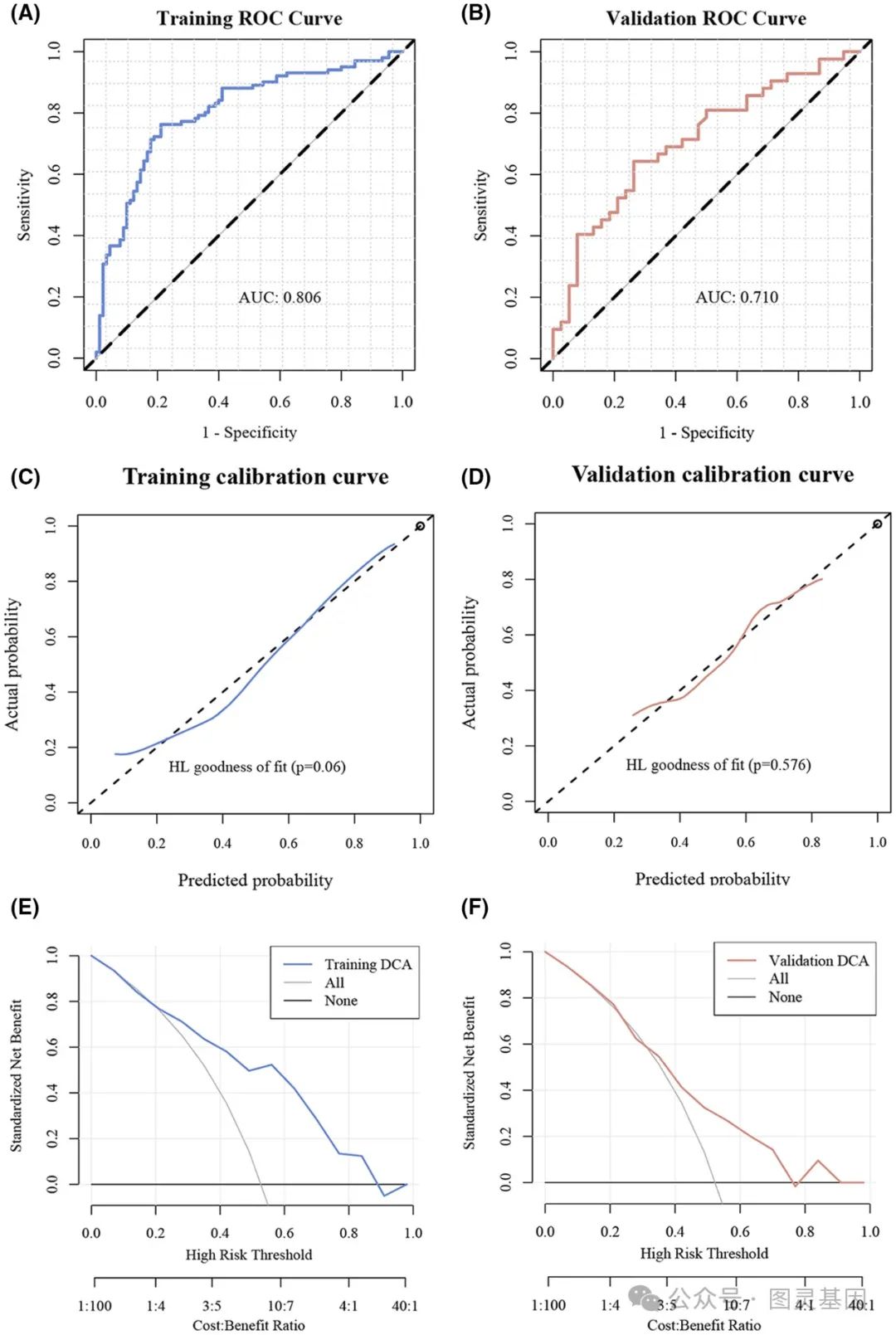
预测模型性能评估
该团队通过分析 271 例具有可用病理切片的病例,开发了一个人工智能驱动的病理学框架,从中提取了 465 个不同的特征。这些特征被用来构建一个梯度增强机模型,旨在计算病理评分并预测 CDKN2A 表达水平。
病理评分与预后因素的比较分析
研究人员将他们的数据集分为训练集( 70% )和测试集( 30% ),以验证模型的性能。他们采用了各种统计技术,包括受试者工作特征( ROC )分析、 Kaplan-Meier 生存分析和 Cox 回归分析,来验证他们的发现,并评估 CDKN2A 表达和病理学模型的预后价值。
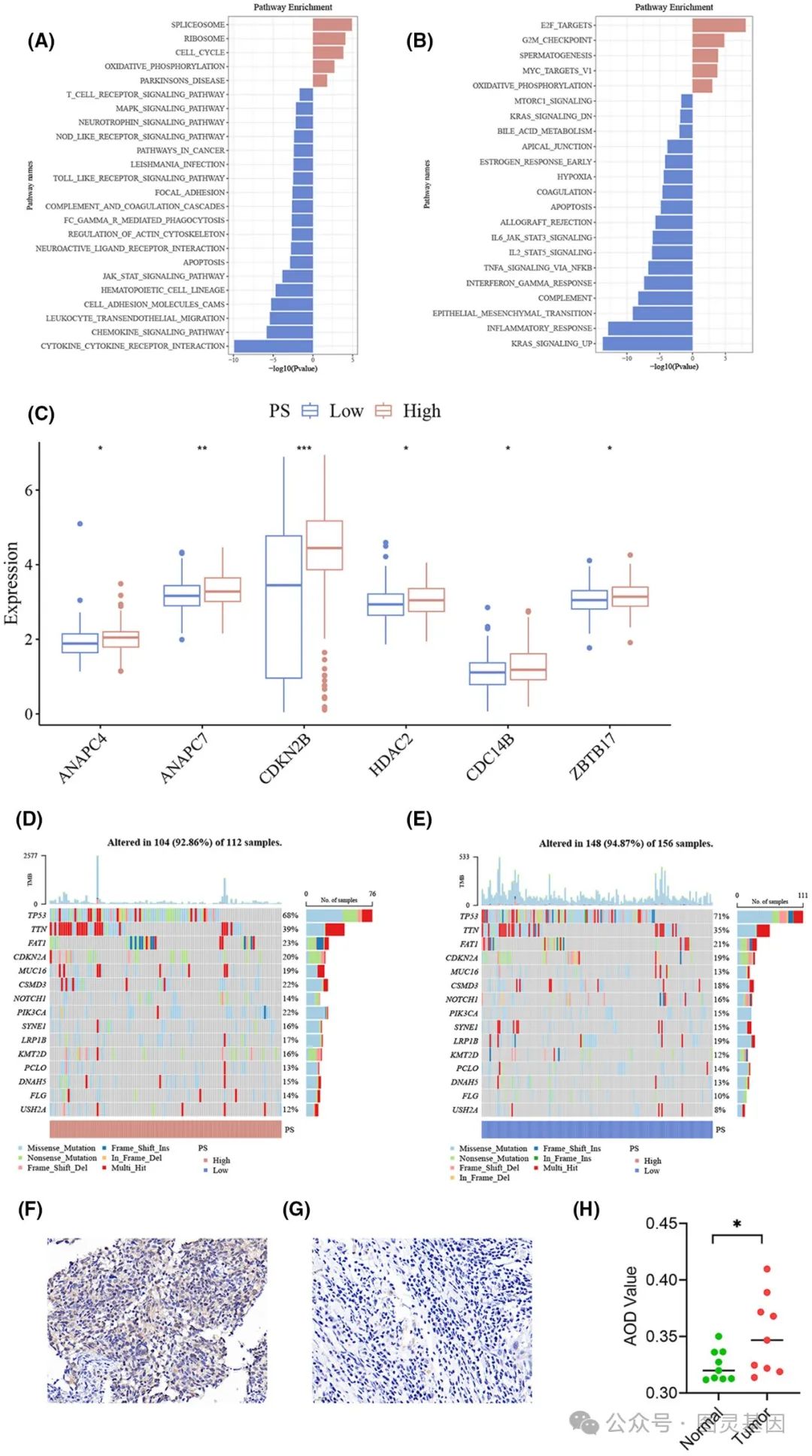
肿瘤样本中的分子谱和通路富集分析
CDKN2A 高表达患者的中位总生存期明显长于低表达患者( 66.73 个月 vs 42.97 个月, P = 0.013 )。这种关联在单变量和多变量分析中都成立,证实了 CDKN2A 作为 HNSCC 患者独立预后指标的作用。
此外,研究表明,该团队开发的 AI 驱动的病理学模型具有很强的预测能力。训练集的曲线下面积( AUC )值为 0.806 ,验证集为 0.710 ,表明该模型能够仅从病理图像中准确预测 CDKN2A 表达水平。通过组织微阵列分析进一步验证了这一性能,证实了该模型的预测能力。
Luo 博士说,这些发现表明,他们的 AI 病理学模型可以增强肿瘤学的个性化医疗。
在确认了 CDKN2A 对 HNSCC 患者的预后价值后,研究人员进一步使用基因集富集分析( GSEA )获得了分子见解。高病理评分与细胞周期和 G2M 检查点通路的激活密切相关,突出了明显的增殖特征。相反,低病理评分与 JAK/STAT 信号传导和上皮间质转化( EMT )等途径相关,表明不同的致癌机制在起作用。
有趣的是,研究小组还发现,高病理评分组的 TP53 突变频率较低,这一发现特别值得注意,因为 TP53 突变与 HNSCC 预后不良有关。
研究人员承认,在他们的回顾性设计中,可能存在固有的选择偏差。他们还强调,需要进行前瞻性的多中心研究来进一步验证和完善他们的预后模型。
“根据这项研究的结果,下一步的研究包括在更大的、多中心的前瞻性研究中验证 AI 驱动的病理模型,以确认其稳健性和可推广性。” Luo 博士指出。他补充说,探索更广泛的组学数据的整合,如基因组学和蛋白质组学,可以进一步提高模型的预测准确性,并为 HNSCC 的分子机制提供更深入的见解。“这些进步将支持肿瘤个性化治疗策略的持续发展。”他说。
关于将 AI 驱动的病理技术纳入临床工作流程, Luo 博士表示,尽管 AI 驱动的病理技术可以为癌症检测和预测提供精确、经济高效和非侵入性的方法,但潜在的挑战包括需要强大的 IT 基础设施、对医疗专业人员的培训以及确保数据安全和患者隐私。
他说:“要促进这些先进技术在临床实践中的应用,与监管机构的合作至关重要。”
链接:http://www.lewenyixue.com/2025/03/18/JCMM%20%7C%20AI%E9%A9%B1%E5%8A%A8%E7%9A%84%E7%97%85%E7%90%86%E5%AD%A6%E6%8F%AD%E7%A4%BACDK/






赶快来坐沙发