高危多发性骨髓瘤的定义和治疗
多发性骨髓瘤(MM)是一种异质性疾病,具有不同的分子学改变和对治疗的不同反应。尽管最近的治疗进展改善了大多数患者的预后,但高危患者的预后仍然不佳。
《Current Oncology Reports》近日发表综述,探讨了新诊断多发性骨髓瘤(NDMM)患者中的高危多发性骨髓瘤(HRMM)亚组,以及与高危状态相关的各种临床、生化、影像学、遗传和动态特征,还讨论了不同的风险分层工具,并强调了标准化HRMM定义的必要性,以推进研究和临床治疗。
临床特征
衰弱(Frailty)和年龄: MM主要影响老年人,中位诊断年龄为66岁。虚弱和年龄已被证明可以独立预测MM患者的预后。
髓外病变(EMD): EMD患者通常具有高危细胞遗传学异常,对常用疗法耐药,且PFS和OS较差。
肾功能衰竭: 20-40%的患者在诊断时有不同程度的肾功能不全,尽管治疗进展,但严重肾功能不全的患者预后仍然较差。
实验室和影像学特征
β2-微球蛋白(β2m): 血清β2m升高与MM患者预后不良相关。
白蛋白: 低血清白蛋白与MM患者的不良预后相关。
乳酸脱氢酶(LDH): 高血清LDH水平反映更高的肿瘤负荷和更积极的疾病进程。
循环浆细胞: 循环浆细胞数量增加与不良预后相关。
多个病灶: 影像学上存在≥3个病灶与预后不良独立相关。
遗传特征
基因组不稳定性: HRMM的关键特征是获得性遗传事件,导致对化疗的耐药性和复发。
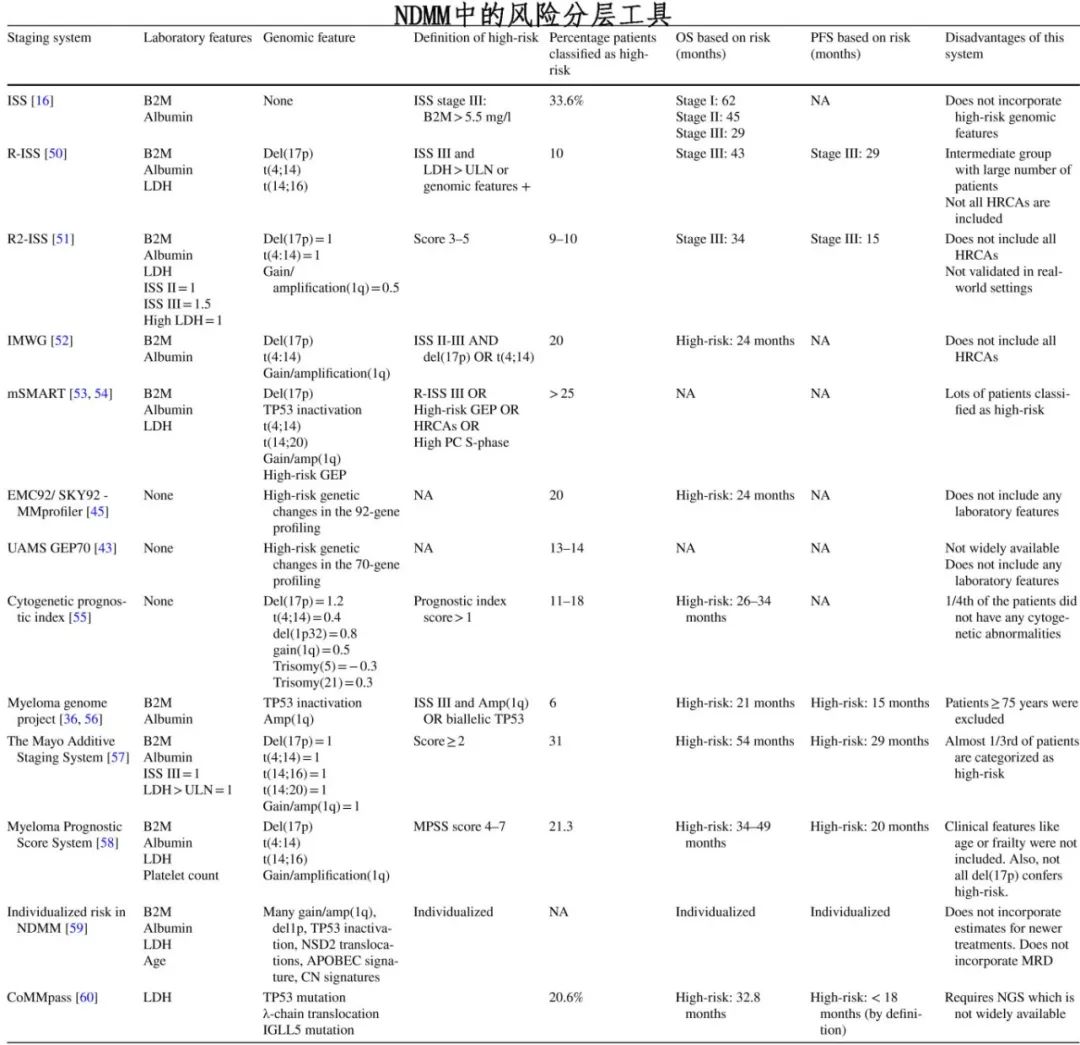
细胞遗传学异常: 通过FISH检测到的高危细胞遗传学异常包括t(4;14)、t(14;16)、t(14;20)、del(17p)、gain/amp(1q21)和/或del(1p)。但并非所有高危细胞遗传学异常患者预后都差,例如t(4;14)和del(17p)。孤立性FISH异常可能不会导致高危,例如孤立性gain/amp (1q21)与del(1p)伴gain/amp (1q21)相比并不具有相同的高危。
二代测序(NGS): NGS可以检测到FISH未发现的细胞遗传学变化,例如TP53双等位基因失活。
基因表达谱(GEP): 可测量各种关键基因的表达,是目前最强的预后检测。GEP70和SKY92都已用于指导治疗决策。COMMPASS研究已经确定了许多可操作的基因畸变,包括RAS、BRAFV600E和FGFR3。
提出了各种风险分层工具,包括国际分期系统(ISS)、R-ISS和mSMART,它们结合了β2m、白蛋白、LDH和细胞遗传学异常等因素。然而这些工具的特异性较低,部分被归类为低危的患者仍可能出现早期进展和死亡。
对一线治疗耐药或在一线治疗开始后18个月内复发和/或在首次自体造血干细胞移植(HSCT)后12个月内复发的患者,其总生存期较差,这组在传统评估中未检测到高危基因型的情况下早期复发的患者称为功能性HRMM。这组患者无论细胞遗传学风险如何,其预后一直较差。高达28%的早期复发患者缺乏传统的高危细胞遗传学异常(HRCA),可能反映出治疗诱导的高度耐药MM克隆的选择,或者基线评估不足。
作者建议在定义HRMM时同时使用临床和疾病特异性标准。建议尽可能为所有患者获取GEP70或SKY92,因为这是识别HRMM最可靠的方法。在无法获取GEP70或SKY92的情况下,需要进行基线FISH检测。
作者建议使用以下标准来诊断HRMM患者(以下任何一项):
1.通过GEP70或SKY92确定的高危状态,或
2. del(17p) > 60%缺失或TP53突变,或
3.存在任何两种共存的HRCA(例如gain/amp(1q)和del(1p)同时存在),或
4.高β2微球蛋白(>5.5 mg/dl)且肌酐正常(<1.2 mg/dl),或
5.诊断时存在EMD、浆细胞白血病和/或三个大病灶(定义为垂直直径的乘积>5cm²)。
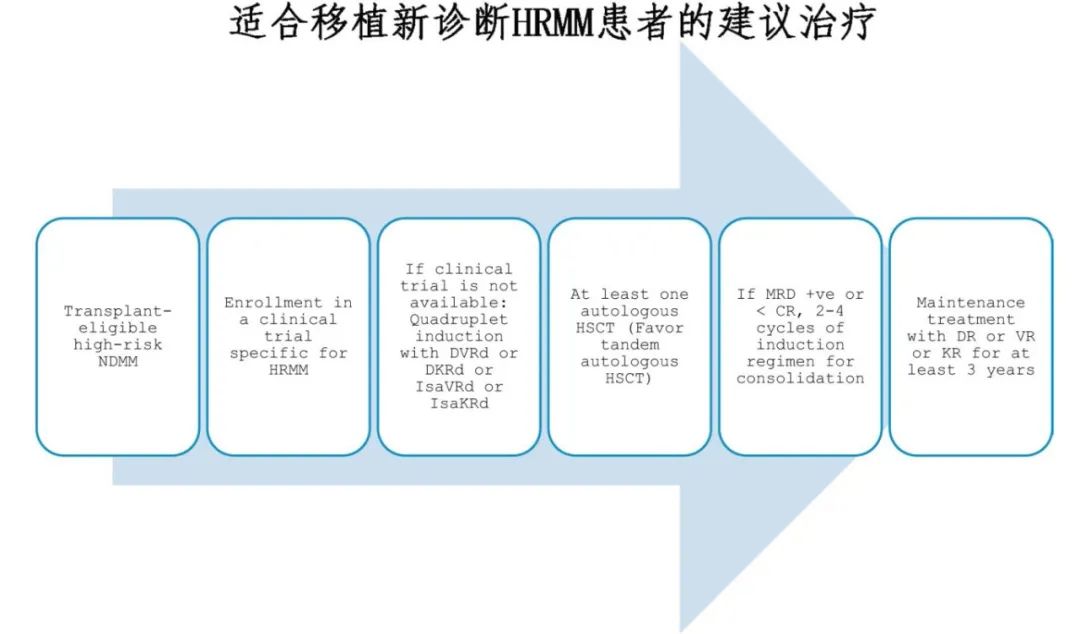
诱导和巩固治疗方案
三药诱导治疗: 传统上使用包括蛋白酶抑制剂(PI)、免疫调节剂(IMiD)和地塞米松的三药方案。
四药诱导方案: 在PI加IMiD的基础上添加抗CD38单克隆抗体(如达雷妥尤单抗或艾莎妥昔单抗)可显著提高MRD阴性率和PFS。
大剂量马法兰和自体造血干细胞移植(HSCT)的作用
自体HSCT: 随机试验表明,三药/四药诱导后进行HSCT在HRMM患者中具有PFS优势,但OS可能不一致。
串联HSCT: 建议所有适合移植HRMM患者都进行串联HSCT。
HRMM的维持/延长治疗
维持治疗: HRMM患者的最佳维持治疗方案和持续时间尚不明确。传统上使用单剂来那度胺进行维持治疗,但在HRMM患者中的效果有限。最近的研究表明,卡非佐米-来那度胺±地塞米松在包括HRMM患者在内的MM患者中显示出更好的PFS。
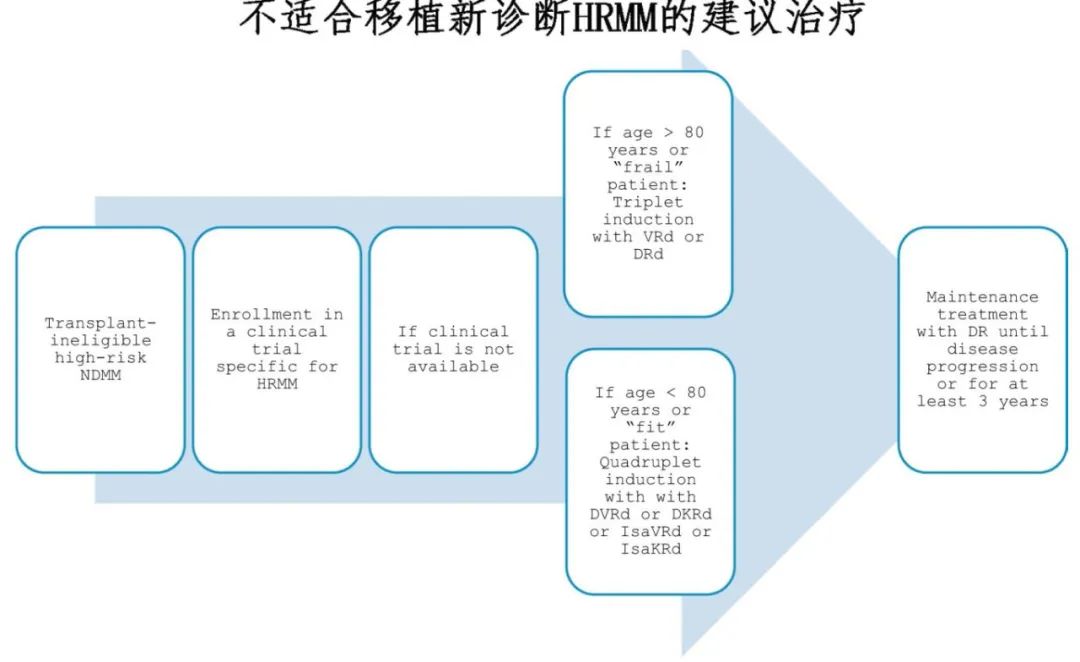
不适合移植的HRMM患者
治疗选择: 对于不适合移植的HRMM患者,四药方案在适合移植的患者中更有效,但患者可能无法耐受如此强化的治疗。对于不适合移植但fit的HRMM患者,应优先采用四药方案诱导和巩固,然后采用两药或三药维持治疗至少2-3年;对于不适合移植的frail HRMM患者,治疗应个体化,并应给予足够的支持治疗,以防止治疗相关不良事件和感染。
HRMM治疗中的新疗法
抗体药物偶联物(ADC): Belantamab mafodotin在与硼替佐米或泊马度胺-地塞米松联合使用时显示出良好的效果。
双特异性T细胞接合剂(BiTE) :(特立妥单抗Teclistamab)和talquetamab在经过多线治疗的MM患者中显示出有希望的结果。
CAR-T细胞疗法 :Idecabtagene vicleucel(ide-cel)和ciltacabtagene autoleucel(cilta-cel)在高危患者中显示出优越PFS。
MRD的作用
HRMM患者应尽一切努力尽可能长时间地实现和维持MRD阴性(或更深层次缓解)。MRD可以动态指导HRMM患者的治疗。
识别和治疗HRMM仍然具有挑战性,因为缺乏标准化的定义和有限的临床试验数据。目前的证据支持使用四药方案、自体干细胞移植和维持治疗来治疗适合移植的新诊断高危患者,新兴疗法(包括CAR-T细胞疗法和BiTE)也为这一高危群体提供了改善预后的希望。未来的研究应集中在制定HRMM的共识定义以及确定这些患者的最佳治疗策略上。
参考文献
ohan Lal, B., van Rhee, F. & Al Hadidi, S. Current State of Evidence on Definitions and Management of High-Risk Multiple Myeloma. Curr Oncol Rep (2025). https://doi.org/10.1007/s11912-025-01639-5
链接:http://www.lewenyixue.com/2025/03/14/%E9%AB%98%E5%8D%B1%E5%A4%9A%E5%8F%91%E6%80%A7%E9%AA%A8%E9%AB%93%E7%98%A4%E7%9A%84%E5%AE%9A%E4%B9%89%E5%92%8C%E6%B2%BB%E7%96%97/







赶快来坐沙发