Cancer Cell:复旦大学刘杰/骆菲菲团队破解STING激动剂癌症治疗耐药之谜

干扰素基因刺激因子 (STING) 通路在启动针对病原体和肿瘤的免疫反应中发挥着关键作用。STING 信号的激活对于多种癌症疗法的抗肿瘤效果至关重要,STING 激动剂在小鼠模型中治疗不同癌症方面展现出了令人瞩目的潜力。
然而,STING 激动剂单独使用在临床试验中仅显示出极小的疗效,这表明肿瘤对 STING 的单药治疗具有很强的耐药性。阐明其背后的具体机制,对于提高其癌症治疗效果至关重要。

-
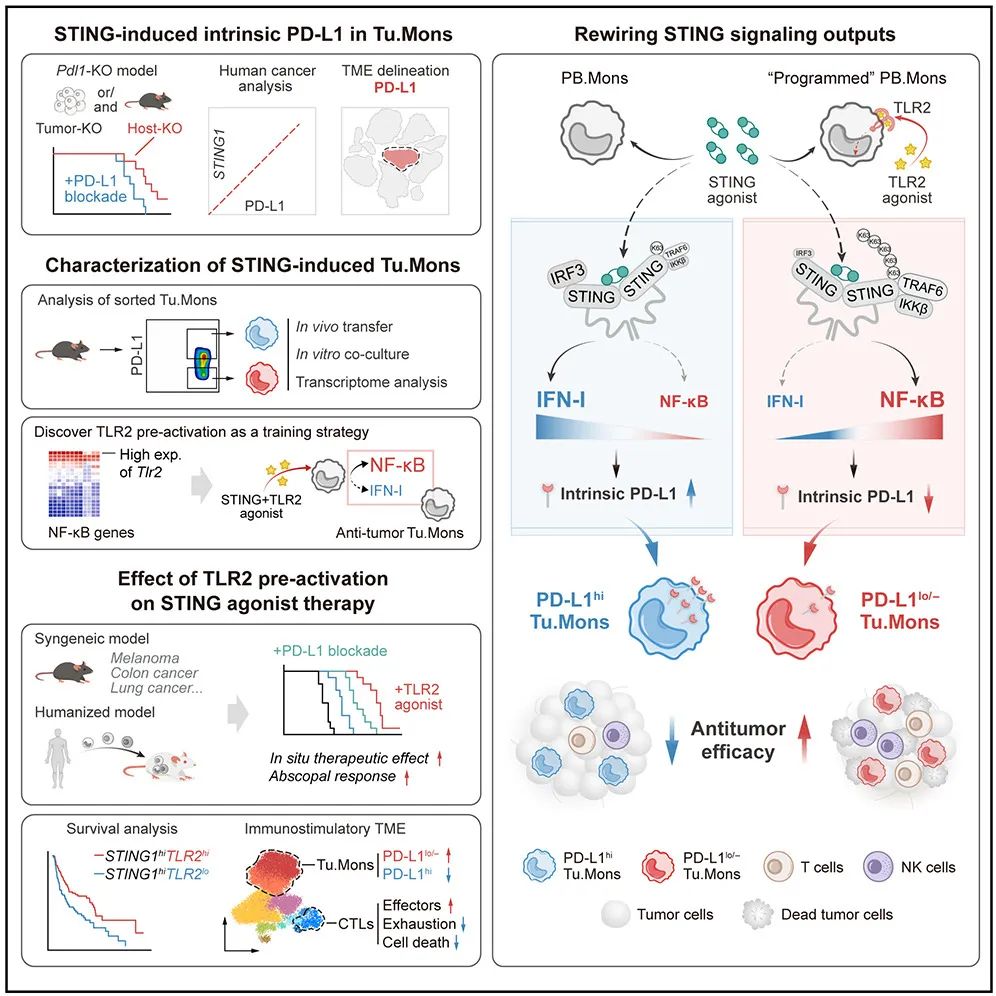
STING 激活诱导的 高表达 PD-L1 的肿瘤单核细胞 ( PD-L1 hi Tu.Mons) 主导了对 STING 激动剂治疗的耐药性;
-
STING-IFN-I 信号轴诱导的细胞内源性 PD-L1 驱动促肿瘤的 PD-L1 hi Tu.Mons;
-
TLR2 激活会重塑 STING 信号转导,从而降低细胞内源性 PD-L1 表达;
-
STING 激动剂与 TLR2 预先激活联合使用,显示出增强的抗肿瘤效果。
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2025/03/12/Cancer%20Cell%EF%BC%9A%E5%A4%8D%E6%97%A6%E5%A4%A7%E5%AD%A6%E5%88%98%E6%9D%B0-%E9%AA%86/
链接:http://www.lewenyixue.com/2025/03/12/Cancer%20Cell%EF%BC%9A%E5%A4%8D%E6%97%A6%E5%A4%A7%E5%AD%A6%E5%88%98%E6%9D%B0-%E9%AA%86/
THE END
0
分享
海报
发表评论





赶快来坐沙发