肠道菌群失衡竟成肝癌“帮凶”?Nature子刊:肺炎克雷伯菌是“致癌黑手”!
如何有效遏制肝细胞癌的高复发率和有限的治疗选择?当前的治疗手段存在诸多局限性,难以解决根本。最近,一项研究探讨了肠道菌群失衡与肝癌之间的关系,有望为临床带来新的治疗策略和潜在靶点。
01▼肠道菌群失衡与肝癌:一个未解之谜,肺炎克雷伯菌或成关键推手
肝细胞癌(HCC)病理生理机制复杂,涉及多阶段的肝脏病变,包括炎症、纤维化、肝硬化及最终的恶性转化。目前常用的治疗方法如手术切除、肝移植和局部区域治疗等均存在局限性,例如手术切除和肝移植受限于供体器官的短缺和高复发率,而局部区域治疗如经动脉化疗栓塞(TACE)在某些患者中可能因肝功能不全或合并症而无法实施。此外,系统性治疗在晚期HCC中的疗效有限,且常伴随严重副作用。
肠道与肝脏之间通过肠-肝轴进行双向交流,这一轴在维持肝脏稳态中发挥着至关重要的作用。肠道微生物群通过产生代谢产物和免疫调节因子,影响肝脏的炎症反应和纤维化过程。当肠道菌群失调时,有害菌的增加可能导致肠道屏障功能受损,促进细菌及其产物移位至肝脏,进而加剧肝脏炎症和纤维化,最终促进HCC的发展。尽管已有研究揭示了肠道菌群与HCC之间的关联,但具体的分子机制尚未明确。
2025年1月,香港中文大学于君教授团队在Nature Microbiology杂志发表了一篇题为“Gut–liver translocation of pathogen Klebsiella pneumoniae promotes hepatocellular carcinoma in mice”的研究,通过系统地研究肠道微生物群在HCC中的作用,特别是探讨特定病原体如肺炎克雷伯菌(K. pneumoniae)如何通过肠-肝轴促进HCC的发展,不仅揭示了肠道菌群失衡与HCC之间的直接联系,还详细探讨了特定病原体在HCC发展中的作用机制。
02▼从肠道到肝脏:病原菌移位的探索之旅,精心设计的实验揭开真相
本研究是一项系统性实验,旨在探究肠道菌群失衡在肝细胞癌(HCC)发生中的作用及其潜在机制。研究者从HCC患者和健康志愿者中收集粪便样本,通过粪菌移植(FMT)技术将这些样本移植到无菌小鼠和特定病原体自由(SPF)小鼠中,以评估肠道菌群对肝脏病理变化的影响。将实验动物分为HCC-FMT组、健康供体FMT组和空白对照组,每组小鼠均接受或不接受致癌物二乙基亚硝胺(DEN)处理,以模拟HCC的发生过程。主要评价指标包括小鼠肝脏病理学变化、肠道屏障功能、细菌移位情况以及肝脏中细菌的定植情况。次要评价指标则涉及炎症反应、纤维化程度和肿瘤相关基因表达等。
03▼肠道菌群失衡引发肝癌:肺炎克雷伯菌的“罪证”确凿,关键数据揭示其致癌机制
肠道屏障功能受损与细菌移位
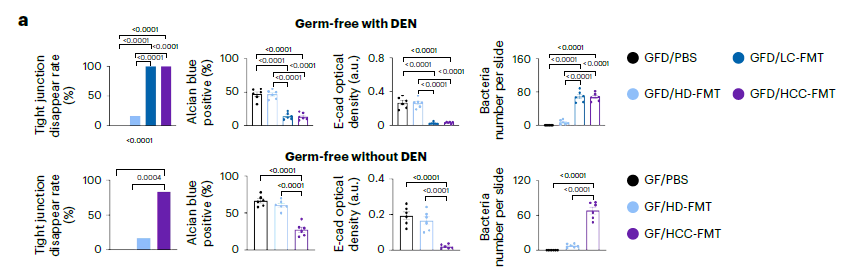
研究结果显示,HCC-FMT小鼠的肠道屏障功能显著受损,经DEN处理和无DEN处理的HCC-FMT小鼠肠道通透性均显著增加(P均<0.005)。透射电子显微镜(TEM)观察显示,HCC-FMT小鼠结肠细胞间的紧密连接消失,黏附连接增宽,导致肠道屏障功能受损。此外,HCC-FMT小鼠结肠黏液层厚度减少,紧密连接蛋白(如CLD3、CLD1和E-cadherin)表达下调,进一步加剧了细菌向肠黏膜固有层和肌层的浸润(图1)。
图1 HCC-FMT组小鼠结肠细胞间紧密连接消失,黏附连接增宽
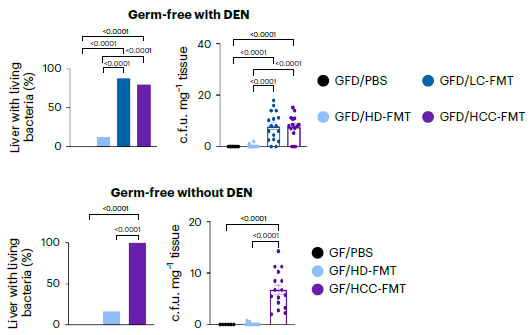
这些变化导致HCC-FMT小鼠肝脏中活细菌的检出率显著增加,几乎所有的HCC-FMT小鼠肝脏样本在厌氧和需氧培养中均呈阳性,而HD-FMT组和PBS组则大多为阴性(P<0.0001)。荧光原位杂交(FISH)检测也证实了这一结果,HCC-FMT小鼠肝脏中细菌检出率显著高于其他组(图2)。
图2 HCC-FMT组小鼠肝脏中活细菌的检出率显著增加
肺炎克雷伯菌的富集与致癌作用
通过对HCC-FMT小鼠肝脏组织的细菌培养和16S rRNA测序,研究发现K. pneumoniae是HCC-FMT组肝脏中富集最多的细菌,其次是Enterococcus faecalis、Proteus mirabilis等。此外,HCC-FMT小鼠肝脏中K. pneumoniae的数量显著高于HD-FMT组和PBS组(P<0.0001)。进一步的单菌定植实验表明,K. pneumoniae单菌定植小鼠(GF/KP)的肝脏病理学变化与HCC-FMT小鼠相似,表现为肝脏炎症、纤维化和异型增生。其中,GF/KP小鼠肝脏中K. pneumoniae的检出率为80%,而GF/EC(大肠杆菌)小鼠和PBS组均为0%(P<0.0001,图3)。这些结果表明,K. pneumoniae在HCC-FMT小鼠肝脏中的富集与其致癌作用密切相关。
注:c. 16S rRNA测序显示K. pneumoniae在HCC患者肝脏中的富集;d. 绝对定量qPCR显示K. pneumoniae的数量增加。
图3 HCC患者肝脏组织中活细菌的富集,特别是K. pneumoniae
K. pneumoniae的分子机制
通过扫描电子显微镜(SEM)和TEM观察,发现K. pneumoniae能够附着在HCC细胞表面,细胞附着实验也证实了这一结果。此外,研究发现K. pneumoniae的热处理上清液(KPCM)对HCC细胞的增殖无显著影响,但与HCC细胞共培养的K. pneumoniae能够促进HCC细胞的增殖和克隆形成。
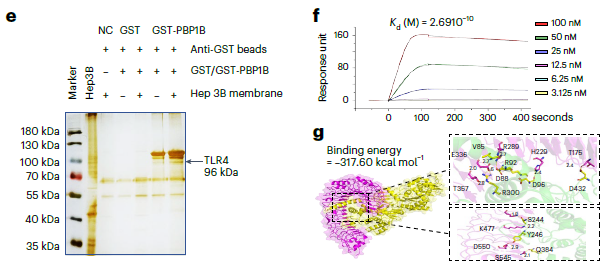
进一步的分子机制研究发现,K. pneumoniae的表面蛋白PBP1B能够与HCC细胞上的TLR4结合,激活TLR4信号通路,从而促进HCC细胞的增殖和致癌信号的激活(图4)。数据显示,PBP1B与TLR4的结合亲和力为0.269 nM,且PBP1B能够显著增加TLR4、MyD88、p-P65和PCNA的蛋白表达水平(P<0.0001)。TLR4抑制剂(TLR4-IN-C34)能够阻断PBP1B诱导的HCC细胞增殖(P<0.0001),表明TLR4是K. pneumoniae促进HCC的关键靶点。
注:e. GST拉下实验,显示PBP1B与TLR4的结合;f. 表面等离子共振(SPR)实验,显示PBP1B与TLR4的结合亲和力;g. 分子对接分析,显示PBP1B与TLR4的结合位点。
图4 K. pneumoniae通过其表面蛋白PBP1B与TLR4结合并激活TLR4信号通路,促进HCC
K. pneumoniae的致癌作用验证为了进一步验证K. pneumoniae的致癌作用,研究者进行了K. pneumoniae单菌定植实验。结果显示,K. pneumoniae单菌定植小鼠(GF/KP)的肝脏病理学变化与HCC-FMT小鼠相似,表现为肝脏炎症、纤维化和异型增生。具体数据表明,GF/KP小鼠肝脏中K. pneumoniae的检出率为80%,而GF/EC(大肠杆菌)小鼠和PBS组均为0%(P<0.0001)。此外,GF/KP小鼠的肝脏中检测到显著的炎症细胞浸润和纤维化标志物表达增加。这些结果进一步证实了K. pneumoniae在HCC中的致癌作用。
04▼总结
本研究通过系统的实验设计和多组学分析,揭示了肠道菌群失衡在肝细胞癌发生中的重要作用,特别是肺炎克雷伯菌的促癌机制。这一发现不仅为理解肠道菌群与HCC的关系提供了新的视角,还为未来的治疗策略提供了新的靶点。展望未来,基于肠道菌群的干预措施,如益生菌疗法或特定病原菌的靶向治疗,可能为HCC的预防和治疗提供新的途径。同时,深入研究肠道菌群与HCC的分子机制,有望开发出更有效的诊断标志物和治疗手段。
参考文献
WANG X, FANG Y, LIANG W, et al. Gut-liver translocation of pathogen Klebsiella pneumoniae promotes hepatocellular carcinoma in mice[J]. Nat Microbiol, 2025, 10(1):169-184. DOI: 10.1038/s41564-024-01890-9.
“医学论坛网”发布医学领域研究成果和解读,供专业人员科研参考,不作为诊疗标准,使用需根据具体情况评估。
链接:http://www.lewenyixue.com/2025/03/10/%E8%82%A0%E9%81%93%E8%8F%8C%E7%BE%A4%E5%A4%B1%E8%A1%A1%E7%AB%9F%E6%88%90%E8%82%9D%E7%99%8C%E2%80%9C%E5%B8%AE%E5%87%B6%E2%80%9D%EF%BC%9FNatur/







赶快来坐沙发