Cell Rep Med|薛婧团队揭示靶向胰腺癌谷氨酰胺依赖性增强铁死亡敏感性
谷氨酰胺是肿瘤中至关重要的营养物质,它不仅提供碳源来推动三羧酸循环,还为核苷酸、非必需氨基酸、氨基糖合成以及谷胱甘肽的生成提供氮源。胰腺导管腺癌 (PDAC) 是一种血管生成不足且间质压力较高的肿瘤,通常处于营养匮乏状态。有研究显示,与周围组织相比,胰腺肿瘤内的谷氨酰胺含量最为缺乏。PDAC细胞表现出强烈的“谷氨酰胺依赖性”,来满足其旺盛的生物合成需求。肿瘤的发展依赖于细胞在代谢压力下的灵活适应性,已有报道发现精氨酸代谢和MAPK信号通路参与谷氨酰胺缺乏的快速反应。然而,肿瘤细胞耐受谷氨酰胺长期缺乏的适应性机制仍不明确。
近日,来自上海交通大学医学院附属仁济医院的 薛婧 团队在 Cell Reports Medicine 杂志上在线发表题为: Targeting pancreatic cancer glutamine dependency confers vulnerability to GPX4-dependent ferroptosis 的文章, 发现靶向谷氨酰胺依赖性通过表观遗传重塑赋予胰腺肿瘤细胞对 GPX4 依赖性铁死亡的易感性,为胰腺癌的治疗提供了一种新的联合策略。
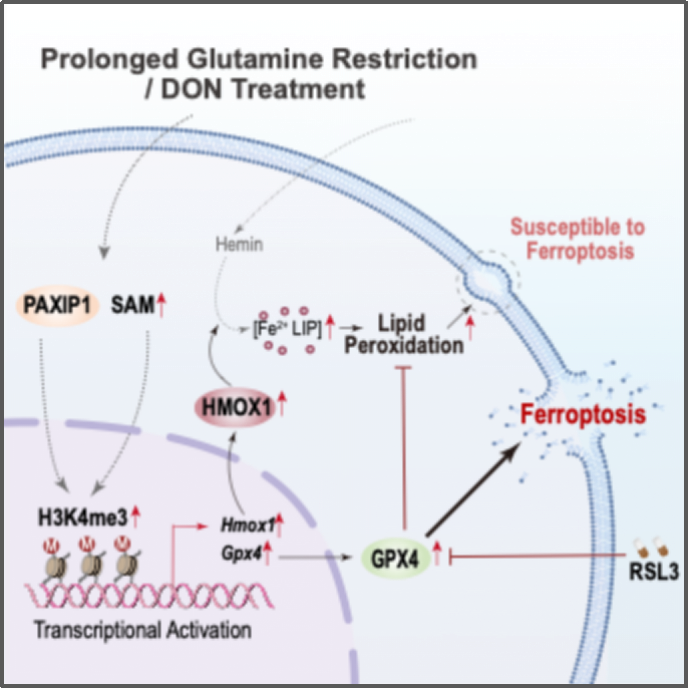
在本研究中,研究者通过体外模型模拟长期代谢应激,发现短期 (3天) 谷氨酰胺剥夺显著抑制细胞生长,但在长期剥夺后表现一定的适应性,即出现增殖速率回升现象 (6-9天) 。进一步机制研究表明,长期耐受谷氨酰胺缺乏过程中,胰腺肿瘤细胞通过剧烈的染色质开放性重排以适应代谢压力。CRISPR-Cas9筛选揭示PAXIP1-H3K4me3上调是耐受谷氨酰胺缺乏的关键表观调控事件,进而激活铁死亡程序:选择性地上调铁死亡诱导基因 (HMOX1) ,促进亚铁离子积累,引发脂质过氧化;与此同时,铁死亡相关的抑制因子 (SLC7A11和GPX4) 上调以平衡过度的脂质过氧化。基于此研究者提出了一种结合谷氨酰胺代谢靶向和GPX4抑制剂的联合靶向新策略。
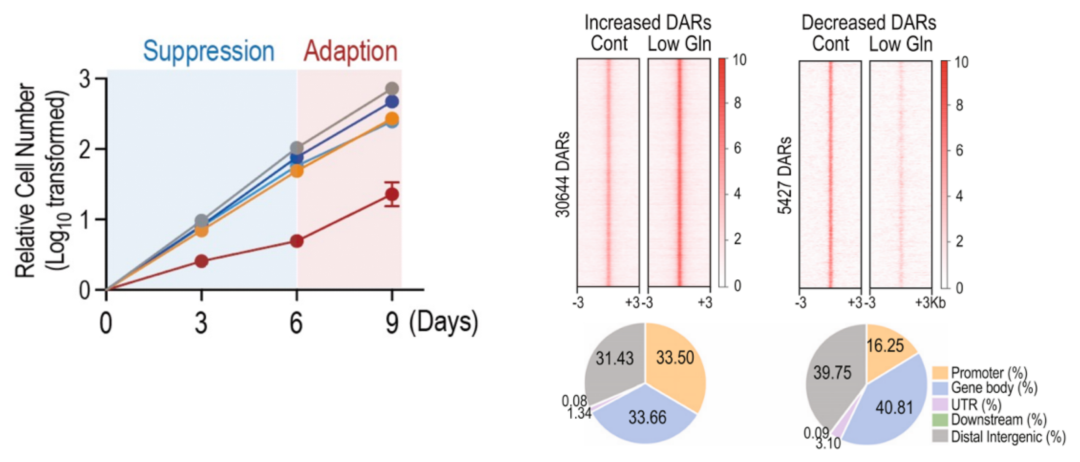
综上所述,本研究揭示了表观遗传元件在胰腺肿瘤细胞适应长期谷氨酰胺缺乏中的关键调控作用,识别了肿瘤细胞在此过程中表现出的代谢脆弱性,并据此提出了潜在的联合靶向策略。
上海交通大学医学院附属仁济医院薛婧研究员、牛宁宁副研究员、王理伟主任,基础医学院唐玉杰研究员为该研究论文的共同通讯作者。仁济医院博士研究生沈叙清、硕士研究生陈月月为该论文的共同第一作者。
原文链接:https://doi.org/10.1016/j.xcrm.2025.101928
制版人:十一
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2025/02/11/Cell%20Rep%20Med%EF%BD%9C%E8%96%9B%E5%A9%A7%E5%9B%A2%E9%98%9F%E6%8F%AD%E7%A4%BA%E9%9D%B6/
THE END








赶快来坐沙发