破解肝癌细胞的代谢“超能力”,浙大吕志民团队发现“老药新用”抑制肿瘤生长的新策略
肝脏是人体内脂肪代谢的场所。肝细胞氧化分解脂肪酸时,产生一类统称为 酮体 (ketone body)的 中间代谢物,包括β-羟基丁酸、乙酰乙酸和丙酮等。肝脏产生的酮体经血液循环进入脑、心脏和肌肉等器官,通过酮体分解(ketolysis)途径产生乙酰辅酶A,后者进入三羧酸循环产生能量。
通常来说,肝脏自身并不能利用酮体。然而,“贪得无厌”的肿瘤细胞是个例外。为满足快速增殖的物质与能量需求,肿瘤细胞往往会进行代谢重编程,以便充分利用一切可以利用的营养物质。 肝细胞癌(HCC)细胞就获得了代谢酮体的“超能力” ,能够像其他组织的细胞那样激活酮体分解途径,分解酮体为自身产生能量。
HCC细胞是如何获得代谢酮体的能力的?破解其具体机制,有望找到遏制肿瘤生长的新方法。
近日,浙江大学转化医学研究院、浙江大学医学院附属第一医院、国家基础科学中心及浙江大学基础交叉研究院的吕志民教授团队在 Molecular Cell 期刊上发表论文, 揭示了SUCLA2通过非经典功能激活酮体代谢的全新机制 。
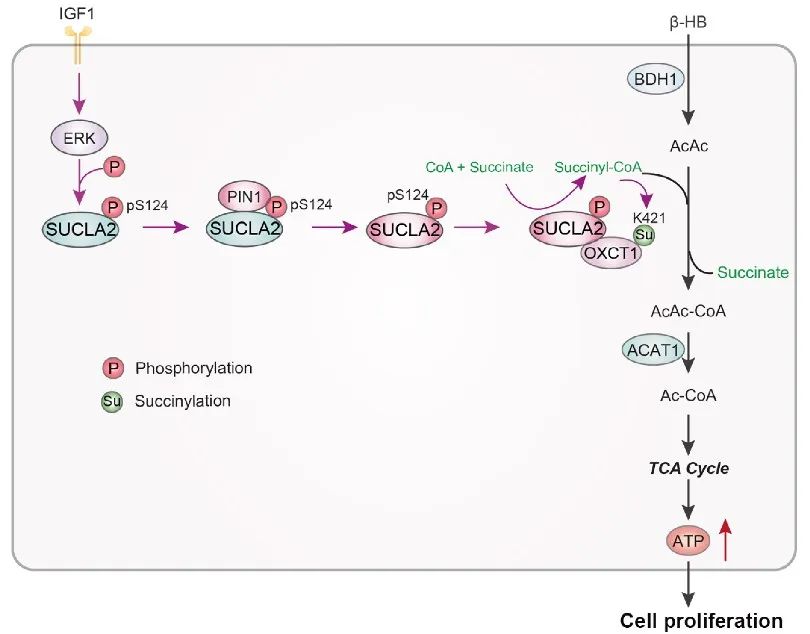
SUCLA2是三羧酸循环中的代谢酶,其经典的代谢功能是催化琥珀酸生成琥珀酰辅酶A,促进三羧酸循环。
而在这项研究中,作者发现,在IGF1处理的HCC细胞中,SUCLA2的S124位点被磷酸化后,在PIN1蛋白的作用下发生异构化,进而可与OXCT1发生结合。 OXCT1是酮体分解途径中的关键代谢酶 ,能催化琥珀酰化辅酶A和乙酰乙酸产生乙酰乙酰辅酶A,后者被进一步分解为乙酰辅酶A。
SUCLA2与OXCT1的结合,使SUCLA2的代谢产物琥珀酰辅酶A可以直接作用于OXCT1,这一方面给OXCT1催化的代谢反应提供了底物,另一方面琥珀酰辅酶A可以直接在OXCT1的K421位点产生琥珀酰化修饰,促进OXCT1结合底物的能力,从而增强OXCT1的酶活。这两方面的协同作用,显著促进了OXCT1介导的酮体分解代谢,产生更多的乙酰辅酶A进入三羧酸循环,进而产生更多的能量,支持了HCC细胞的快速增殖和肿瘤的生长。
▲HCC细胞中,SUCLA2激活酮体代谢的机制示意图(图片来源:研究团队提供)
根据肝癌细胞酮体代谢重编程的这一机制,研究团队提出了一种全新的治疗策略: 中断酮体分解,抑制肿瘤生长 。
研究团队发现,临床上一种被用来治疗尿路感染的药物 乙酰氧肟酸可作为OXCT1的抑制剂 ,将乙酰氧肟酸与肝癌治疗一线药物乐伐替尼(lenvatinib)联合使用,在动物实验中能够抑制小鼠肝脏肿瘤的生长,显著增强乐伐替尼的效果。
综上所述,该研究揭示了 SUCLA2既可以通过其经典的代谢功能促进三羧酸循环,还具有非经典功能直接参与到酮体分解途径 。其与OXCT1的结合通过两种途径共同增强了肝癌细胞的酮体分解代谢水平,促进了肝癌细胞对酮体这一非经典营养物质的利用,最终促进了肝癌的发展。未来,通过抑制酮体代谢来抑制肿瘤生长有望为治疗肝细胞癌提供新的方向。
链接:http://www.lewenyixue.com/2025/02/06/%E7%A0%B4%E8%A7%A3%E8%82%9D%E7%99%8C%E7%BB%86%E8%83%9E%E7%9A%84%E4%BB%A3%E8%B0%A2%E2%80%9C%E8%B6%85%E8%83%BD%E5%8A%9B%E2%80%9D%EF%BC%8C%E6%B5%99%E5%A4%A7%E5%90%95%E5%BF%97%E6%B0%91/





赶快来坐沙发