综述:骨髓增殖性肿瘤进展为急性髓系白血病的预防和治疗
费城染色体阴性(Ph 阴性)骨髓增殖性肿瘤(MPN)进展为加速期(AP)或急变期(BP)的风险受临床、病理、细胞遗传学和分子学变量的影响。目前治疗方法下,MPN-AP/BP 患者的总体生存有限(中位总生存期为4-9个月,加入急性髓系白血病[AML ]方案也不足12个月),尤其是无法接受异基因造血干细胞移植(allo-HCT)的患者。此外,allo-HCT的长期生存主要见于慢性期 MPN,表明 干预的理想时间可能在 MPN演变为 AP/BP 之前 。
《Haematologica》近日发表综述,重点关注进展为 MPN-AP/BP 的风险因素、高危慢性期 MPN 的识别、潜在的早期干预策略以及allo-HCT时机选择的考虑因素,还总结了 MPN-AP/BP 患者的当前生存结局,讨论了评估治疗反应的不确定性,概述了针对这一患者群体的临床试验考虑因素,并强调了治疗高危 MPN 的未来方向。
疾病进展为MPN-AP/BP
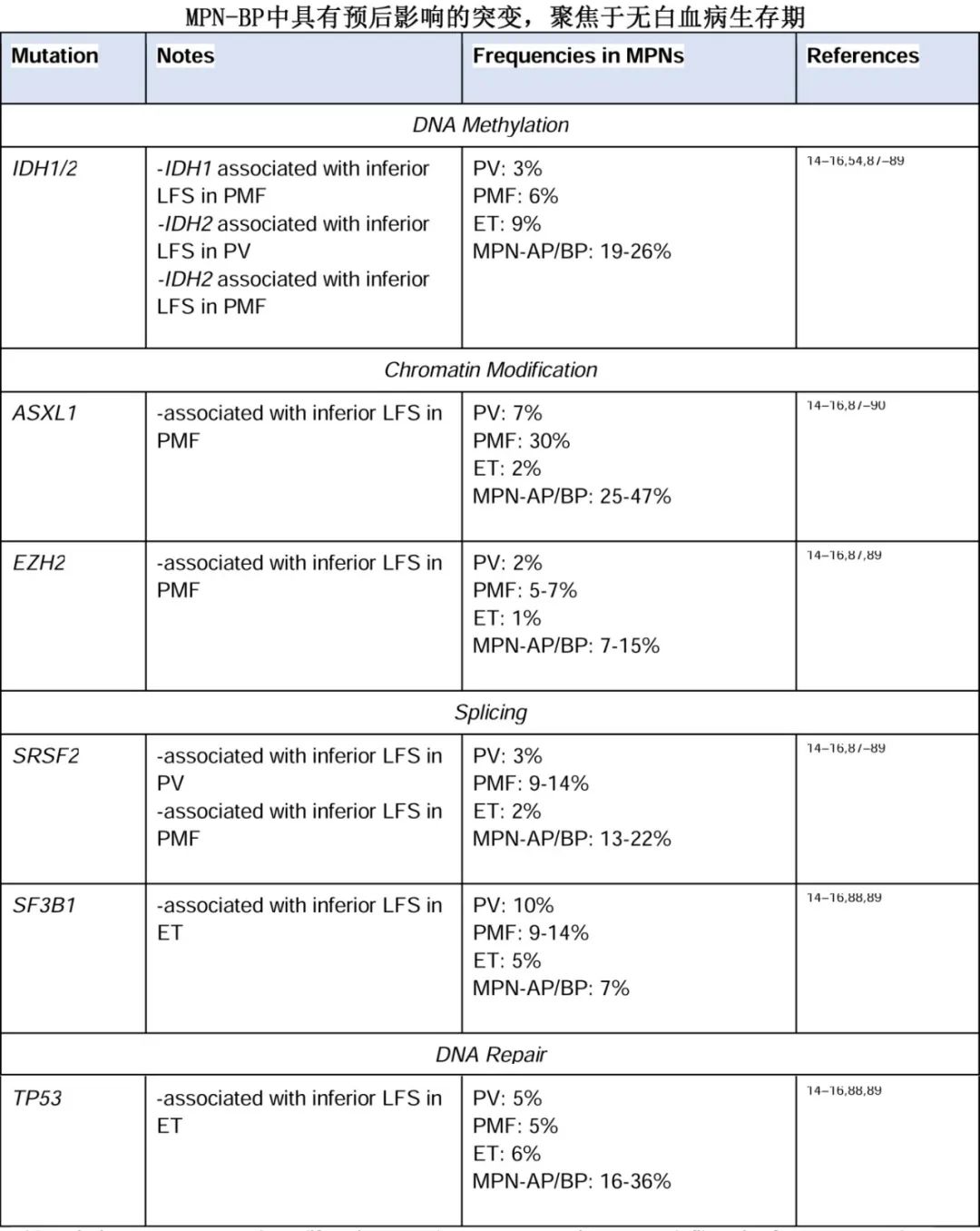
虽然已经为原发性骨髓纤维化(PMF)开发了许多预后工具,但目前对于慢性期MPN还没有整体风险分层可捕捉到进展为MPN-AP/BP的风险。在疾病慢性期获得高危突变是骨髓增殖性肿瘤进展中的一个关键事件,但红细胞增多症(PV)、原发性血小板增多症(ET)和PMF中具有预后影响的突变也有所不同。下表总结了MPN-BP中具有预后影响的突变。
对于PMF,生存结局的主要影响因素包括年龄、外周血细胞计数异常和细胞遗传学特征;此外特定因素在MPN-BP的发展方面具有更大的预后价值,例如动态国际预后系统(DIPSS)评分表明血小板减少症和不良染色体核型是 MPN-BP 10 年风险的预测因素。更新的评分也纳入了高危分子写突变,有助于识别高危患者群体。单个突变也与不良预后相关,并已纳入突变增强的国际预后评分(MIPSS)70-plus;极高分患者中有 23%发生 MPN-BP 进展。近期一项分析结合了CBL、NRAS、KRAS、RUNX1 和 TP53 的突变状态以及基于 MIPSS 的预后评分;多变量分析显示ASXL1、SRSF2、U2AF1 Q157 和 EZH2具有显著意义,而IDH1、IDH2、TP53、CBL、NRAS 或 KRAS无意义。该研究表明,即使分子学评分已被纳入临床实践,但对于PMF仍未完全确定哪些突变确实是高危。关于高危 PMF 突变中allo-HCT时机的问题将在下文讨论。
通过评估PMF患者的风险并进行allo-HCT来预防进展为MPN-AP/BP仍是治疗策略的基石。然而,尽管allo-HCT在 PMF 中的作用已得到充分确立,但对于PV和ET患者的干预方式尚不太明确,尤其是在极为担忧疾病进展的情况下。通常来说,针对这两种疾病慢性期的策略都集中在降低血栓风险上,但对疾病演变的评估(或治疗选择)关注较少。此外,PV 和 ET 进展为 MPN-AP/BP 的通路并非都有纤维化阶段;帕兹等对 49 例从 PV 或 ET 发展为 MPN-BP 的患者进行分析,指出其中只有 16%的患者在 MPN-BP 进展之前有继发性MF。MPN-BP 发展的时间因存在的突变谱不同而有很大差异;IDH1、IDH2、RUNX1 和 U2AF1 突变与较短的潜伏期相关,而 TP53、NRAS 和 BCORL1 突变与较长的 MPN-BP 发展时间相关。鉴于PV和ET中进展为MPN-BP的分子学异质性,在慢性期具有抗克隆作用的治疗干预可能是预防疾病进展的一种手段。MAJIC-PV 研究是一项随机的 II 期研究,纳入羟基脲经治PV患者以比较芦可替尼与现有最佳疗法治疗的疗效;芦可替尼组达到了完全缓解(CR)这一主要终点。该研究还根据分子学反应分析了学;分子学反应定义为 JAK2 V617F 变异等位基因频率(VAF)减少>50%。接受芦可替尼治疗的患者实现分子学反应与无事件生存期(EFS)和总生存期(OS)改善显著相关。值得注意的是,同时存在 ASXL1 突变的患者接受芦可替尼治疗不太可能实现分子学反应。分子学反应的深度似乎也对结局有影响。Guglielmelli 等分析了 75 例接受芦可替尼治疗的 JAK2 突变PV或ET患者,将 JAK2 分子学反应定义为完全缓解(<0.01%)、深度缓解(<2%)或部分缓解(VAF 减少 50%)。14 例达到≥CR的患者均未进展为MF或MPN-BP;另一方面,所有 3 例进展为MPN-BP的患者均无分子学反应。研究研究评估在PV和ET中使用干扰素,也表明有可能实现持续的分子学反应。因此,在PV和ET患者中开展研究并聚焦于防止克隆演变和无进展生存期,仍是一个需要进一步研究的领域。
除了疾病进展的分子驱动因素外,慢性期MPN中存在的炎症微环境也是疾病进展的关键组成部分。例如,已证实白细胞介素-8(IL8)与PMF向MPN-BP进展相关。此外,对MPN的单细胞多组学分析表明,慢性炎症为 TP53 突变细胞提供优势,并导致后续发生TP53 突变MPN。炎症在髓系疾病进展中的作用不仅限于MPN;在潜能未定的克隆性造血(CHIP)中的炎症亦可赋予选择优势和克隆性扩增,最终导致明显的髓系恶性肿瘤。目前正在研究canakinumab等抗炎疗法在等各种慢性髓系疾病(CHIP、较低危MDS、慢性粒单核白血病、MPN)中的作用,但这些策略是否会改变克隆性进展还有待确定。
Allo-HCT在高危MPN中的应用
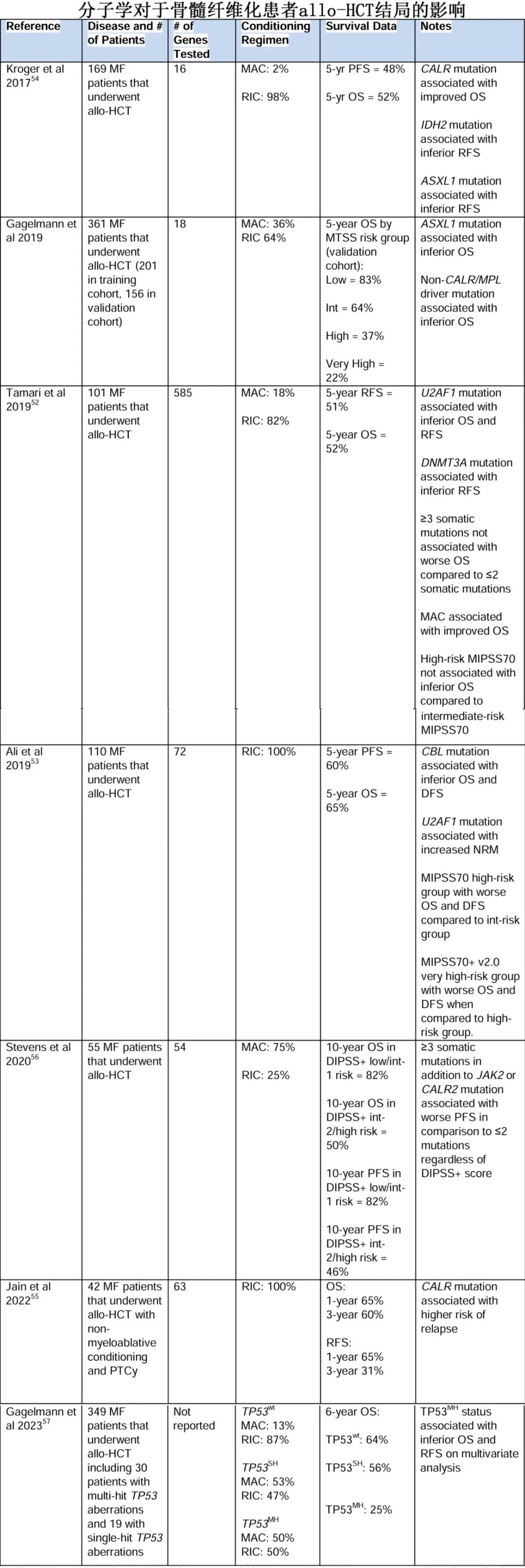
当慢性期MPN患者进入纤维化阶段时,考虑allo-HCT主要取决于患者特征和风险状况。由于目前尚无获批的疗法无法显著降低MF进展为MPN-BP的风险,allo-HCT是唯一一种能够影响M的自然进展并具有治愈潜力的方式。回顾性研究已证实,根据DIPSS,allo-HCT对中危2 或高危患者有益;allo-HCT对低危/中危 1 患者的获益并不明确。如何将高危突变纳入MF的allo-HCT决策则更不明确。多项研究调查了高危突变对 MF allo-HCT结局的影响,但结果相互矛盾,如下表所示。虽然 TP53 突变未纳入 MF 预后评分,但研究已分析了 TP53 状态对 MF allo-HCT结局的影响。在一组 349 例接受allo-HCT的 MF 患者中,49 例患者有 TP53 突变:TP53 突变患者的中位总生存期为 1.5 年,而 TP53 野生型患者为 13.5 年;多打击TP53 异常的患者预后最差,而单打击 TP53 异常的患者预后与 TP53 野生型患者相似。总体而言,对于符合条件的中危2/高危患者,应强烈考虑allo-HCT;对于基于突变谱的高危患者,情况则不太明确。对于单打击 TP53 突变患者,作者也强烈考虑allo-HCT,但allo-HCT的时机选择是防止疾病进展为MPN-AP/BP的关键考虑因素,而关于移植时机的最佳决策仍是 MF 中一个关键的未解决问题。
对于进展为MPN-AP/BP的患者,allo-HCT是唯一具有治愈潜力的治疗方式。从历史上看,人们曾考虑在allo-HCT前减轻原始细胞负荷,但并非所有MPN-AP患者都有此必要。Gagelmann 等报告了 35 例allo-HCT时处于加速期的MF患者;尽管与allo-HCT时处于慢性期的MF患者相比复发率较高,但该人群中仍观察到持久缓解,5 年总生存率为 65%。
不幸的是,MPN-BP患者allo-HCT的结局不如MPN-AP患者。欧洲血液和骨髓移植学会(EBMT)对 663 例接受allo-HCT的 MPN-BP 患者进行的分析报告称,3 年总生存率为 36%;规模较小的分析报告称,生存率介于5 年总生存率 18%到 4 年总生存率38%。值得注意的是,原始细胞<5%与allo-HCT的结局改善无关。对于符合条件的 MPN-BP 患者,应强烈考虑allo-HCT;然而在进行allo-HCT之前所需的缓解深度尚不清楚。这些数据建议对allo-HCT进行干预的时间应在慢性期或加速期;虽然部分MPN-BP患者接受allo-HCT后可实现 长期生存 ,但慢性期或加速期MPN患者长期生存的可能性要低得多。
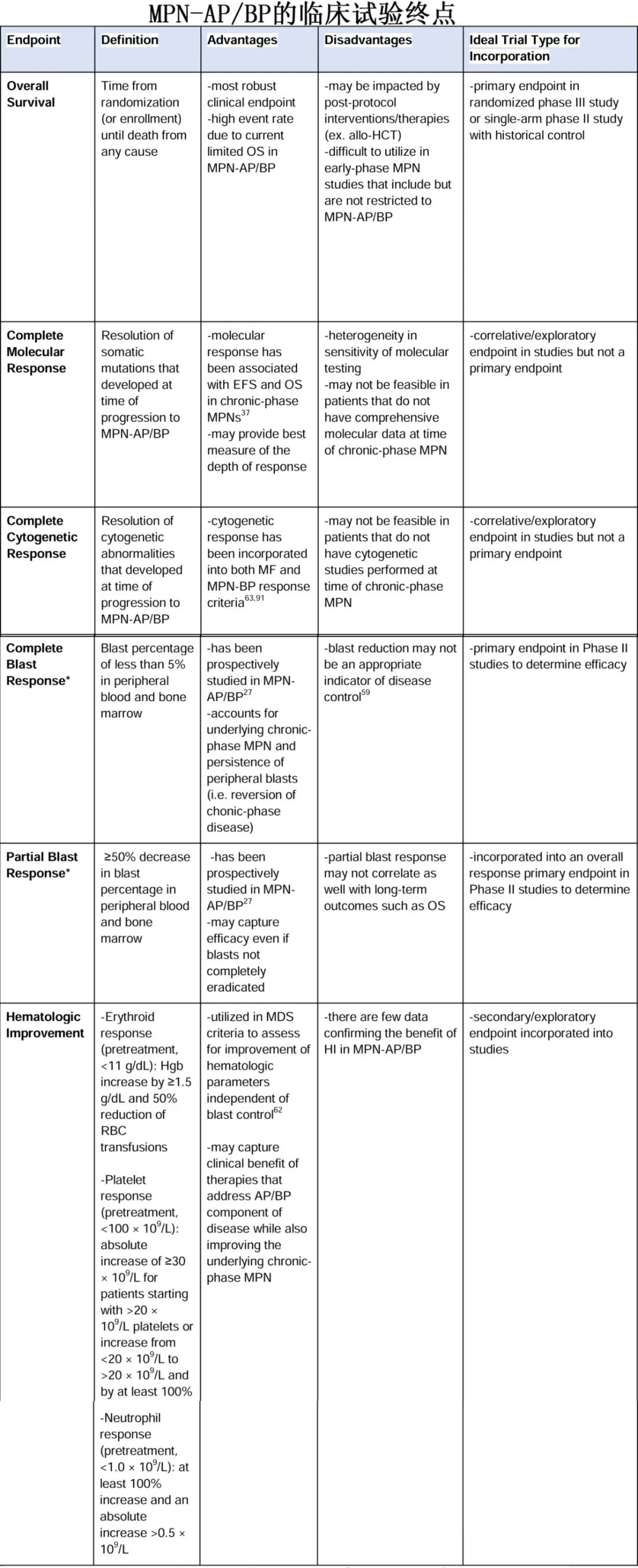
评估治疗反应
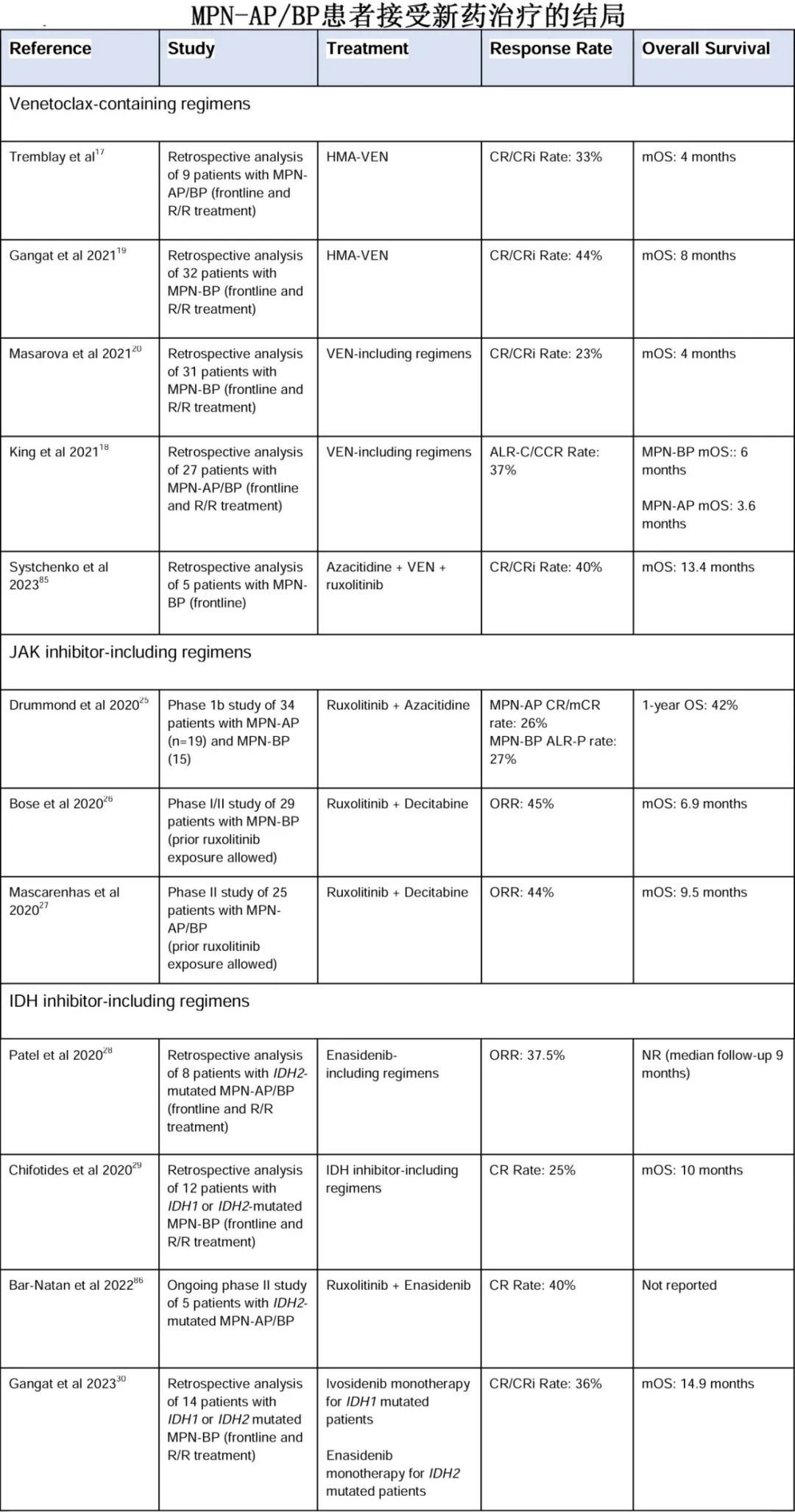
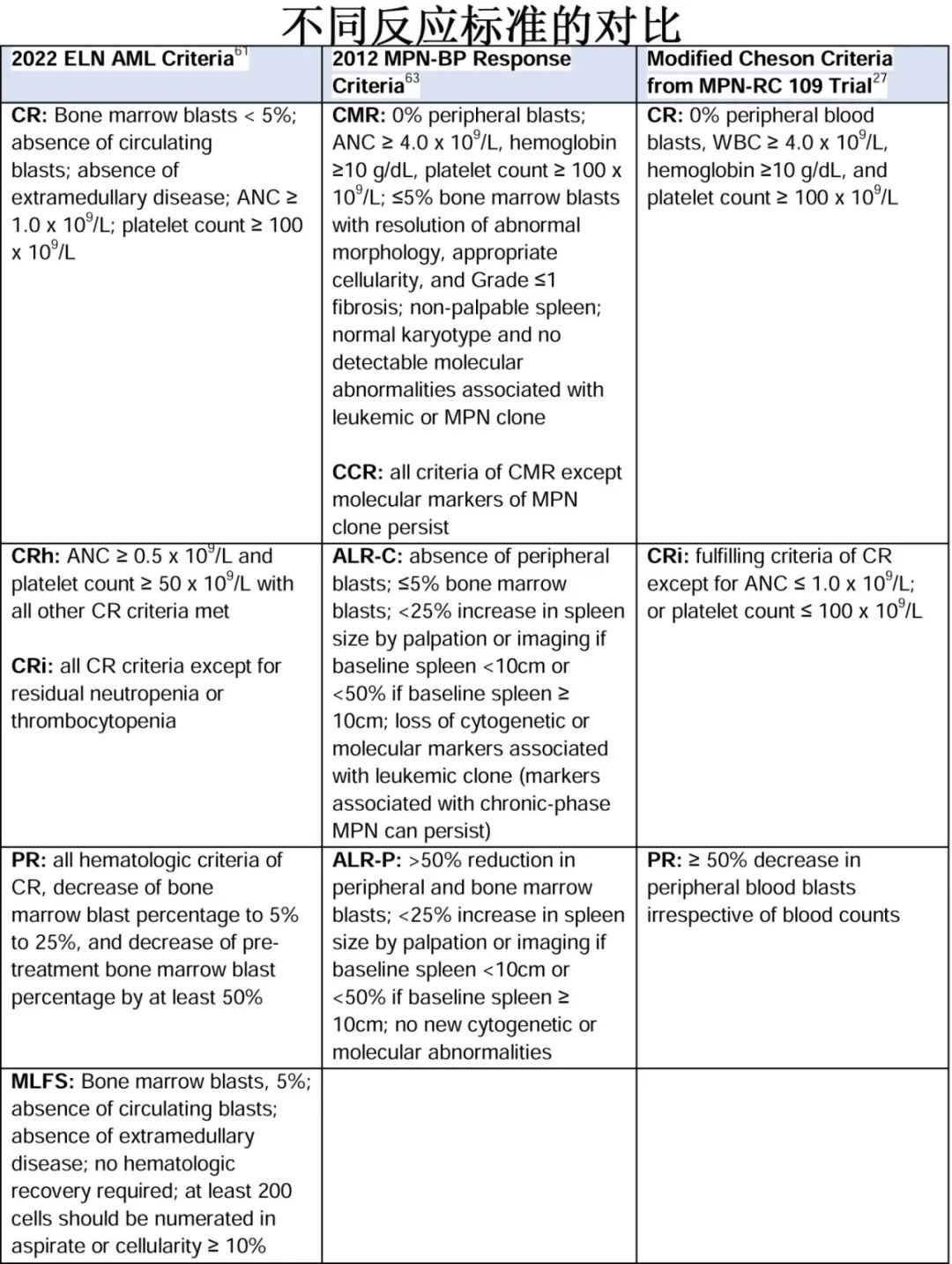
MPN-AP/BP患者对治疗的反应评估存在异质性。虽然针对AML和较高危MDS已有既定且近期修订的反应标准,但针对 MPN-AP/BP 的最新标准还是来自 2012 年,该标准是为了考虑疾病的两个方面——慢性期 MPN的AP/BP部分。例如,骨髓纤维化、白细胞增多以及消除与 MPN 克隆相关的分子标志物是 2012 年反应标准的一部分。此外,AML的反应标准与生存结局的相关性在 MPN-AP/BP 中并不一致,正如de novo AML中那样。接受allo-HCT的 MPN-BP 患者中原始细胞减少对预后没有影响,但allo-HCT时原始细胞<5%的MPN-BP 患者的结局比allo-HCT时原始细胞<5%的AML患者的结局要差得多。MPN-BP和AML反应 标准不一致的潜在原因包括:MPN 患者外周血和骨髓原始细胞之间不一致、脾脏作为髓外转化部位,以及脾脏中(相对于血液)造血干细胞群的克隆性不同。此外对于MPN-AP/BP患者,连续的外周血原始细胞计数之间可能会有相当大的差异,从而可能会混淆评估结果。下表比较了 2022 欧洲白血病网(ELN)AML 标准、2012 年 MPN-BP 标准和改良的 Cheson 标准对反应的评估。
在缺乏allo-HCT的情况下,确认哪种反应标准最能预测生存的大型分析尚未开展,从而导致即使是在专门评估MPN-AP/BP的前瞻性研究中,反应评估也会有相当大的差异。例如,在第一个表中总结的三项DNMTi + JAKi研究中,反应是通过MDS标准、2012 MPN-BP、标准AML标准和改良的AML标准来评估的。随着针对 MPN-AP/BP 的新型疗法不断研究,统一反应标准对于表征疗效至关重要。鉴于一旦MPN中的原始细胞百分比≥10%,则疾病的性质就相似,使用传统的 20%的阈值来确定应使用何种反应标准不太适合。最终,能够捕捉到原始细胞百分比降低和外周血细胞计数改善的反应标准可能最有帮助;增加细胞遗传学和分子学反应可能会深入了解缓解的深度以及其如何影响长期生存。鉴于慢性期MPN特征(如骨髓纤维化)与 MF 疗效结局没有强相关性,纳入这些特征的效用不太明确。需要对现有的反应标准进行分析,以便确定具有临床意义的标准,用于评估针对 MPN-AP/BP 的新型疗法。下表提出了在评估MPN-AP/BP的新型疗法时可能最有意义的终点指标,但夜莺认识到每个终点指标都有其优点和缺点。此外,MPN患者报告的结局工具如果经过验证,也应常规纳入MPN-AP/BP研究中,以捕捉除反应和生存结局之外的影响。
MPN-AP/BP的前瞻性研究注意事项
将MPN-AP/BP患者纳入前瞻性研究是一个独特且棘手的问题;慢性期MPN研究通常会有原始细胞的cutoff值,针对MDS和AML的研究会排除既往MPN患者。该情况最终导致治疗数据是由真实世界分析所产生,因为缺乏可用的前瞻性数据。例如,CPX-351在继发性AML患者中专门研究,而排除先前有MPN的患者。目前CPX-351在MPN-AP/BP中的数据来自对12例患者的真实世界分析。此外,靶向治疗髓系疾病的举措,如BEAT AML和MYELOMATCH也没有专门为MPN-AP/BP设计的研究。为了确定具有潜在疗效的新疗法,建议在慢性期MPN的早期研究中纳入MPN-AP/BP队列。此外,在靶向治疗方案中,应强烈考虑纳入具有相应分子标志物的MPN-AP/BP。
结论与未来方向
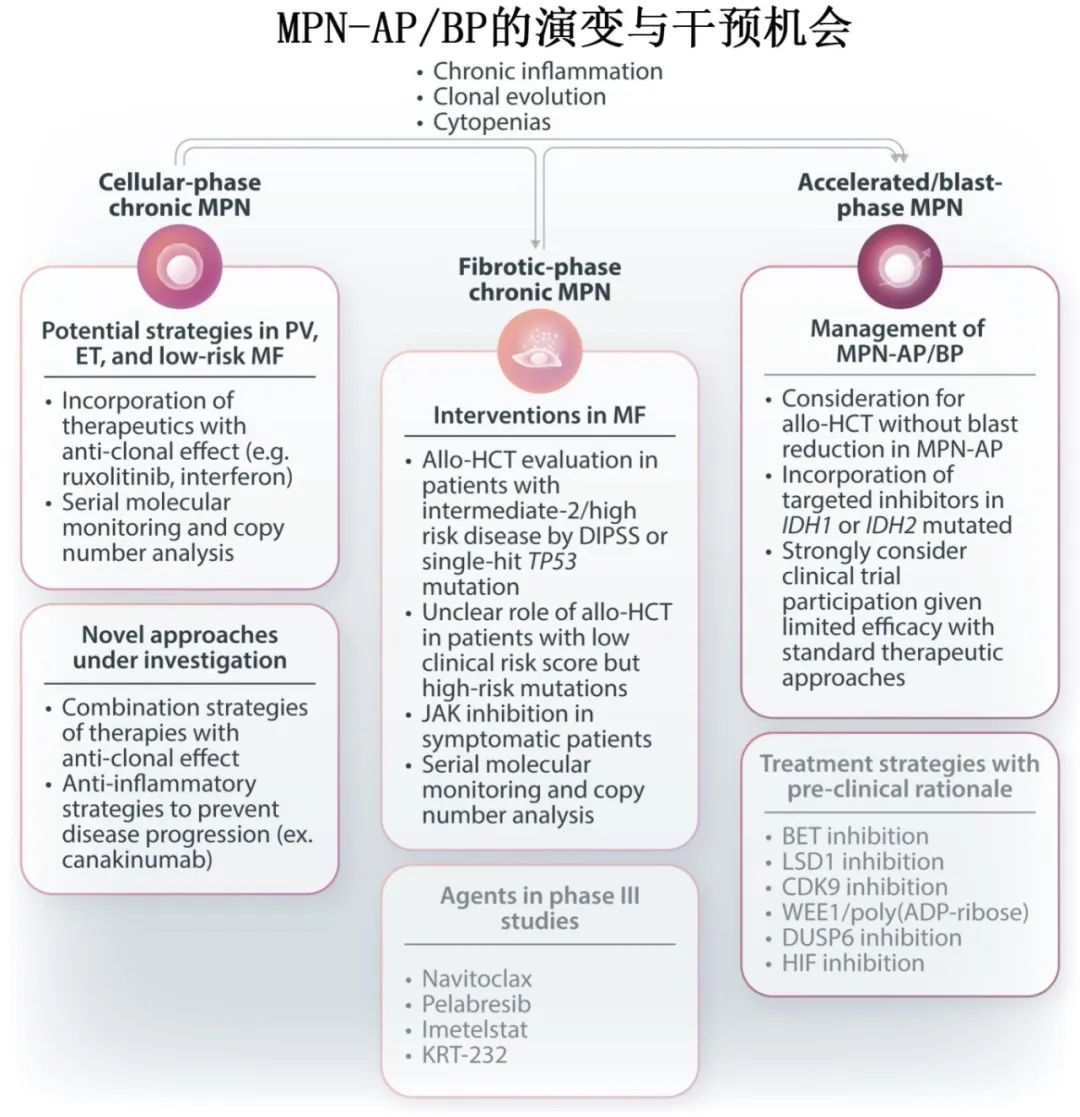
尽管在骨髓恶性肿瘤的治疗方法有所发展,但MPN-AP/BP的治疗仍极具挑战性。下图概述了MPN-AP/BP的当前预防和治疗方法,同时也考虑了正在研究的新策略。作者认为,对治疗MPN-AP/BP有重大影响的策略如下:识别出进展为MPN-AP/BP风险最高的慢性MPN患者,制定有可能阻止或延缓进展的策略,考虑allo-HCT的时机,协调MPN-AP/BP反应标准,将MPN-AP/BP纳入髓系恶性肿瘤的早期研究中以确定值得进一步开发的疗法。针对PV和ET的研究不仅应关注血液学控制的初级终点,还应生成有关分子学反应及其如何影响疾病进展的数据。在骨髓纤维化方面也在进行类似的努力,呼吁超越脾脏反应和症状评估,以更好地理解疾病修正意味着什么,以及是否可以在不进行allo-HCT的情况下实现疾病修正。骨髓纤维化的多种联合策略正在研究中,包括Ⅲ期研究,研究芦可替尼+navitoclax和芦可替尼+pelabresib,它们都达到了主要终点;长期随访可能有助于确定它们对疾病自然史的影响。此外还有令人鼓舞的临床前数据阐明MPN-AP/BP中可能成为靶点的进展通路,例如 LKB1/STK11 缺失和 DUSP6 异常表达。此外,新的策略,如 BET 抑制、LSD1 抑制、CDK9 抑制以及 WEE1/聚(ADP-核糖)聚合酶抑制的联合,都有临床前数据支持在未来的临床研究中对这些靶点开展研究。
参考文献
Anand A. Patel and Raajit K. Rampal. Prevention and treatment of transformation of myeloproliferative neoplasms to acute myeloid leukemia.Haematologica. 2024 Oct 24. doi: 10.3324/haematol.2023.283950
链接:http://www.lewenyixue.com/2025/01/10/%E7%BB%BC%E8%BF%B0%EF%BC%9A%E2%80%8B%E9%AA%A8%E9%AB%93%E5%A2%9E%E6%AE%96%E6%80%A7%E8%82%BF%E7%98%A4%E8%BF%9B%E5%B1%95%E4%B8%BA%E6%80%A5%E6%80%A7%E9%AB%93%E7%B3%BB%E7%99%BD%E8%A1%80/






赶快来坐沙发