【论著】机器人与腹腔镜治疗中低位直肠癌短期疗效比较的倾向性匹配分析
引用本文 : 李瑞奇, 周家杰, 赵帅, 等. 机器人与腹腔镜治疗中低位直肠癌短期疗效比较的倾向性匹配分析[J]. 中华胃肠外科杂志, 2024, 27(12): 1261-1268. DOI: 10.3760/cma.j.cn441530-20240130-00050.
作者: 李瑞奇 周家杰 赵帅 王道荣
作者单位:南京大学医学院临床教学医院苏北人民医院 南京大学医学院临床教学医院苏北人民医院 江苏省苏北人民医院胃肠外科 扬州大学-扬州市普通外科研究所 扬州市消化病/代谢病基础与临床转化重点实验室
摘要
目的 探讨机器人与腹腔镜手术治疗中低位直肠癌的短期疗效。
方法 本研究采用回顾性队列研究方法,纳入2019年7月至2021年11月期间在南京大学附属苏北人民医院采用腹腔镜或机器人行直肠癌根治术治疗的中低位直肠癌(肿瘤下缘距肛缘<10 cm)患者临床资料,排除未能完全保留肛门、癌性梗阻或穿孔、术前低位前切除综合征(LARS)评分显示肛门功能差以及随访资料不完整的患者。共973例符合标准纳入研究。为减少基线不平衡时患者之间的偏差,采用1∶2最近邻匹配法进行倾向评分匹配,机器人组175例,腹腔镜组350例;两组基线资料的比较,差异无统计学意义。主要观察指标为两组肿瘤学预后[无病生存率(DFS)和总体生存率(OS)]和肛门功能(术后6个月和12个月采用LARS评分系统进行评估)的比较。次要观察指标为患者术后生活质量(根据生命质量测定量表QLQ-C30及QLQ-CR38来建立新的量表,于术后6个月和12个月进行评估;功能模块评分越高,表示患者功能越好,而体征模块评分越低,表示症状越轻)以及患者围手术期相关并发症发生率的比较。
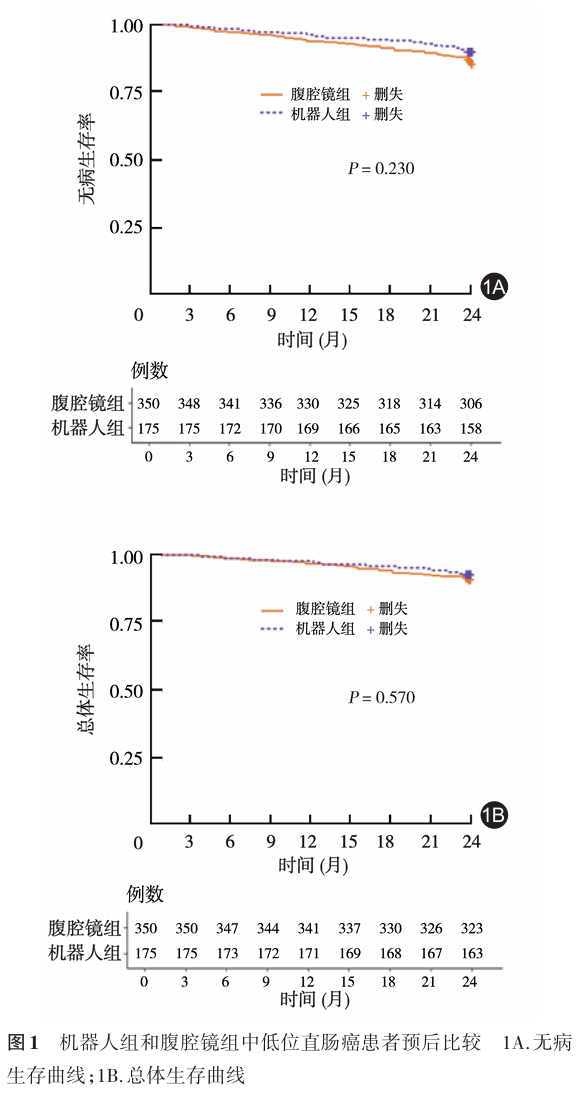
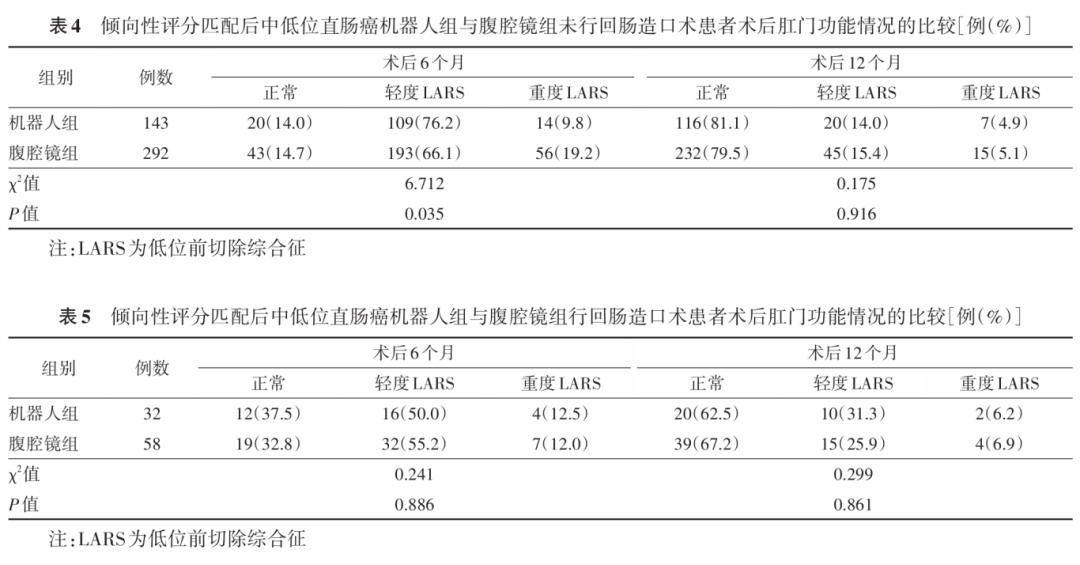
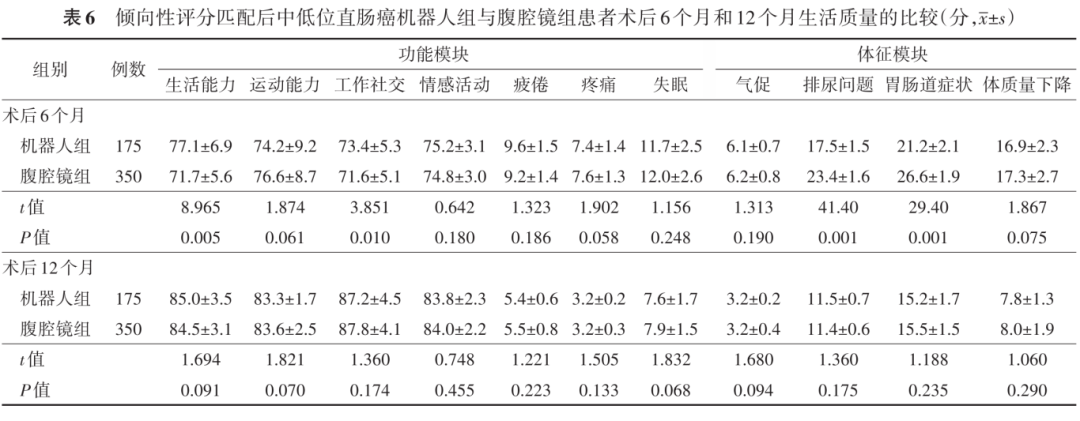
结果 (1)肿瘤学预后:机器人组术后2年DFS和OS分别89.7%和93.1%;腹腔镜组分别为86.0%和91.7%。两组比较,差异均无统计学意义(分别: P =0.230, P =0.570)。(2)肛门功能:未行回肠造口患者中,机器人组术后6个月的肛门功能优于腹腔镜组[重度LARS:9.8%(14/143)比19.2%(56/292),χ 2 =6.712; P =0.035];而在术后12个月时,两组患者差异无统计学意义。施行回肠造口的患者中,两组术后6个月和12个月肛门功能差异均无统计学意义(均 P >0.05)。(3)术后生活质量:与腹腔镜组比较,机器人组的生活能力[(77.1±6.9)分比(71.7±5.6)分, t =8.965, P =0.005]、工作社交能力[(73.4±5.3)分比(71.6±5.1)分, t =3.851, P =0.010]、排尿问题[(17.5±1.5)分比(23.4±1.6)分, t =41.40, P =0.001]以及胃肠道症状方面[(21.2±2.1)分比(26.6±1.9)分, t =29.40, P =0.001]更具优势,差异均有统计学意义(均 P <0.05)。在术后12个月时,两组功能和体征模块的生活质量差异均无统计学意义(均 P >0.05)。(4)围手术期并发症:两组术中并发症的差异均无统计学意义(均 P >0.05);腹腔镜组患者术后尿潴留的发生率高于机器人组[5.0%(19/350)比1.7%(3/175),χ 2 =4.009, P =0.044],差异有统计学意义。
结论 机器人直肠癌根治术可以达到与腹腔镜直肠癌根治术相似的短期肿瘤学结果,并在肛门功能和术后生活质量上具有优势,同时可降低围手术期泌尿系统并发症发生率。
自Heald教授提出全直肠系膜切除术(total mesorectal excision,TME)的概念以来,以其为手术金标准的直肠癌根治术已经发展了40余年 [1] 。随着加速康复外科(enhanced recovery after surgery,ERAS)理念的发展,围手术期相关并发症以及术后生活质量也成为外科医生更加关注的话题 [2] 。这也使得具有更小切口的腹腔镜手术和机器人手术在治疗中低位直肠癌中逐渐成为主流。同时,COLORⅡ研究认为,相比于传统开腹手术,腹腔镜手术具有较低的环周切缘阳性率和相当的肿瘤学结果,这也与CLASICC研究结果相一致 [3-4] 。而机器人手术改良的3D视野以及稳定的机械臂可以在狭窄骨盆完成精准切除,使其在低位进展期直肠癌的治疗中同样具有优势 [5] 。REAL研究认为,具有丰富经验的外科医生,可以通过机器人手术方式,改善低位直肠癌的手术质量 [6] 。可以说,机器人手术作为微创外科的发展,是对腹腔镜手术的补充。然而,机器人高昂的手术费用能否转化为令人满意的术后肿瘤学效果及肛门功能,仍存争议。机器人与腹腔镜手术在术后短期疗效上的优劣尚未达成共识。因此,本研究采用倾向性匹配分析的方式,旨在比较两种手术方式在治疗中低位直肠癌的短期效果及安全性和可行性,并为合理选择术式提供参考。
一、研究对象
本研究采用回顾性队列研究方法。
纳入标准:(1)肿瘤下缘距肛缘<10 cm;(2)以TME为手术原则,采用腹腔镜或机器人行直肠癌根治术。排除标准:(1)未能完全保留肛门;(2)癌性梗阻或穿孔;(3)术前进行低位前切除综合征(low anterior resection syndrome,LARS)评分,肛门功能差;(4)随访资料不完整。
根据以上标准,回顾性分析2019年7月至 2021年11月期间在南京大学附属苏北人民医院行直肠癌根治术的973例患者的临床资料,其中175例接受了机器人手术,798例接受了腹腔镜手术。
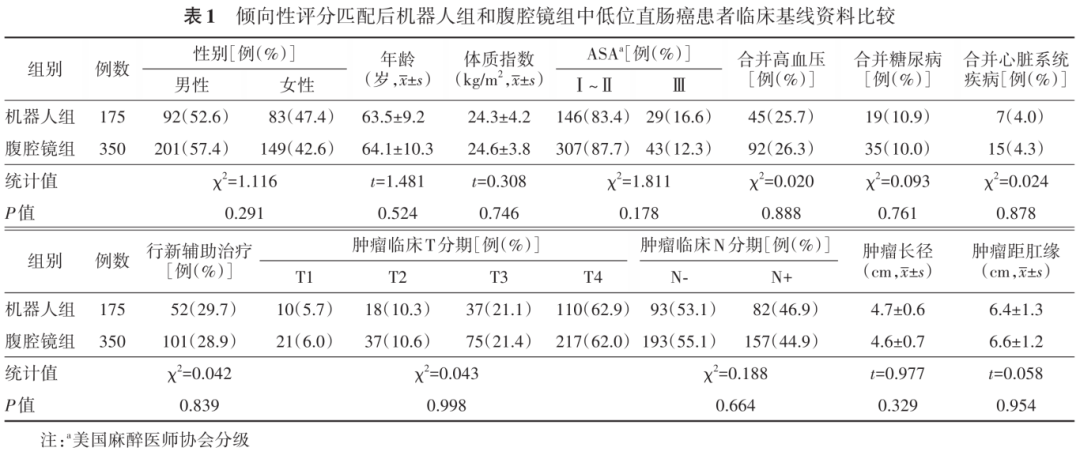
为减少基线不平衡时患者之间的偏差,采用1∶2最近邻匹配法进行匹配,通过多因素logistic回归估计倾向性匹配分值,混杂协变量包括性别、年龄、体质指数、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、高血压、糖尿病、缺血性心脏病、术前临床分期、新辅助治疗、肿瘤长径和肿瘤距肛缘的距离。卡钳值为0.01。匹配后,机器人组纳入175例,腹腔镜组纳入350例;两组基线资料的比较,差异无统计学意义,见表1。所有患者均充分了解不同手术方式优缺点并签署知情同意书。本研究经南京大学附属苏北人民医院伦理委员会审批通过(审批号:2019KY-022)。
二、观察指标和评价标准
观察指标:主要观察指标为肿瘤学预后和肛门功能。其中,肿瘤学预后的评估方式为1年和2年的无病生存率(disease-free survival,DFS)及总体生存率(overall survival,OS)。次要观察指标为患者术后生活质量与患者围手术期相关并发症发生率。
评价标准:(1)肛门功能评估:根据中华医学会结直肠外科学组与腹腔镜与内镜外科学组推荐指南,采用LARS评分系统进行肛门功能评估 [7] 。LARS评分系统通过问卷形式在排气失禁、稀便失禁、排便次数异常、排便聚集以及排便急迫5个方面对患者进行量化评分,可以较为全面地反映直肠术后肛门功能障碍的程度。根据每项评分相加求得总和,将患者归类。(2)术后生活质量评价:根据欧洲癌症研究治疗组织(European Organization for Research and Treatment of Cancer,EORTC)设计的适用于所有肿瘤患者的生命质量测定量表(quality of life questionaire-core 30,QLQ-C30)及适用于结直肠癌患者的生命质量测定量表(quality of life questionaire-colorectal 38,QLQ-CR38)来建立新的量表。为了能更客观、真实地评估患者的术后生活质量,新量表中综合了以上两个量表的优势,整合类似的项目,去除产生偏移的参数,主要从功能模块和体征模块进行评价 [8-10] 。本研究根据EORTC评分手册进行评分,每个模块的子项得分为每个条目的得分之和除以条目数,新量表见表2。为了使各条目的得分能进行数值运算,本研究采用线性变换,用极差化方法将其转换为 0~100 的分数,并最终得出功能模块和体征模块的总分。功能模块的评分越高表示患者功能越好,而体征模块评分越低则表示症状越轻 [11] 。
三、手术方法
两组患者均严格按照TME的原则进行以手术,流程和具体方案均按照《中国结直肠癌诊疗规范(2023版)》和《机器人结直肠癌手术中国专家共识(2020版)》 [12-13] 。由相同经验丰富的外科医生执行,并进行严格的质量控制。机器人手术采用达芬奇系统,腹腔镜手术采用STORZ 3D成像系统。除了操作平台不同,两组患者手术步骤大致相同,均保留左结肠动脉,高位结扎肠系膜下静脉,清扫第253组淋巴结,游离脾曲,使用吲哚菁绿荧光观察吻合口以及肠管血供,并且进行吻合口的缝合加固。根据笔者团队早期研究建立的吻合口漏预测模型,对高危患者进行回肠造口术 [14] 。
四、随访方法
随访流程与项目严格按照“指南”推荐进行 [12] 。病理依据为确诊复发的金标准。术后肛门功能及生活质量情况通过电话随访问卷的方式进行收集,未行回肠造口患者肛门功能评价时间为术后6个月和12个月,而行回肠造口患者肛门功能评价时间为回肠还纳术后6个月和12个月。生活质量评价为术后6个月和12个月。随访截止时间为2023年12月。
五、统计学方法
采用SPSS version 24和R4.0.2软件对所有参数进行分析和绘图。符合正态分布的计量资料采用 x±s 表示,用配对 t 检验进行比较。分类变量以例(%)表示,根据理论数采用Pearson χ 2 或Fisher检验。采用Kaplan-Meier生存曲线对患者进行肿瘤学结果分析。 P <0.05表示差异具有统计学意义。
一、两组术中及术后情况比较
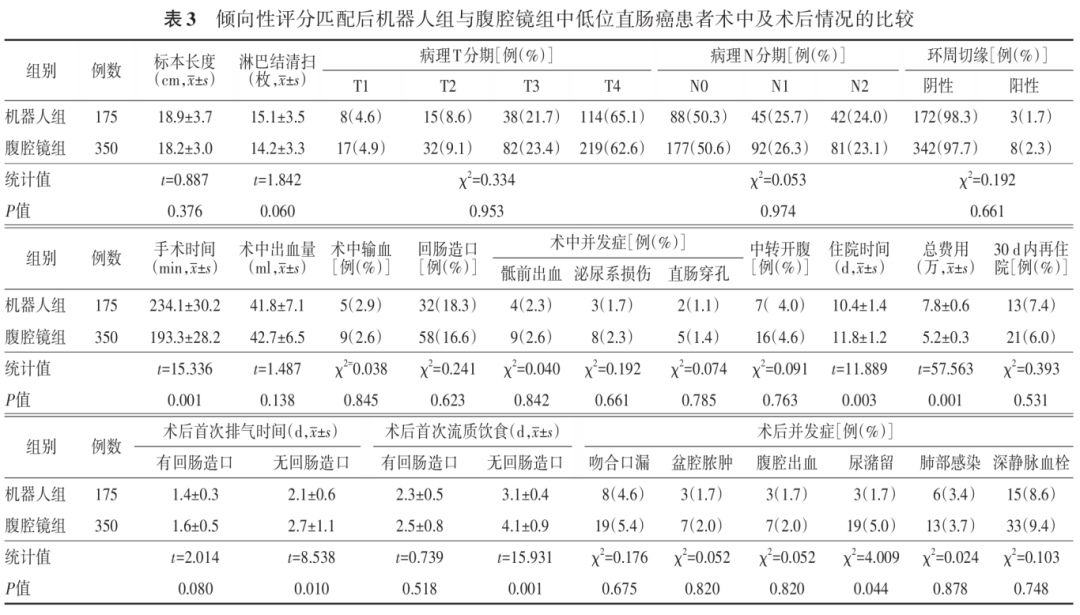
两组患者在术中出血量、回肠造口比例、术中相关并发症、中转开腹、标本长度、淋巴结清扫数目、环周切缘、术后病理特征方面以及术后30 d内再住院等比较,差异均无统计学意义(均 P >0.05)。与腹腔镜组比较,机器人组的手术时间明显较长,住院时间较短,住院总费用较高,差异均具有统计学意义(均 P <0.05)。见表3。
在未行回肠造口的患者中,机器人组患者术后首次排气时间和首次清流食时间均早于腹腔镜组,差异有统计学意义(均 P <0.05)。在术后并发症方面,腹腔镜组患者尿潴留的发生率高于机器人组,差异有统计学意义( P <0.05);其他术后并发症比较,差异未见统计学意义(均 P >0.05)。见表3。
二、两组预后和肛门功能的比较
机器人组术后1年和2年DFS分别为96.0%和89.7%,1年和2年OS分别为97.7%和93.1%;腹腔镜组DFS分别为93.4%和86.0%,OS分别为96.9%和91.7%。两组比较,差异均无统计学意义(均 P >0.05),见图1。未行回肠造口患者中,机器人组术后6个月的肛门功能优于腹腔镜组;而在12个月时,两组患者差异无统计学意义。见表4。施行回肠造口的患者中,两组术后6个月和12个月肛门功能差异均无统计学意义(均 P >0.05)。见表5。
三、两组患者术后生活质量评价情况
术后6个月时,两组患者均伴有程度不同的功能紊乱和不良体征;与腹腔镜组比较,机器人组的生活能力、工作社交、排尿问题以及胃肠道症状方面更具优势,差异均有统计学意义(均 P <0.05)。在术后12个月时,两组功能和体征模块的生活质量差异均无统计学意义(均 P >0.05)。见表6。
多项前瞻性临床研究表明,腹腔镜直肠癌手术可以达到与开放手术相似的肿瘤学结果,且术后恢复较快,符合ERAS理念 [15-17] 。机器人手术作为微创手术发展的产物,其更加仿生的机械臂和清晰的3D视野便于术者在狭窄骨盆进行切除。但是,相对于腹腔镜手术,机器人手术操作上的优势是否能转化为更好的肿瘤学疗效和术后生活质量,目前尚无定论。根据笔者中心前期临床数据资料分析认为,机器人手术在技术上具有可行性,在肿瘤学方面可以达到与腹腔镜相似的结果 [18] 。TME完整性关系到患者术后复发与总生存率,这与肿瘤学疗效息息相关 [19] 。Aselmann等 [20] 回顾性分析了85例TME患者,结果显示,机器人组“完整TME”标本的比例为97.7%,明显优于腹腔镜组。本研究结果显示,在2年随访时间内,尽管两组的OS和DFS差异并无统计学意义,但机器人组下降陡峭程度更低,曲线下降率更小,提示延长随访时间节点,增加样本统计量,机器人组的DFS和OS或许会展现出优势。REAL研究同样证实两种手术方式可以达到令人满意的短期肿瘤学疗效 [6,21] 。
环周切缘(circumferential resection margin,CRM)阳性率是与局部复发相关的重要因素。一项包含661例患者的荟萃分析表明,与腹腔镜手术相比,机器人手术组CRM阳性率较低 [22] 。尽管在本次研究中两组CRM阳性率差异并无统计学意义( P >0.05),然而我们在操作过程中发现,对于后壁肿瘤可能侵犯到浆膜层或接受新辅助放化疗的患者存在局部组织水肿,机器人手术放大的视野和灵活的机械臂更便于在腹下神经前筋膜与骶前筋膜之间进行游离,采取钝锐结合的方式,能够保证CRM的安全性。同时,在直肠后壁的游离过程中,分离至肛提肌层面位置较深,空间狭小,在切开直肠骶骨筋膜后进入肛提肌上间隙时,利用多角度旋转的机械臂沿直肠固有筋膜的背侧进行游离,便于保持直肠系膜的完整切除。
在肿瘤学根治目的前提下,功能学结果也应同样被重视。本研究在EORTC设计的QLQ-C30量表与QLQ-CR38量表基础上整合随访问卷来评估两组患者术后生活质量,用LARS评分问卷系统来评估患者术后肛门功能,结果显示,在术后6个月时,机器人组能更好地适应生活和工作,这或许得益于其在胃肠道功能和泌尿系统方面的良好恢复。对于肿瘤位置在肛门边缘5 cm以内的超低位直肠癌,有研究表明,机器人手术可以提高保肛率 [23] 。结直肠外科医生的最终目标是在根治性基础上最大程度地保留肛门。然而,只追求保留肛门的“形”,而忽略肛门的功能是不可取的。根据本研究LARS量表评估未造口患者术后6个月肛门功能发现,机器人组发生轻度LARS比例明显高于腹腔镜组,这初步可以说明机器人手术有利于术后肛门功能的保护。我们在机器人手术中可以更加清晰地辨识位于直肠固有筋膜和骶前筋膜之间的支配肛门外括约肌的腹下神经和骶部内脏神经,而这些神经包绕在直肠及其周围结缔组织,在直肠后间隙进行直肠后壁游离的过程中可以更好地保护相关神经。因此有研究认为,机器人手术的独特优势可以带来良好的术后排便功能以及胃肠道恢复 [24] 。而在泌尿功能方面,虽然ROLARR研究使用国际前列腺症状评分评估术后膀胱功能没有差异,但泌尿功能保护一直被视为机器人手术的优势之一 [25-26] 。我们的体会是,在直肠前间隙游离的过程中,于腹膜反折上方1 cm 切开腹膜,在邓氏筋膜前间隙操作,而后在精囊腺水平底部0.5 cm处离断邓氏筋膜,可有效地保护直肠前腔由神经血管束发出的神经,能更好地在狭窄盆腔分离时减少副损伤,这也许可以解释为什么机器人手术泌尿功能并发症发生率低的原因。而在本研究中,机器人组仅3例(1.7%)患者发生尿潴留,明显低于腹腔镜组,且机器人组术后排气更快,进流食时间更早,因此我们初步判定,机器人平台可以有效地保护盆底神经。日本的一项大样本多中心研究同样显示,机器人平台在保护盆腔自主神经方面具有技术优势 [27] 。
围手术期相关并发症发生率直接影响到患者生活质量。相关荟萃分析认为,机器人平台的固有优势可以降低术中出血风险及吻合口漏的发生率,然而手术时间较长,有可能会带来额外的麻醉风险 [28] 。根据我们的经验,机器人手术时间较长的原因在于术前机械臂安装过程而并不在于手术操作本身。相反,机器人系统缝合器械的可旋转性更便于低位直肠端端吻合后的加固缝合。而加固缝合联合机器人系统自带荧光导航观察血供情况,可以有效降低吻合口漏的发生风险 [29] 。同时,清晰术野可以在较深部位更加准确地辨识盆隔上筋膜,以此解剖部位为标志,在正确层面内游离,降低了骶前静脉丛与盆神经丛的副损伤 [30] 。因此,在本研究中,机器人组围术期相关并发症发生率较低,结合其神经保护功能,患者住院天数明显缩短,在术后加速康复中更具优势。
综上,本研究采用倾向性评分匹配的方式比较了中低位直肠癌机器人操作平台与腹腔镜平台术后患者的肿瘤学与功能学结果,初步证实机器人组在术后并发症、肛门功能及术后生活质量方面更具优势。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 李瑞奇负责数据随访,分析数据,文章撰写;周家杰、赵帅负责对文章的知识性内容作批评性审阅;王道荣负责对文章进行审查,修改文章,提出技术性指导,酝酿和设计实验,获取研究经费,行政、技术或材料支持
滑动阅读参考文献
链接:http://www.lewenyixue.com/2025/01/08/%E3%80%90%E8%AE%BA%E8%91%97%E3%80%91%E6%9C%BA%E5%99%A8%E4%BA%BA%E4%B8%8E%E8%85%B9%E8%85%94%E9%95%9C%E6%B2%BB%E7%96%97%E4%B8%AD%E4%BD%8E%E4%BD%8D%E7%9B%B4%E8%82%A0%E7%99%8C%E7%9F%AD/






赶快来坐沙发