南京大学医学院研究发现:肿瘤恶液质的形成与氨基酸代谢异常密切相关
随着生物医学的发展,癌症治疗手段不断改进,多种癌症的死亡率已经显著下降。但在临床上, 有一类常见的并发症严重影响着癌症患者的生存质量,并且会直接造成死亡,却还缺乏有效的防治药物,这类并发症就是恶病质。
恶病质,又称恶液质,表现为进行性的体重下降、食欲减退、肌肉萎缩和脂肪降解,不但会降低机体对化疗的耐受性,还极容易引发贫血、感染和多器官功能衰竭。传统的营养支持,只能部分缓解恶病质。为了癌症患者能够活得更久、更健康,需要明确恶病质的发生机制,从而建立有针对性的营养支持策略。
日前,南京大学医学院王宏伟教授、 黄志强 助理教授团队与苏北人民医院王永祥教授团队合作,在《细胞》子刊 Cell Metabolism 在线发表研究论文, 首次报道了恶病质引起骨骼肌萎缩的重要代谢网络,提出 蛋氨酸对于改善恶病质肌肉萎缩具有重要作用 。

蛋氨酸,也称为甲硫氨酸,在牛奶、奶酪等奶制品中含量丰富 。作为人体的必需氨基酸之一,蛋氨酸是蛋白质合成中的起始氨基酸,负责翻译的启动,一旦缺乏会影响蛋白质的生物合成。另一方面, 蛋氨酸还参与并影响细胞的表观遗传修饰状态 ,蛋氨酸代谢通路的激活可产生S-腺苷甲硫氨酸(SAM),该物质是DNA、RNA、蛋白质和其他生物底物甲基化的主要甲基供体,参与调控基因表达和蛋白质功能。

▲ 奶制品是蛋氨酸的优质来源(图片来源:123RF)
在这项研究中,论文作者首先从临床晚期肿瘤患者的骨骼肌表型分析入手,使用代谢组学、基因组学和表观遗传学的多组学研究方法,分析了在恶病质骨骼肌萎缩的过程中,蛋氨酸代谢异常的病理学表型特征。
临床样本以及后续的小鼠模型均显示出恶病质有 蛋氨酸代谢通路的严重障碍 ,表现为蛋氨酸向SAM的转化受阻,导致SAM的含量在肌肉组织中显著降低。由于甲基供体SAM的缺失,表观遗传调节因子DNMT3A表达下调,肌管细胞中DNA甲基化修饰水平下降。同时,内质网应激导致转录因子ATF4被激活,细胞中REDD1的表达水平上升。REDD1又称DNA损伤诱导转录因子4(Ddit4),是调控AKT通路活化的重要抑制因子,在恶病质骨骼肌中表达水平显著升高。转基因和基因敲除小鼠实验表明,敲除REDD1可显著改善肿瘤引起的体重损失和肌肉降解。
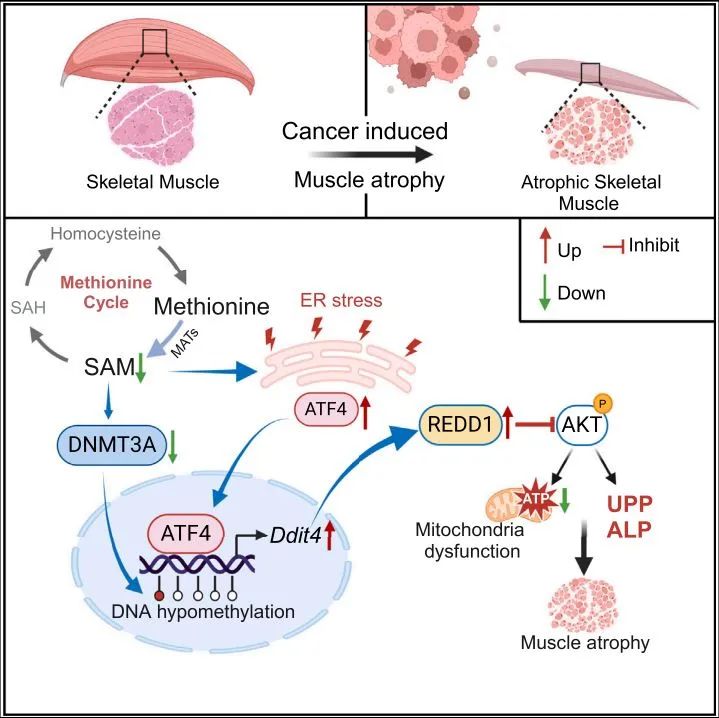
▲研究示意图: 蛋氨酸-DNMT3A-ATF4-REDD1轴对骨骼肌的表观遗传调控机制 (图片来源:参考资料[1])
随着蛋氨酸代谢失调促进肿瘤恶病质肌肉萎缩的病理学机制得以揭示,研究作者提出了 改善恶病质肌肉萎缩的潜在营养干预途径:恢复蛋氨酸循环和SAM补充 。动物实验表明,蛋氨酸补充剂能以DNMT3A依赖性方式恢复REDD1启动子的DNA甲基化,抑制REDD1的转录,改善肌肉的代谢状态。
值得一提的是,作者团队还从营养学角度探讨了不同甲基供体对恶病质骨骼肌萎缩的保护效果。尽管叶酸循环和蛋氨酸循环是机体中密切关联的一碳代谢网络,但研究表明, 补充叶酸和甜菜碱并不能改善由肿瘤引起的肌肉萎缩,而补充蛋氨酸和SAM能够缓解恶病质诱发的肌肉萎缩 。
作者指出,恶病质肌肉萎缩与蛋氨酸代谢异常之间的关联为在癌症患者保持肌肉功能提供了理论营养框架,为临床恶病质的综合防控提供了新的思路与实验依据。
参考资料:
[1] Lin et al., Disrupted methionine cycle triggers muscle atrophy in cancer cachexia through epigenetic regulation of REDD1, Cell Metabolism (2024), https://doi.org/10.1016/j.cmet.2024.10.017
链接:http://www.lewenyixue.com/2024/12/30/%E5%8D%97%E4%BA%AC%E5%A4%A7%E5%AD%A6%E5%8C%BB%E5%AD%A6%E9%99%A2%E7%A0%94%E7%A9%B6%E5%8F%91%E7%8E%B0%EF%BC%9A%E8%82%BF%E7%98%A4%E6%81%B6%E6%B6%B2%E8%B4%A8%E7%9A%84%E5%BD%A2%E6%88%90/