Nature子刊 | 头颈部肿瘤新辅助免疫治疗:T细胞动态与免疫应答系统综述 | 年度盘点
【CMT&CHTV 医学前沿·临床经典】
导语: 该综述总结了新辅助免疫疗法在头颈癌治疗中的T细胞动态变化,特别关注了免疫检查点抑制剂(ICIs)在头颈鳞状细胞癌(HNSCC)中的应用,分析ICIs在头颈癌治疗中的潜力和挑战。
头颈癌是全球第七大常见癌症,其中头颈鳞状细胞癌(HNSCC)是最常见的类型。HNSCC主要源于口腔、咽或喉的黏膜上皮,发病率呈全球上升趋势。HNSCC有两种主要病因:与HPV相关的(HPV阳性)和与HPV无关的,后者多由烟草和酒精等致癌物引起。手术是可切除口腔或晚期喉癌的标准治疗方式,术后病理分析决定是否需要辅助治疗,通常是放疗,可能伴或不伴化疗。
以往的新辅助化疗研究未能改善生存率,但对有良好病理反应的患者(病理完全缓解或主要病理反应)有更好预后。这些研究为免疫检查点抑制剂(ICI)与化疗的联合方案提供了发展基准。ICIs作为免疫疗法的主力,通过阻断PD-1信号通路,如帕博利珠单抗和纳武利尤单抗,已在多个治疗场景中实现长期生存。自2016年以来,这些药物已被FDA批准用于治疗复发和/或转移性HNSCC患者,并在2019年被批准作为一线治疗。然而,ICIs与化疗放疗同时使用并未改善未切除的局部晚期疾病患者的预后。
2024年12月10日, Nature Reviews Clinical Oncology 发表了题为“T cell dynamics with neoadjuvant immunotherapy in head and neck cancer”的综述,梳理新辅助ICIs在HNSCC治疗中的最新研究进展,深入探讨了新辅助免疫疗法在头颈癌治疗中的T细胞动态变化,分析免疫检查点抑制剂(ICIs)在头颈鳞状细胞癌(HNSCC)治疗中的应用及其对患者病理反应和免疫应答的影响。
01
▼
内容概述
新辅助ICIs在头颈癌治疗中的应用及其效果
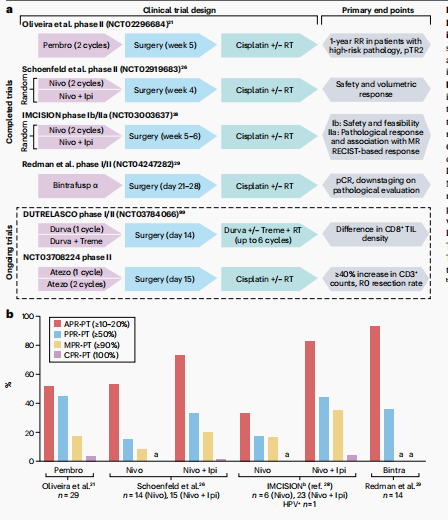
在过去五年中,多项临床试验已经研究了ICIs在头颈鳞状细胞癌(HNSCC)患者手术前新辅助治疗中的安全性和有效性。这些试验包括了HPV阳性和HPV阴性的HNSCC患者,测试了抗PD-1抗体作为单药治疗或与其他ICIs(如抗CTLA-4和抗LAG3抗体)、放疗、化疗或其他额外治疗方法的联合应用。
新辅助ICIs的安全性: 对于术前给予ICIs的初步担忧集中在可能导致的早期肿瘤进展或对围手术期护理产生不良影响。然而,风险评估显示新辅助ICIs在HNSCC患者中是安全的,3-4级不良事件的报告比例在0-8.4%之间。此外,多项研究表明新辅助ICIs对计划手术、术中并发症风险、术后结果或肿瘤进展的影响最小。对463名接受新辅助ICIs治疗的HNSCC手术患者的回顾性分析显示,与倾向匹配的对照组相比,围手术期结果(包括手术并发症的发生率)没有统计学上的显著差异。关于手术延迟的担忧,一项包含344名患者数据的荟萃分析显示,ICIs治疗并未导致手术延迟。这些数据令人鼓舞,并促进了新辅助ICIs作为安全方法的更广泛接受。尽管如此,接受新辅助ICIs治疗的患者仍应定期监测疾病进展和不良事件。
新辅助ICIs的有效性: 一项跨癌种分析提供了标准化的免疫相关病理反应(irPRCs)标准,用于评估抗PD-(L)1抗体的病理反应。这些irPRCs包括在HNSCC患者的Ⅱ期试验中观察到的淋巴细胞浸润和对角蛋白碎片的反应。在HNSCC患者中,接受新辅助ICIs单药治疗的pCRs或MPRs较为罕见,主要肿瘤MPRs报告在0-17%的患者中,pCRs在0-5.6%。部分病理反应(pPRs)更为常见,因此研究者采用了额外的病理肿瘤反应(pTR)量化标准,包括pTR0(0至<10%的原始肿瘤区域坏死)、pTR1(10至<50%)和pTR2(≥50%)。
关键考虑因素是这些pPRs是否与改善的生存结果相关。新兴数据表明,即使未达到MPR或pCR,pPRs仍与多种癌症类型的更好临床反应相关。例如,在CheckMate 816试验中,可切除的非小细胞肺癌(NSCLC)患者接受化疗或化疗加纳武利尤单抗治疗,后者方案改善了中位无事件生存期(EFS)。预先计划的探索性分析显示,病理反应的程度与临床结果之间存在连续而非分类变量的相关性。对于每增加1%的残留活性肿瘤,EFS的风险比(HR)增加了0.017。有趣的是,这一发现特定于原发肿瘤的病理反应,而与淋巴结状态无关。总之,尽管实现MPR或pCR是治疗的重要目标,但pPR可能与临床益处相关,并应继续在进行中的试验中研究。
新辅助ICIs单药治疗: 已有多个研究中心报告了新辅助抗PD-(L)1抗体作为单药治疗在可切除的HPV相关和非HPV相关的HNSCC患者中的初步经验。结论是,cPRs或MPRs不常观察到,仅在0-17%的患者中发生。其次,与CheckMate 816类似,pPR与相对于无反应者更好的生存结果相关。具体为,在92名接受新辅助帕博利珠单抗治疗的患者中,任何病理反应(定义为活性肿瘤细胞减少>20%)与93%的无病生存期(DFS)和100%的一年总生存期(OS)相关,而无反应者的DFS为72%。这一观察与PD-L1表达或常规病理风险特征无关。然而,需要进一步的研究来定义抗PD-(L)1抗体术前剂量的最佳时机和数量。
新辅助ICIs联合治疗方案: 由于新辅助ICIs作为单药治疗的疗效并不突出,研究者探索了这些药物与其他治疗方法(如抗CTLA4抗体)联合使用的效果。研究发现,与ICIs联合使用可能增强pPR率,并在原发性肿瘤和淋巴结之间发现不一致的反应。例如,接受纳武利尤单抗加他达拉非治疗的患者中有50%在原发性肿瘤和肿瘤引流淋巴结之间有不一致的病理反应,后者更有可能有病理反应。两项研究显示,在HPV阴性HNSCC患者中,手术前给予抗PD-1和抗CTLA4抗体的联合治疗有希望的病理反应。然而,这两项试验的样本量都较小,且没有一项试验有足够的能力直接比较所测试方案的效果。
新辅助ICIs与放疗联合: 两项临床试验扩展了先前临床研究的发现,表明低分割放疗与ICIs联合可以促进抗肿瘤免疫反应,并提高HPV阴性HNSCC患者的反应率。在一项Ⅰ-Ⅰb期试验中,21名HPV阴性的Ⅲ-Ⅳ期HNSCC患者接受了一剂Durvalumab和递增剂量的立体定向体部放疗(SBRT)治疗,随后在3-6周内进行手术,之后给予辅助Durvalumab和可选的辅助化疗放疗。在最大耐受剂量下,接受24Gy放疗的患者中有89%实现了MPR或pCR,这是迄今为止所有测试新辅助ICIs的试验中病例缓解率最高的。
值得注意的是,没有MPR或pCR的患者出现疾病复发,16个月的OS(80.1%)超过了历史结果。在另一项试验中,HPV阳性或HPV阴性的HNSCC患者接受了SBRT单独或与纳武利尤单抗联合治疗。在五名接受SBRT加纳武利尤单抗治疗的HPV阴性疾病患者中,有三名实现了MPR(60%),一名实现了pCR(20%),这一发现与之前讨论的试验相似。这些结果突出了ICIs加SBRT作为局部晚期HPV阴性HNSCC患者有前途的新辅助治疗策略,并正在Ⅱ期NIRT-2试验(NCT04938609)中进行测试。
新辅助ICIs与化疗联合: 几项Ⅰ期和Ⅱ期单臂试验测试了化疗免疫疗法的组合,与ICIs单药治疗或联合治疗相比,pCR或MPR率有所提高。这些试验包括了22至48名患者,主要测试了与铂类和/或紫杉醇类化疗联合使用的抗PD-(L)1抗体。这种方法在患者中产生了16.7%-63.0%的pCR和27.7%-74.1%的MPR。这些pCR率是与单独新辅助化疗相比的适度提高。所有这些研究都发现了化疗加入后不良事件的预期增加,但没有引起新的安全信号。
单细胞研究
高分辨率测序技术的出现为定义T细胞群体的分子表型和监测治疗后这些群体的动态变化提供了有力支持。结合单细胞T细胞受体(TCR)测序和单细胞RNA测序(scRNA-seq)方法,已经能够对多个T细胞亚群进行表征。此外,空间转录组分析也揭示了与肿瘤微环境(TME)相关的细节。这些方法已被用于分析接受新辅助ICIs治疗的HNSCC患者的样本。
图1 新辅助ICIs单细胞相关研究
T细胞亚群与ICIs反应相关性: 不同研究对T细胞状态的命名不同,但普遍认同的两个主要类别的CD8 + T细胞为非耗竭记忆CD8 + T细胞(TNExM)和耗竭CD8 + T细胞(TEx)。TNExM富含特定于病毒抗原的转录标记,类似于黑色素瘤和非小细胞肺癌(NSCLC)患者中的发现。TEx与TNExM的区别包括表达不同的颗粒酶(TEx中的GZMB和TNExM中的GZMK)、不重叠的TCR克隆型和伪时间分析上的不同轨迹。
图2 肿瘤内T细胞动力学对新辅助ICIs的反应
慢性抗原刺激推动了CD8 + TEx细胞的发展,这些细胞的细胞毒功能受损,表达与T细胞功能障碍相关的基因,如PDCD1、CTLA4和HAVCR2。TEx细胞的几个亚群已被描述,包括终末耗竭(TTE)细胞,这些细胞经历了TOX介导的转录和表观遗传重编程。尽管TTE细胞的细胞毒功能受损,但它们仍保持抗原依赖的增殖能力,在TME中保持流行。TTE细胞可以由祖细胞耗竭T(TPE)细胞补充,这些细胞表达转录因子TCF1,保留自我更新的能力,但缺乏其前体细胞的效应功能。组织驻留记忆T(TRM)细胞是TEx细胞的一个额外亚群,表达CD103和特异性转录因子HOBIT,但在遇到认知抗原时保留功能能力。
在一项对14个肿瘤活检样本中的超过17 000个CD8 + T细胞进行的单细胞分析中,研究者根据细胞毒性或极度耗竭的表达特征,进一步将TTE细胞细分为富含细胞毒性(TTE-CTX)或极度耗竭(TTE-EEx)亚群。响应ICIs的患者肿瘤浸润性淋巴细胞(TILs)中主要由TTE-CTX细胞组成,而非响应者的肿瘤在基线时富含TTE-EEx细胞。
图3 ICIs给药后的全身T细胞动力学
新辅助ICIs后TEx细胞室的动态变化: 治疗后T细胞动态的变化提供了ICIs反应和抗性的机制见解,以及潜在的生物标志物。两项研究描述了CD8 + TEx细胞室对ICIs的反应扩张,而TNExM细胞室的大小保持不变。在来自接受新辅助ICIs治疗的II期试验患者的匹配前后肿瘤样本中,检测到ITGAE+群中扩展的CD8 + TCR克隆型的富集,以及TRM样(ZNF683)、效应(GZMB)和抑制性(ENTPD1)基因的上调。值得注意的是,与接受单药治疗的患者相比,接受纳武利尤单抗加伊匹单抗治疗的患者的ITGAE+群中克隆型的扩张更大,这与包括抗CTLA4抗体的ICIs联合使用增强T细胞启动的报告一致。
CD4 +T细胞亚群: CD4 + T细胞,特别是CD4 + T辅助1(TH1)细胞,通过分泌促进CD8 + T细胞免疫的效应细胞因子发挥抗肿瘤作用,已在多种实体瘤患者中与改善的临床结果相关,并可能在ICIs的抗肿瘤活性中发挥作用。在HNSCC患者中,值得注意的CD4 + T细胞群体包括TTE、TH1、效应记忆(TEM)和调节性(Treg)细胞,所有这些细胞都可以在TME中找到。与CD8 + T细胞类似,肿瘤特异性耗竭和非耗竭CD4 + T细胞群体也存在于HNSCC患者的肿瘤材料中。
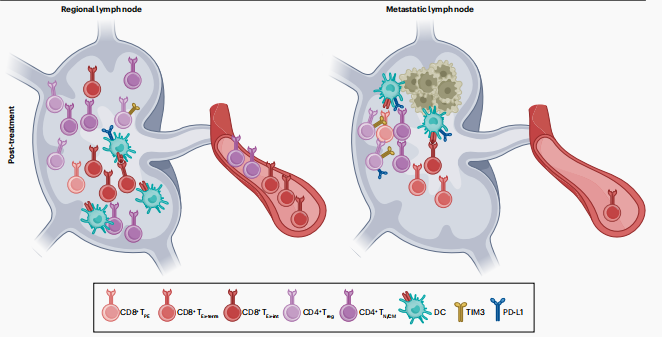
淋巴结的作用: 临床前研究的数据强调了淋巴结对ICIs反应的重要性,但淋巴结在HNSCC患者对ICIs反应中的具体作用尚不完全清楚。值得注意的是,接受新辅助ICIs治疗的HNSCC患者的PET-CT成像显示,对荧光脱氧葡萄糖(FDG)新的亲和力的淋巴结(在27名患者中的13名)在原发性肿瘤的病理反应与否的患者中出现频率相似。重要的是,13名患者中有2名和8名分别有无转移性疾病在他们的颈部解剖标本中被检测到,表明ICI后颈部FDG亲和力可能不反映新的转移性疾病的存在。
系统性T细胞动态: 将原发性肿瘤和配对淋巴结的免疫微环境的见解与外周血的免疫细胞含量联系起来,为了解新辅助ICIs对系统性免疫细胞群体的影响以及这些影响如何保护患者免于进展到远处转移性疾病提供了宝贵的机会。几项跨不同癌症类型的研究表明,肿瘤抗原特异性T细胞克隆型很少在外周血中被检测到,尽管如此,外周血样本已被证明包含能够补充肿瘤内T细胞的T细胞,并有潜力作为反应的生物标志物。
单细胞研究表明,新辅助ICIs治疗后,T细胞群体发生了显著变化,这些变化可能与患者的治疗反应和预后相关。
02
▼
总结讨论
新辅助ICIs在HNSCC治疗中显示出安全性和临床效果,尤其是与化疗或其他ICIs联合使用时。高分辨率相关研究的数据提供了证据,表明肿瘤和血液中特定的CD8 + T细胞亚群可能作为对ICIs反应的生物标志物。肿瘤内耗竭的ZNF683 + CD8 + TRM样细胞是新辅助抗肿瘤免疫反应的关键介早期阶段新辅助试验的数据为KEYNOTE-689这一随机Ⅲ期试验奠定了基础,该试验测试了围手术期帕博利珠单抗和标准治疗(SOC)的效果。
ZHAO M, SCHOENFELD J D, EGLOFF A M, et al. T cell dynamics with neoadjuvant immunotherapy in head and neck cancer. Nat Rev Clin Oncol. https://www.nature.com/articles/s41571-024-00969-w. [2024-12-10]. DOI:10.1038/s41571-024-00969-w.
编辑:赤芍
二审:薄荷
三审:清扬
排版:半夏
链接:http://www.lewenyixue.com/2024/12/20/Nature%E5%AD%90%E5%88%8A%20%7C%20%E5%A4%B4%E9%A2%88%E9%83%A8%E8%82%BF%E7%98%A4%E6%96%B0%E8%BE%85%E5%8A%A9%E5%85%8D/
如果本内容对您有帮助,欢迎给我打赏,支持创作