四川大学华西医院最新研究:SG饮食“饿杀“结直肠癌及免疫重启的双重作用
【CMT&CHTV 医学前沿·临床经典】
【导语】近期,四川大学华西医院一项发表在 Cell Metabolism 的研究揭示了限制丝/甘氨酸(SG)饮食在增强抗肿瘤免疫反应和促进肿瘤通过PD-L1乳酸化逃避免疫监视的双重作用。
结直肠癌(CRC)是全球第三大常见癌症,其致死率不断攀升。免疫检查点抑制剂(ICIs)已被批准用于CRC治疗,包括程序性死亡受体-1(PD-1)抑制剂,但大多错配修复完整/微卫星稳定(pMMR/MSS)的CRC患者难以从这些治疗中获益。在pMMR/MSS型CRC患者中,免疫细胞浸润不足是其对免疫治疗产生抵抗的主要原因,调节免疫状态和肿瘤微环境(TME)以增强免疫治疗的效果是关键。
肿瘤细胞的高度代谢活性依赖于外源性丝氨酸、甘氨酸等氨基酸来支持其起始、增殖、转移和抗药性。这一过程中,肿瘤细胞主要通过厌氧糖酵解产生大量乳酸,进而形成免疫抑制的微环境。乳酸的积累不仅促进肿瘤相关巨噬细胞向M2型极化,抑制CD8 + T细胞和自然杀伤(NK)细胞的细胞毒性,减少CD4 + 和CD8 + T细胞在肿瘤微环境中的浸润,还为肿瘤浸润的调节性T细胞(Tregs)提供代谢支持。
2024年12月, 四川大学华西医院马学磊/石虎兵教授团队在 Cell Metabolism 杂志发表了题为“Dual impacts of serine/glycine-free diet in enhancing antitumor immunity and promoting evasion via PD-L1 lactylation”一文,探究了外源性限制丝/甘氨酸(SG)饮食对pMMR/MSS型CRC生长的影响,以及其如何通过调节抗肿瘤免疫反应,以及促进肿瘤细胞通过PD-L1乳酸化逃避免疫监视的双重作用。该研究不仅深入分析了SG饮食对肿瘤微环境和免疫细胞的影响,还评估了其与免疫治疗联合应用的潜力,为结直肠癌的临床治疗提供了新的视角和可能的治疗策略。
01
▼
研究设计
本研究是一项单臂、Ⅰ期临床试验(ChiCTR2300067929),研究纳入了20名晚期实体瘤患者,主要评估SG饮食的安全性和血清氨基酸代谢水平,次要结果包括患者耐受性和潜在的抗肿瘤效果。研究中,患者被给予SG饮食,同时监测其对肿瘤大小变化和血液中免疫细胞水平的影响。
02
▼
研究结果
研究结果显示,SG饮食能够显著抑制CRC的生长,并促进细胞毒性T细胞的积累,从而增强抗肿瘤免疫。
SG饮食抑制CRC生长并促进肿瘤细胞死亡
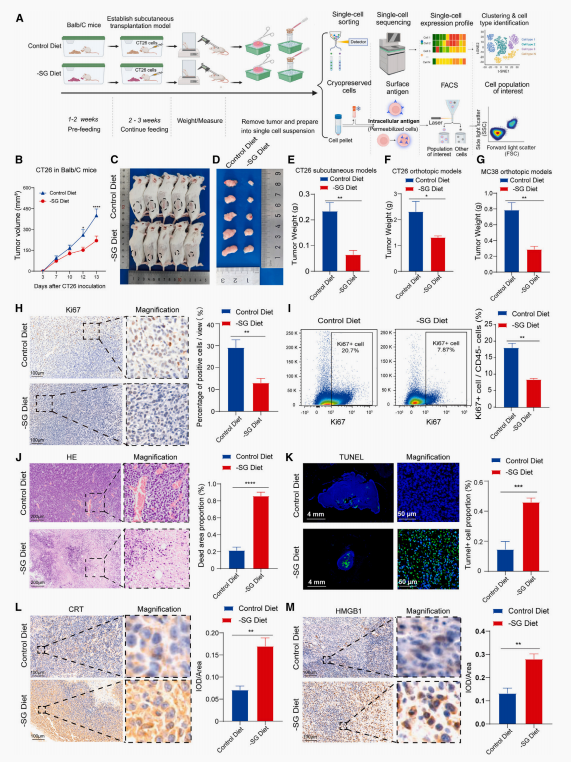
研究发现,限制丝/甘氨酸(SG)饮食显著抑制了CRC细胞CT26和MC38的增殖。通过EdU(5-乙炔基-2'-脱氧尿苷)掺入实验,观察到SG饮食阻碍了肿瘤细胞从G1期到S期的过渡。此外,SG饮食还显著增加了早期和晚期凋亡细胞的比例,并减少了CT26细胞的迁移能力。在多种小鼠模型中,SG饮食显著抑制了肿瘤生长(图1B-1G)。值得注意的是,SG饮食并未显著改变小鼠的体重,但显著降低了血清中血清和甘氨酸的水平,并通过免疫组化(IHC)和流式细胞术减少了肿瘤的增殖能力(图1H和1I)。这些结果表明,SG饮食可能通过诱导免疫原性细胞死亡而非改变环境或体重来抑制肿瘤生长。
图1 限制丝/甘氨酸饮食抑制结直肠癌癌症生长并诱导免疫原性细胞死亡
SG饮食调节肿瘤内免疫微环境
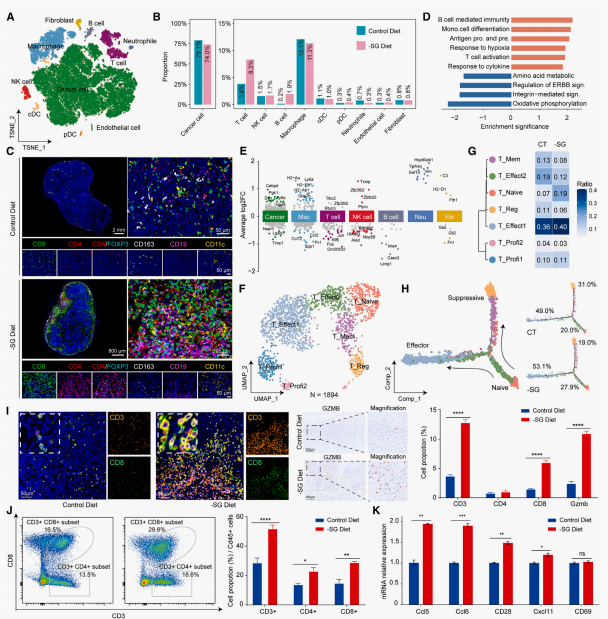
通过单细胞RNA测序(scRNA-seq)分析发现,与对照组相比,SG饮食显著扩大了肿瘤中的淋巴细胞群,特别是T和B细胞,并减少了巨噬细胞群(图2A)。多色IHC进一步证实了SG饮食下,肿瘤中T细胞和B细胞的大量浸润(图2C)。基因集富集分析(GSEA)显示,与对照组相比,SG饮食显著上调了淋巴细胞分化和激活、B细胞介导的免疫和T细胞激活途径(图2D)。以上结果表明,SG饮食可能通过调节肿瘤内的免疫微环境来增强抗肿瘤免疫。
图2 限制丝/甘氨酸饮食调节肿瘤内免疫环境
SG饮食重编程T淋巴细胞并减少免疫抑制细胞
研究进一步分析了T细胞和巨噬细胞亚群,发现SG饮食显著增加了肿瘤内T细胞的比例,主要是由于 naive T细胞和效应T细胞的显著增加,同时抑制性Tregs显著减少(图2G)。T细胞的分化轨迹表明,SG饮食增强了T细胞向效应型转化的趋势(图2H)。此外,SG饮食还增强了肿瘤组织中T细胞的细胞毒性和激活表型(图2K)。表明SG饮食促进了肿瘤浸润性淋巴细胞向有效和细胞毒性表型的转变。
CD8 +T细胞在SG饮食抑制CRC肿瘤生长中的关键作用
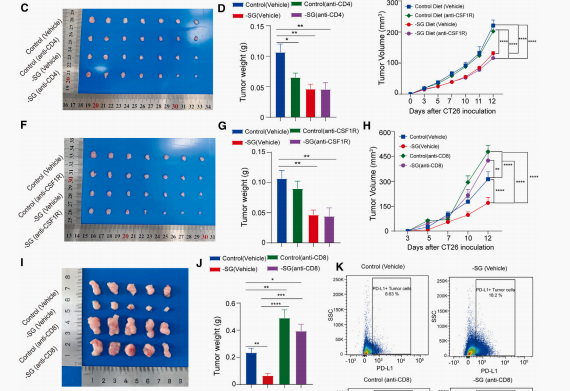
为了确定SG饮食过程中的关键细胞,研究假设增加的CD4 + /CD8 + T细胞和巨噬细胞的数量和表型转变对SG饮食的抗肿瘤效果的关键。通过分别用CD4、CD8或CSF1R抗体处理小鼠,发现只有CD8 + T细胞的消耗显著增加了肿瘤体积和重量,且无论是否是SG饮食(图3H-3J)。结果表明,SG饮食的抗肿瘤效果取决于CD8 + T细胞的存在。
图3 限制丝/甘氨酸饮食抑制CRC肿瘤生长需要CD8 T细胞
SG饮食增强CRC对PD-1抑制剂的敏感性
研究发现SG饮食显著增加了pMMR/MSS CRC中的CD3 + 和CD8 + T细胞浸润以及IFN-γ和PD-L1水平。结合SG饮食和PD-1抑制剂治疗显著增强了对肿瘤生长的抑制作用,具有显著的缩瘤效果(图4B-4D)。此外,SG饮食与PD-1抑制剂的联合治疗显著增加了CD3 + 和CD8 + T细胞(图4E)。表明SG饮食可能增强了对PD-1抑制剂反应不佳的pMMR/MSS CRC肿瘤对治疗的敏感性。
图4 限制丝/甘氨酸饮食增强CRC小鼠模型对PD-1抑制剂治疗敏感
SG饮食的临床应用潜力
在临床试验中,20名患者接受了SG饮食,其中5名(25%)实现了部分缓解(PR),13名(65%)病情稳定(SD),2名(10%)病情进展(PD)。总体响应率(ORR)为25%,临床获益率(CBR)为90%。血清中血清和甘氨酸水平的显著降低以及外周血液中CD4 + 和CD8 + T细胞中GZMB和IFN-γ表达水平的显著增加,进一步证实了SG饮食在调节免疫反应方面的潜力。
03
▼
总结讨论
研究的结论指出,SG饮食不仅能够通过限制肿瘤细胞对血清和甘氨酸的吸收来抑制肿瘤生长,还能够通过改变TME来增强T细胞的浸润和细胞毒性。尽管SG饮食在增强淋巴细胞活性方面显示出效果,但肿瘤细胞也可能通过乳酸化PD-L1来稳定PD-L1表达,减少CD8 + T细胞的效能。抑制PD-1/PD-L1通路可能恢复CD8 + T细胞的功能,并增强抗肿瘤反应。此外,本研究还发现,SG饮食能够增加肿瘤细胞表面PD-L1的表达。同时,作者也指出了研究需要在更大的人群中验证SG饮食的有效性,以增强研究结果的稳健性和适用性。
TONG H, JIANG Z, SONG L, et al. Dual impacts of serine/glycine-free diet in enhancing antitumor immunity and promoting evasion via PD-L1 lactylation[J]. Cell Metab. 2024; 36(12): 2493-2510.e9. DOI:10.1016/j.cmet.2024.10.019.
链接:http://www.lewenyixue.com/2024/12/16/%E5%9B%9B%E5%B7%9D%E5%A4%A7%E5%AD%A6%E5%8D%8E%E8%A5%BF%E5%8C%BB%E9%99%A2%E6%9C%80%E6%96%B0%E7%A0%94%E7%A9%B6%EF%BC%9ASG%E9%A5%AE%E9%A3%9F%E2%80%9C%E9%A5%BF%E6%9D%80/
如果本内容对您有帮助,欢迎给我打赏,支持创作






 未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》