双重作用!重庆医科大学胡国华/潘敏团队:发现抗肿瘤有效新策略
【导读】 免疫检查点阻断疗法(ICB)在代谢紊乱的肿瘤微环境中的临床疗效显著降低,这是当前抗肿瘤策略中不可忽视的一大挑战。
12月11日,重庆医科大学胡国华/潘敏研究团队在期刊《Advanced Science》上发表了题为“Tumor Microenvironment-Responsive Nanoparticles Enhance IDO1 Blockade Immunotherapy by Remodeling Metabolic Immunosuppression”的研究论文,该研究中,研究人员开发了一种响应肿瘤微环境(TME)的纳米颗粒(HMP1G NPs),以增强1-MT介导的免疫检查点阻断(ICB)的治疗效果。机制上,HMP1G NPs通过芳香烃受体/信号转导和激活转录因子3/白细胞介素信号通路下调肿瘤细胞产生的IDO1,以改善犬尿氨酸/色氨酸代谢和免疫抑制。在小鼠乳腺癌模型中,HMP1G NPs治疗引发有效的抗肿瘤免疫反应,并改善生存结果。 这项研究介绍了一种新型纳米平台,它同时改善代谢并增强ICB的疗效,以实现一种新的、高效的抗肿瘤策略。

https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202405845
背景信息
01
免疫检查点阻断(ICB)疗法越来越多地应用于多种实体肿瘤,在某些恶性肿瘤中显著改善了临床疗效。然而,ICB疗法对所谓的“冷”肿瘤(如乳腺癌(BRCA)和头颈部鳞状细胞癌(HNSCC))缺乏疗效,因为肿瘤细胞的内在变化,包括酶活性和代谢紊乱,可以阻止免疫细胞在肿瘤微环境中渗透或发挥功能,导致对ICB疗法的原发性耐药。因此,旨在破坏这些代谢途径并重新编程免疫抑制性TME的策略对于扩大癌症免疫疗法的应用至关重要。
TRP的消耗和KYN的积累直接影响效应T细胞(Teffs)的功能,强烈促进外周免疫耐受。IDO1介导的TRP代谢是KYN途径中最广泛研究的代谢途径之一。IDO1是一种免疫检查点蛋白,是催化TRP降解和KYN积累所必需的酶。在多种实体肿瘤中观察到了IDO1表达上调,使其成为有吸引力的免疫治疗靶点。KYN诱导的免疫抑制被归因于KYN及其衍生物与芳香烃受体(AhR)的相互作用,激活了AhR信号通路。AhR信号通路激活对免疫调节具有多方面的影响,包括上调肿瘤细胞中IDO1的表达,上调CD4+ T细胞中FOXP3的表达,抑制CD8+ T细胞的增殖,降低这些细胞释放的干扰素和颗粒酶的水平,最终增加免疫抑制性浸润的比例。靶向IDO的特异性竞争性蛋白抑制剂,如1-甲基色氨酸(1-MT),可以有效地抑制IDO1活性并缓解免疫抑制。然而,由于实体肿瘤的免疫原性较低,单一IDO阻断疗法的疗效有限。
HMP1G纳米颗粒在4T1-肿瘤小鼠模型中表现出卓越的抗肿瘤效果
02
研究人员仔细评估了HMP1G纳米颗粒在低免疫原性4T1肿瘤小鼠模型中的抗肿瘤效果。研究人员将重点放在对自由1-MT、HMPG和HMP1G纳米粒子在体内水平的比较分析上。通过监测肿瘤大小,研究人员发现HMP1G纳米粒子组对4T1肿瘤生长的抑制作用显著大于1-MT和HMPG组。此外,1-MT和HMPG组小鼠的中位生存时间是25天,与对照组相比没有显著改善,而HMP1G NPs组有两只小鼠在第40天时仍然存活。另外,在任何治疗后均未观察到显著的体重变化,这表明在测试剂量下HMP1G NPs具有极佳的生物相容性。研究人员还进行了H&E染色和TdT介导的dUTP末端标记(TUNEL)染色分析,以评估肿瘤细胞的凋亡和坏死。与未治疗组相比,HMP1G NPs组表现出最严重的细胞凋亡和坏死,而2和3组则表现出中等程度的细胞凋亡和坏死。总的来说,这些结果表明HMP1G NPs具有极佳的抗肿瘤效果,且不会引起显著的副作用。
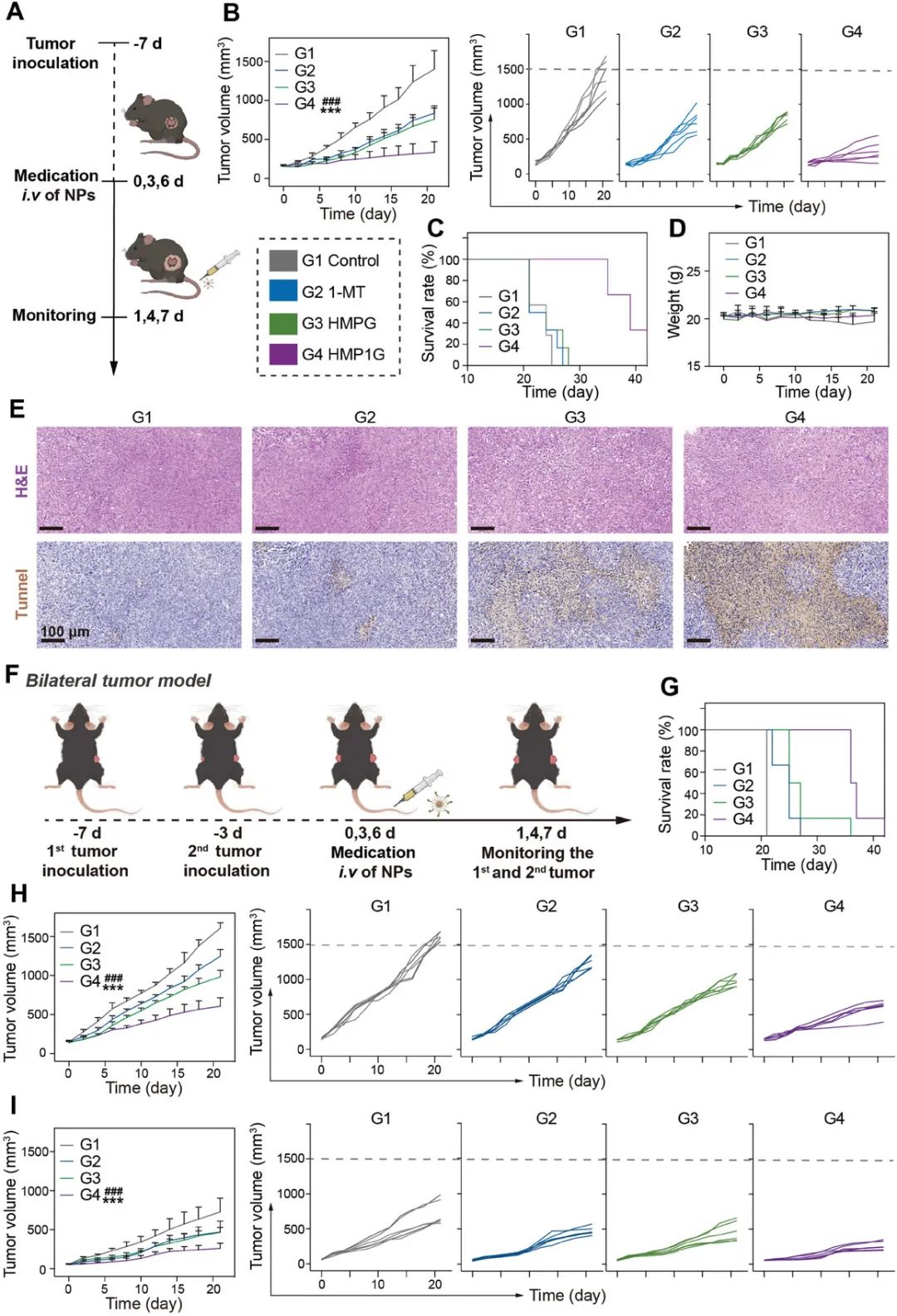
NPs在体内的抗肿瘤治疗效果
受HMP1G纳米颗粒在抗肿瘤治疗中卓越表现的启发,研究人员评估了HMP1G纳米颗粒的旁观者效应,以抑制远处肿瘤的生长。研究人员建立了一个模拟远处肿瘤的人工转移瘤模型。研究人员发现HMP1G纳米颗粒治疗不仅有效地抑制了原发肿瘤的生长,而且对远处肿瘤的生长表现出最显著的抑制作用。相反,1-MT和HMPG纳米颗粒治疗对原发肿瘤和远处肿瘤的抑制作用有限,这表明当1-MT单独用于体内时,ICB响应率较低。值得注意的是,HMP1G纳米颗粒组对4T1肿瘤生长的抑制效果最为显著,平均生存时间为38天,显著长于其他各组。这些结果表明,HMP1G纳米颗粒可以实现高效的ICB抗肿瘤效果,产生更有效的远端效应,抑制肿瘤转移。
HMP1G纳米颗粒改善4T1-肿瘤小鼠免疫抑制
03
研究人员使用流式细胞术进一步评估了双侧肿瘤模型小鼠的免疫状态。研究人员意外发现HMP1G纳米颗粒治疗导致DC的有效成熟,脾脏中DC的丰度为36.37%,显著高于1 MT组的28.9%、HMPG纳米颗粒治疗组的29%和未治疗小鼠的13.49%。同时,接受HMP1G纳米颗粒治疗的小鼠在脾脏和肿瘤内都显示出对Treg细胞(CD3+CD4+Foxp3+)最有效的抑制作用,而1-MT和HMPG纳米颗粒治疗仅能轻微抑制肿瘤内的Treg细胞。
研究人员根据分析,得出结论,在用HMP1G纳米颗粒治疗的小鼠肿瘤中,效应T细胞(CD3+CD4+)和细胞毒性T细胞(CD3+CD8+)的数量显著增加。随着肿瘤中Treg细胞数量的减少,这一策略导致T效应细胞与Treg细胞的比例以及CTL与Treg细胞的比例显著增加,这是激活抗肿瘤适应性免疫的重要标志。总的来说,在4T1-肿瘤小鼠模型中应用HMP1G纳米颗粒触发了强烈的抗肿瘤免疫响应。这些结果证实,HMP1G纳米颗粒疗法可以逆转免疫抑制性肿瘤微环境(TME),产生免疫刺激效应,这可能归因于HMP1G纳米颗粒通过CDT介导的高效抗肿瘤作用和良好的ICB敏感性。
研究意义
04
本研究表明,HMP1G纳米颗粒在增强靶向免疫原性差的肿瘤(如BRCA)的ICB治疗策略方面具有重大潜力。本研究构建的纳米平台策略也有望增强癌症免疫治疗和许多涉及抗肿瘤免疫的其他癌症治疗。
【参考资料】
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202405845
链接:http://www.lewenyixue.com/2024/12/13/%E5%8F%8C%E9%87%8D%E4%BD%9C%E7%94%A8%EF%BC%81%E9%87%8D%E5%BA%86%E5%8C%BB%E7%A7%91%E5%A4%A7%E5%AD%A6%E8%83%A1%E5%9B%BD%E5%8D%8E-%E6%BD%98%E6%95%8F%E5%9B%A2%E9%98%9F%EF%BC%9A/