Cancer Discovery|儿童急性T淋巴细胞白血病的临床特征与高危突变
急性T淋巴细胞白血病( T-ALL )是儿童最常见的血液系统肿瘤之一。其中 γ δ T-ALL 是一个较少研究的亚型,其肿瘤细胞表面表达由 γ 链和δ链组成的T细胞受体( TCR ),约占全部T-ALL病例的10%。既往研究提示,该亚型可能面临更差的治疗效果和更高的复发风险。
由于缺乏大规模针对 γ δ T-ALL的研究,其临床特征和发病机制仍不清楚。虽然近年来通过基因组学研究取得了一些进展,但这些研究纳入的 γ δ T-ALL病例较少,且缺乏对非编码区等基因组特征的分析,因此亟需进行更全面、深入的研究。
近日,以圣裘德儿童研究医院 Charles G. Mullighan 和 Hiroto Inaba 团队牵头的多国联合团队在 Cancer Discovery 发表了题为 Biologic and Clinical Analysis of Childhood Gamma Delta T-ALL Identifies LMO2/STAG2 Rearrangements as Extremely High Risk 的文章。 该研究基于200例γδ T-ALL的临床和基因组数据,揭示了发病年龄<3岁、诱导治疗后MRD≥1%和STAG2/LMO2突变是儿童 γ δ T-ALL的高危因素,进而筛选了针对此类患者有效的治疗策略。

本研究纳入了由 13项 临床研究组成的多国合作组的 200例25岁 以下的 γδ T-ALL 患者,以及1,067例根据治疗方案匹配的非 γ δ T-ALL对照病例。研究发现, γ δ T-ALL患者总体上表现出较差的预后,诊断年龄更小,且治疗后的应答更差,表现为在诱导治疗和巩固治疗后都有更高的微小残留病变(measurable residual disease, MRD )水平,需要进行造血干细胞移植的比例更高,且原发病或治疗副作用造成的死亡率更高。
诊断年龄小于3岁的 γ δ T-ALL患者,其5年无事件生存率(event-free survival,EFS)仅为33%,总生存率(overall survival,OS)仅为49%,显著低于诊断年龄≥3岁的 γ δ T-ALL患者或非γδ T-ALL患者。此外,诱导治疗结束时(end of induction, EOI ),MRD≥1%的患者在所有年龄段的生存率均显著低于MRD<1%的患者。这些数据表明诊断年龄 <3岁 和 EOI 时 MRD≥1% 是提示 γδ T-ALL 患儿不良预后的高危因素,因此这些高风险患者可能需要优化的治疗方案。
此外,研究发现, γ δ T-ALL患者的复发主要局限于骨髓(骨髓复发率高达91.3%),而非 γ δ T-ALL患者中枢神经系统复发更常见。
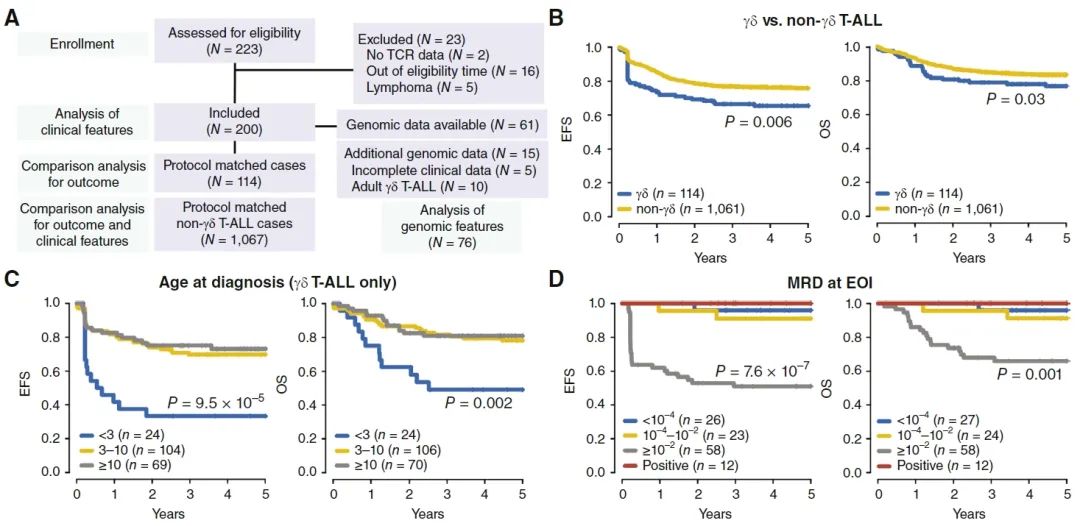
研究设计和患者临床结局:(A)研究方案,(B) γ δ T-ALL患者与非 γ δ T-ALL患者的生存率对比,(C/D) γ δ T-ALL患者中诊断年龄和EOI时MRD水平对生存率的影响
结合全基因组测序(whole genome sequencing,WGS)、RNA测序和HiChIP等技术,研究者对 γ δ T-ALL患者的基因变异进行了分型,并解析了突变导致的疾病机制。 γ δ T-ALL患者与非 γ δ T-ALL患者相比具有独特的基因型分布。 STAG2/LMO2 双突变是 γδ T-ALL 患者特征性变异之一,所有纳入研究的该亚型 γ δ T-ALL患儿的诊断年龄都小于3岁,且与其他类型患者相比生存期显著较短。
进一步研究表明STAG2/LMO2双突变患者中最常见的变异类型是 LMO2::STAG2 重排,导致 STAG2 失活和 LMO2 过度激活。STAG2是黏着复合物(cohesin complex)的重要组分,参与染色质空间折叠以形成拓扑相关结构域(topologically associating domain,TAD),进而通过增强子-启动子相互作用调控基因正常表达。通过构建STAG2缺失和过表达的细胞模型,并进行RNA-seq和H3K27ac ChIP-seq分析,研究者证明了STAG2失活将导致TAD结构异常,严重破坏T细胞分化相关基因表达,导致白血病的发生。
此外,研究还发现了其他 γ δ T-ALL特异性基因分型,如LMO2- γ δ样、超二倍体T-ALL伴重现性染色体增加、TLX3重排和PICALM::MLLT10融合等,这些亚型 γ δ T-ALL患者具有各自不同的临床特征。
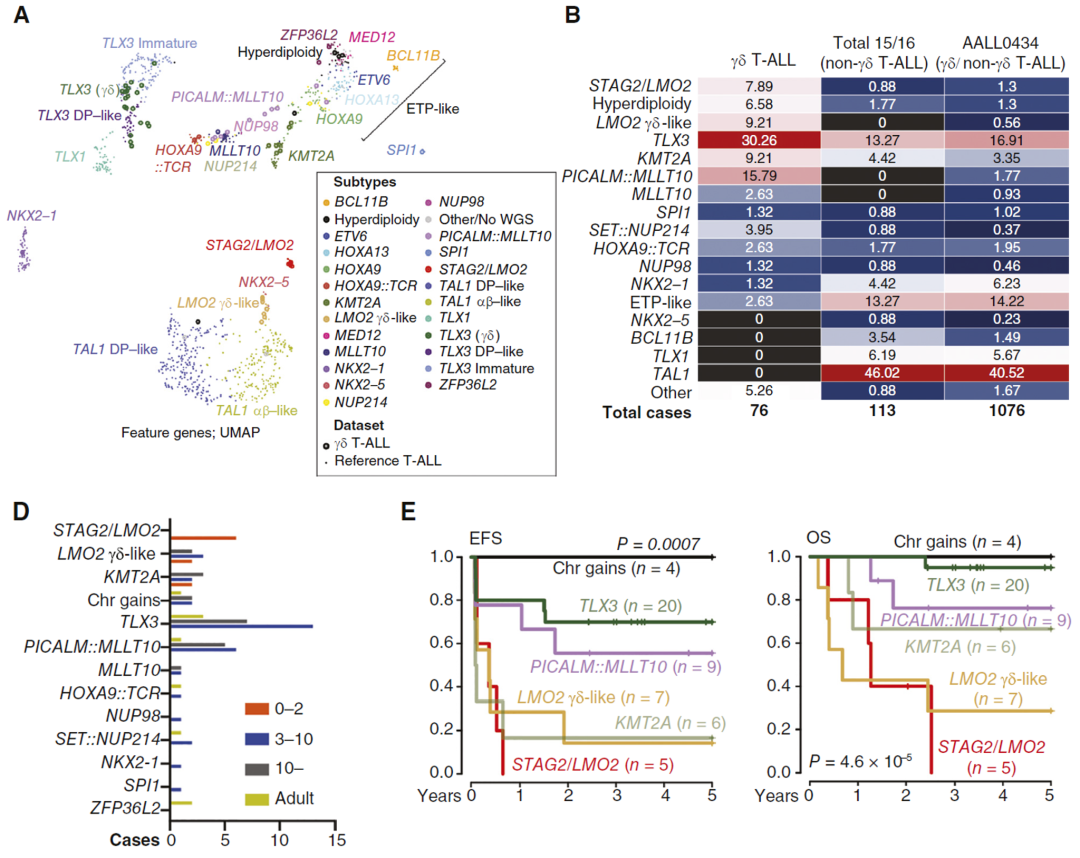
γ δ T-ALL基因分型和临床特征:(A)参考所有T-ALL基因组数据对 γ δ T-ALL进行基因分型,(B)不同基因型在 γ δ T-ALL与非 γ δ T-ALL患者中的分布,(D) γ δ T-ALL患者不同基因型与诊断年龄的关系,(E)不同基因型 γ δ T-ALL患者的生存曲线
最后,研究者通过高通量药物筛选探索了潜在的治疗策略。PARP抑制剂talazoparib和组蛋白去乙酰化酶抑制剂vorinostat是对STAG2/LMO2 γ δT-ALL细胞具有显著杀伤作用的药物,其中PARP抑制剂靶向STAG2失活造成的DNA复制缺陷,使双链DNA断裂积累并诱导细胞死亡。在患者来源的异种移植模型( PDX )中, talazoparib 和 vorinostat 都可以有效地抵抗肿瘤生长。
其他有效的药物包括nelarabine和L-门冬酰胺酶等,这些药物都已经被用于T-ALL或其他肿瘤的临床研究或治疗。此发现为高风险的 γ δ T-ALL患儿提供了一种潜在的精准治疗策略。
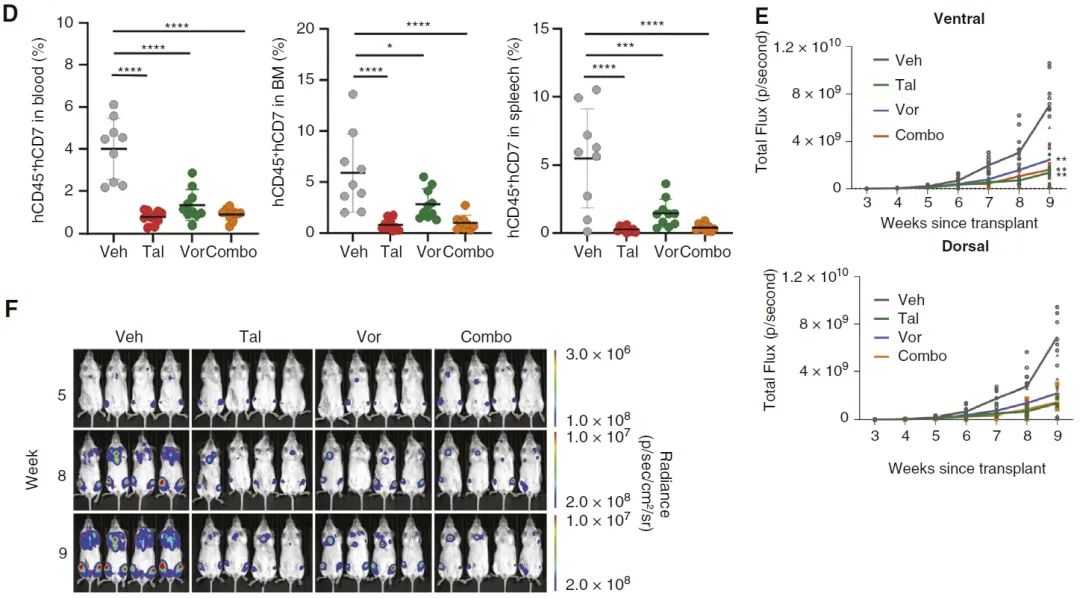
针对talazoparib(Tal)和vorinostat(Vor)的临床前试验表明两种药物均能够显著抑制PDX肿瘤细胞的生长
总之, 本研究首次全面探讨了儿童 γ δ T-ALL的临床特征和基因分型,并揭示了高危突变的致病机制及潜在的治疗策略。研究明确了诊断年龄和MRD水平对患者预后的关键作用,并揭示了高危患儿STAG2失活对染色质结构和基因表达具有深远影响。
更重要的是,本研究提出了 PARP 抑制剂等可做为靶向 STAG2/LMO2 亚型的潜在治疗策略,这些成果加深了对儿童 γ δ T-ALL的认识,也为未来 γ δ T-ALL患儿的风险分层和个体化治疗开发提供了重要参考。
撰文

责编

制作
排版 | Sheila 校对 | uu
▼滑动查看更多▼
Acute lymphoblastic leukemia expressing the gamma delta T-cell receptor (γδ T-ALL) is a poorly understood disease. We studied 200 children with γδ T-ALL from 13 clinical study groups to understand the clinical and genetic features of this disease. We found age and genetic drivers were significantly associated with outcome. γδ T-ALL diagnosed in children under 3 years of age was extremely high-risk and enriched for genetic alterations that result in both LMO2 activation and STAG2 inactivation. Mechanistically, using patient samples and isogenic cell lines, we show that inactivation of STAG2 profoundly perturbs chromatin organization by altering enhancer-promoter looping, resulting in deregulation of gene expression associated with T-cell differentiation. High-throughput drug screening identified a vulnerability in DNA repair pathways arising from STAG2 inactivation, which can be targeted by poly(ADP-ribose) polymerase inhibition. These data provide a diagnostic framework for classification and risk stratification of pediatric γδ T-ALL. Significance: Patients with acute lymphoblastic leukemia expressing the gamma delta T-cell receptor under 3 years old or measurable residual disease ≥1% at end of induction showed dismal outcomes and should be classified as having high-risk disease. The STAG2/LMO2 subtype was enriched in this very young age group. STAG2 inactivation may perturb chromatin conformation and cell differentiation and confer vulnerability to poly(ADP-ribose) polymerase inhibition.
DOI: 10.1158/2159-8290.CD-23-1452
 点击此处,直达原文
点击此处,直达原文
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/12/07/Cancer%20Discovery%EF%BD%9C%E5%84%BF%E7%AB%A5%E6%80%A5/
THE END
 点击此处,直达原文
点击此处,直达原文 










赶快来坐沙发