分泌IL-15的GPC3 CART治疗实体瘤
白细胞介素-15(IL-15)能够促进T淋巴细胞的存活,增强嵌合抗原受体(CAR)T细胞对抗实体瘤的特性,已临床前模型中验证。
Glypican-3(GPC3)在一组实体瘤中表达,这项研究报告两个队列,第一队列12例患者(NCT02905188和NCT02932956)接受了GPC3 CAR T细胞,这些细胞安全但未产生客观的抗肿瘤反应。第二队列12例患者(NCT05103631和NCT04377932)接受了 共表达IL-15的GPC3 CAR T细胞(15.CAR),这显著增加了体内CART细胞扩增,并诱导了66%的疾病控制率DCR和33%的抗肿瘤反应率ORR 。总的来说,IL-15增加了GPC3 CAR T细胞在患者中的扩增、肿瘤内存活和抗肿瘤活性。
主要结果
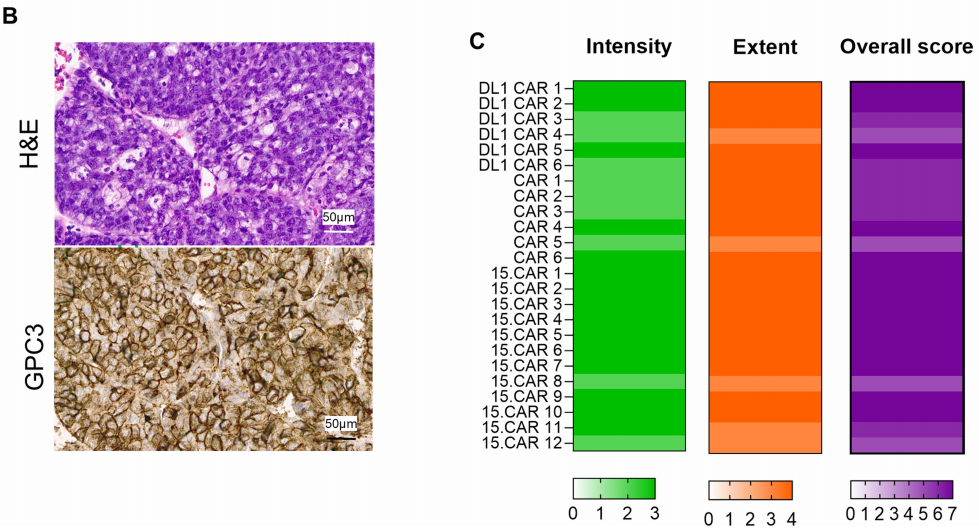
1、GPC3表达评估:免疫组织化学法检测GPC3表达
GPC3在儿童肝母细胞瘤和胎盘组织阵列样本中的表达作为阳性对照
GPC3在正常组织中不表达,特别是在非恶性组织中,这使得它成为一个理想的免疫治疗靶点,可以减少对正常组织的不良影响。研究者在儿童中也确认了GPC3的不表达,进一步支持了其作为治疗靶点的安全性。
B:患者15的入组样本示例
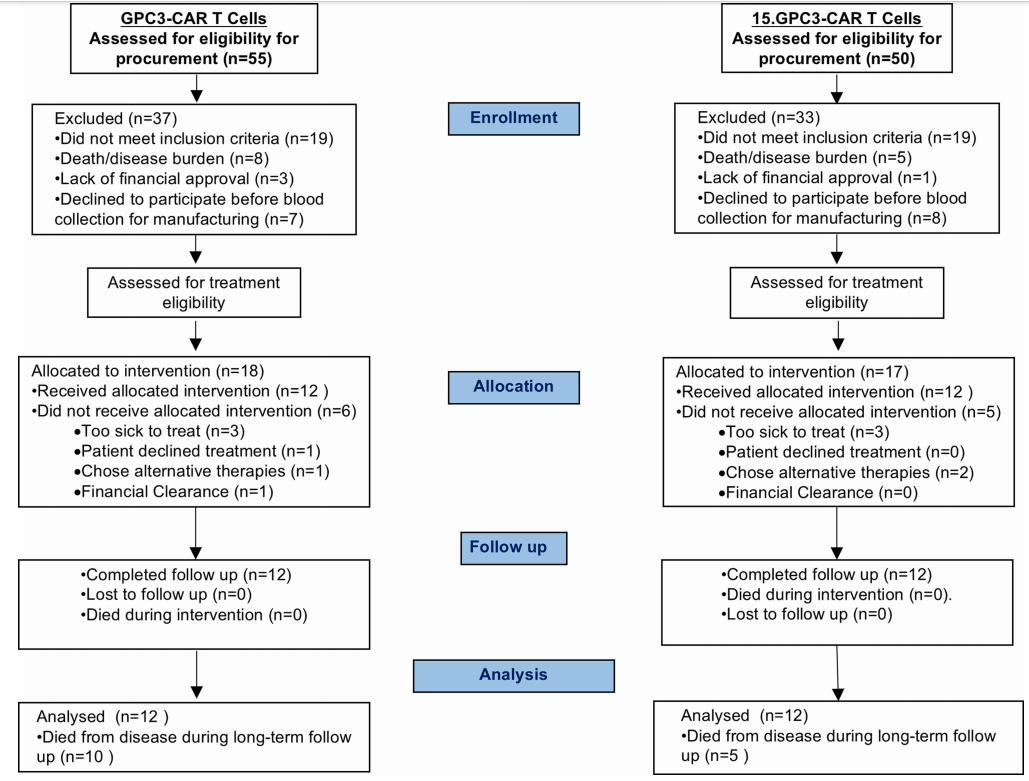
2、患者筛选、入组
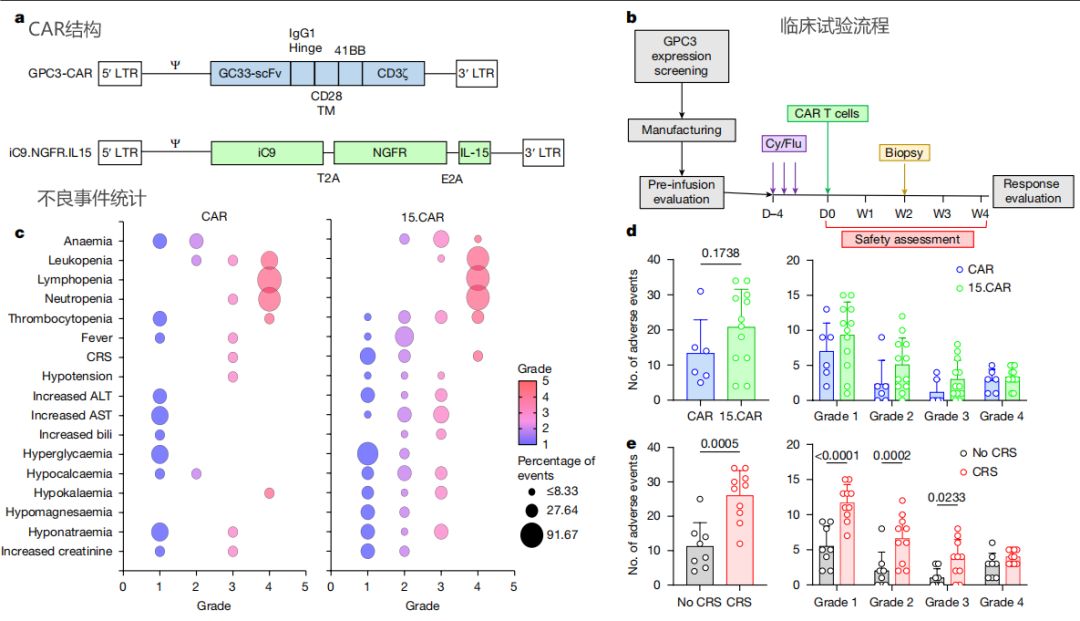
3、CART的特征与回输
2、15.GPC3 CART细胞在患者中诱导显著的抗肿瘤反应
-
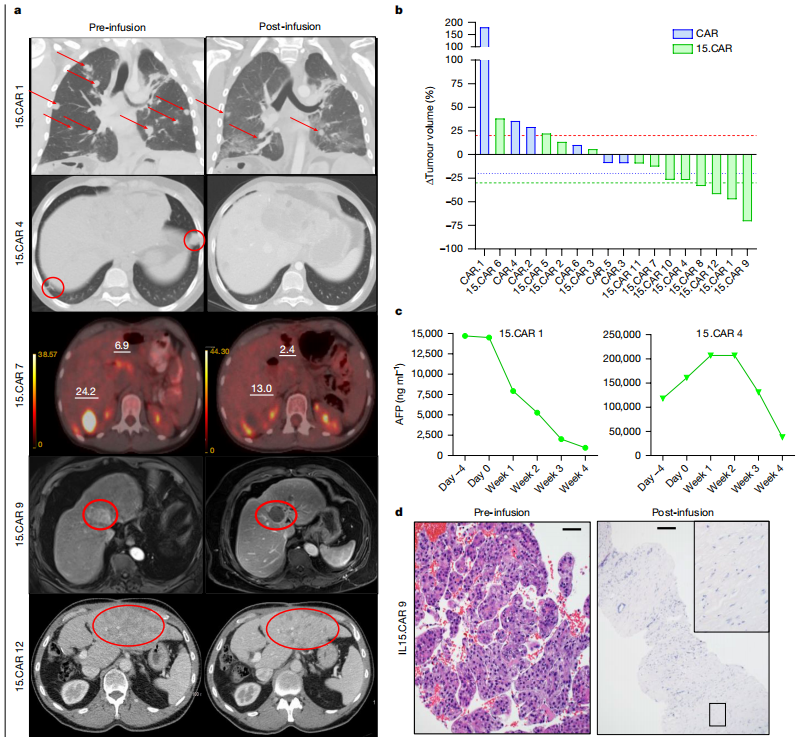
不同患者(15.CAR 1、15.CAR 4、15.CAR 7、15.CAR 9和15.CAR 12)在接受CAR T细胞输注前后的影像学图像。这些图像包括胸部CT(计算机断层扫描)、腹部MRI(磁共振成像)和PET-CT(正电子发射断层扫描)。红色箭头和圆圈表示肿瘤,数字代表肝脏肿瘤的标准摄取值(SUV)。这些图像直观地显示了治疗前后肿瘤的变化。
-
瀑布图(Waterfall plot)显示肿瘤体积的变化。红色虚线代表20%的增加,蓝色虚线代表20%的减少,绿色虚线代表30%的减少。这个图表直观地显示了治疗后肿瘤体积的客观变化,包括部分缓解(PR)和疾病稳定(SD)。
-
两个对AFP(甲胎蛋白)分泌肿瘤有反应的患者,在指定时间点的血清AFP浓度。AFP是一种肿瘤标志物,其水平的显著降低通常表明肿瘤负荷的减少。
-
患者15.CAR 9的肿瘤活检样本,使用HE染色在输注前后的对比。左侧是输注前的样本,右侧是输注后的样本。图像显示了患者肝肿瘤的近完全坏死。
以上影像学变化、肿瘤体积的客观变化、肿瘤标志物的降低以及肿瘤组织的病理学变化,表明15.CAR T细胞治疗在实体瘤患者中具有抗肿瘤活性。
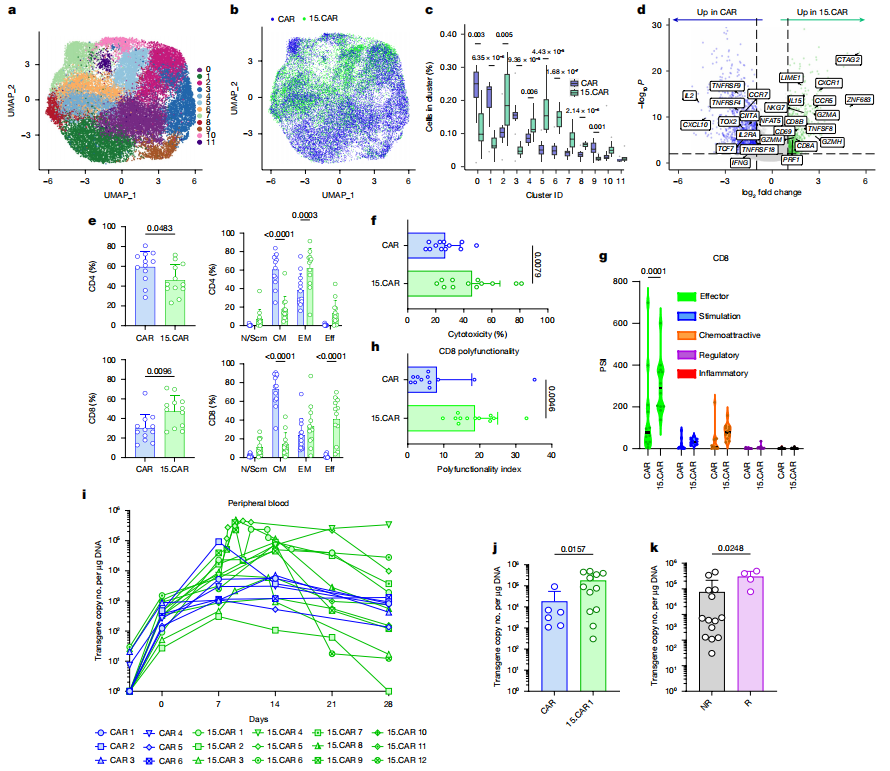
3、CAR或15CAR T细胞输注前产品和输注后体内扩增的比较
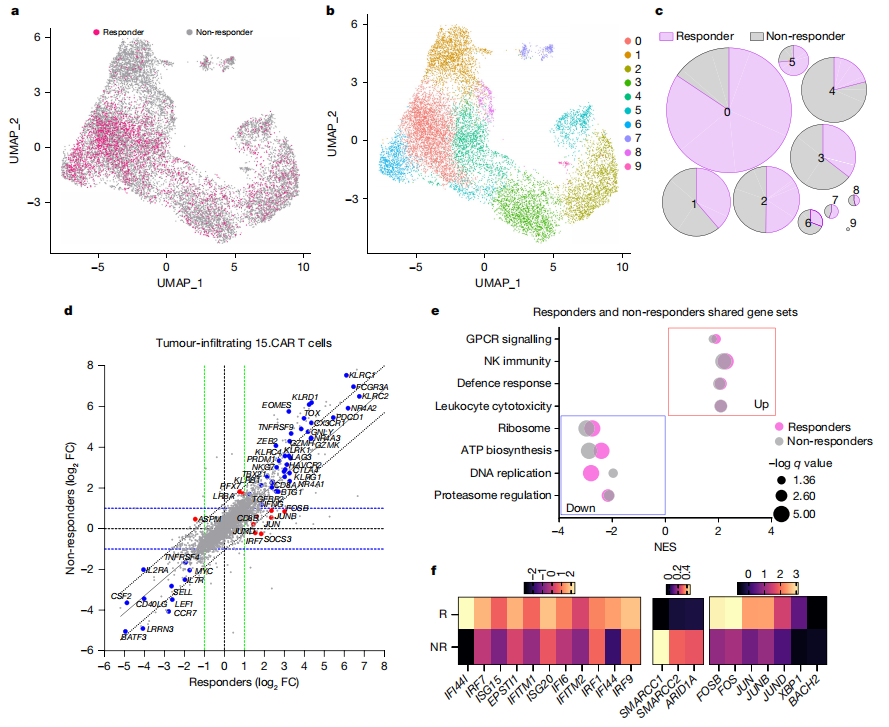
4、有效与无效患者输注后肿瘤浸润15CART细胞单细胞基因表达谱的比较
5、CART治疗患者的抗肿瘤反应特征
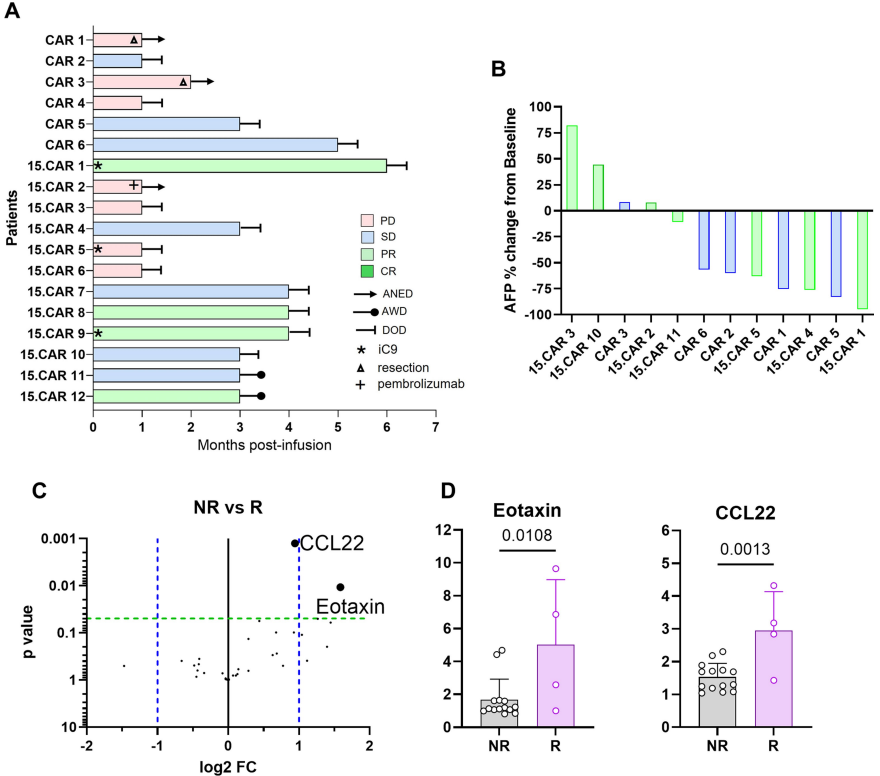
a: 长期随访结果,包括那些达到无病生存(ANED)的患者以及需要使用iC9安全开关控制CART活性的患者。图中还标注了存活有病(AWD)和因病死亡(DOD)的患者。
b: 瀑布图 显示了从基线到治疗后AFP浓度的变化。 展示了在接受CAR T细胞治疗的患者中,具有AFP分泌功能的肿瘤患者血清中AFP浓度的变化。
c:比较了根据RECIST标准,非响应者(NR)和响应者(R)之间的差异表达细胞因子。
d:比较了在响应者(R, n=4)和非响应者(NR, n=14)患者中,至少有两倍统计学意义增加的个别细胞因子。这个图表进一步细化了在R和NR患者中,特定细胞因子的表达差异。
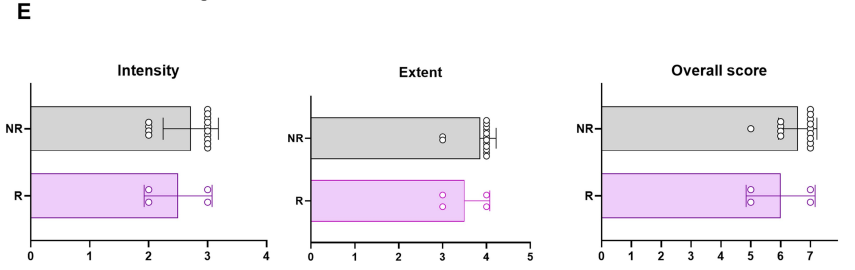
e:比较了响应者(R, n=4)和非响应者(NR, n=14)患者的肿瘤GPC3表达。
没有检测到响应者和非响应者之间GPC3表达水平的显著差异,GPC3的表达水平似乎并不是影响患者对15.CAR T细胞治疗反应的显著预测因素
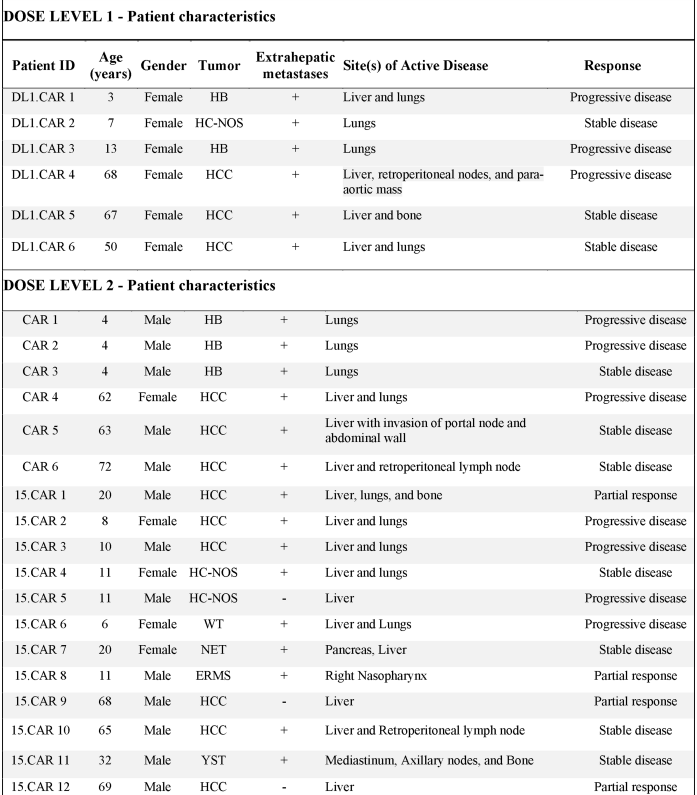
7、24例患者基线
不同类型的GPC3阳性肿瘤,包括肝细胞癌(HCC)、肝细胞肿瘤未特指(HC-NOS)、卵黄囊瘤(YST)、Wilms瘤(WT)、胰腺神经内分泌肿瘤(NET)和胚胎性横纹肌肉瘤(ERMS)。
小结
单次注射15CAR - T细胞是安全的,且提高了实体瘤患者抗肿瘤反应率和体内扩增。此外,肿瘤内15.CAR T细胞中FOS/JUN和T1IFN途径相关基因的表达增加,以及SWI/SNF活性的下调,与治疗反应相关。
参考文献:
Steffin D, Ghatwai N, Montalbano A, et al. Interleukin-15-armoured GPC3 CAR T cells for patients with solid cancers. Nature. Published online November 27, 2024. doi:10.1038/s41586-024-08261-8.
链接:http://www.lewenyixue.com/2024/12/03/%E5%88%86%E6%B3%8CIL-15%E7%9A%84GPC3%20CART%E6%B2%BB%E7%96%97%E5%AE%9E/







赶快来坐沙发