【Blood】综述:CAR-T和双特异性抗体在滤泡性淋巴瘤中的作用及未来方向
滤泡性淋巴瘤(FL)是第二大常见非霍奇金淋巴瘤(NHL)类型,是一种惰性疾病,通过免疫化疗(CIT)无法治愈。在一线 CIT 治疗 24 个月内疾病进展(PD)的患者(POD24)预后较差,此外在首次复发后,后续治疗的无进展生存期(PFS)也大幅缩短。之前的重点一直放在加强免疫疗法以克服 FL 有缺陷的肿瘤免疫微环境上,免疫调节方案(如利妥昔单抗-来那度胺)在复发/难治性(R/R)FL 中取得了令人鼓舞的结果,同时在一线的疗效与 CIT 相似,为进一步开发基于免疫疗法的方案铺平了道路。
近期美国FDA批准多种方案治疗3线及之后的(3L+) FL,包括tazemetostat、CAR-T细胞(axicabtagene ciloleucel [axi-cel]、tisagenlecleucel [tisa-cel] 和 lisocabtagene maraleucel [liso-cel])、双特异性抗体(BsAbs)(莫妥珠单抗[mosunetuzumab]和 epcoritamab)以及泽布替尼联合奥妥珠单抗。其中T 细胞重定向策略(TRS,包括CAR-T 和 BsAbs)备受关注,彻底改变了R/R FL的治疗格局。
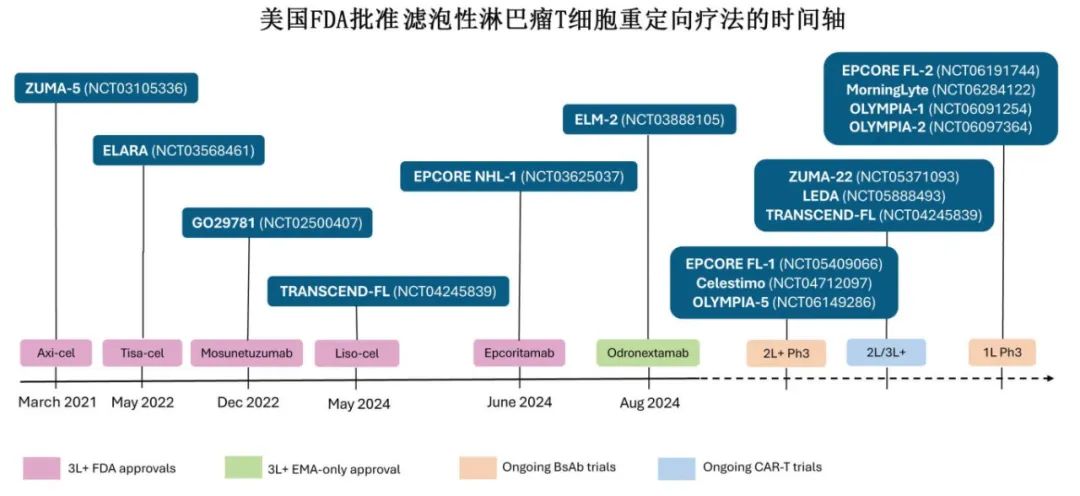
《Blood》近日发表综述,介绍了CAR-T 和 BsAbs在FL治疗中的作用,包括治疗顺序和未来方向,现整理供参考。

CAR-T
CAR-T 细胞是经过基因工程改造的自体 T 细胞,以一种不依赖主要组织相容性复合物的方式辅助肿瘤细胞的识别和清除。主要的短期不良事件(AE)包括细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS);晚期不良事件包括低丙种球蛋白血症、血细胞减少症、感染和继发性恶性肿瘤。基于3L+ 患者的单臂试验,已有三种 CAR-T 产品获得美国FDA对R/R FL的批准(表 1)。
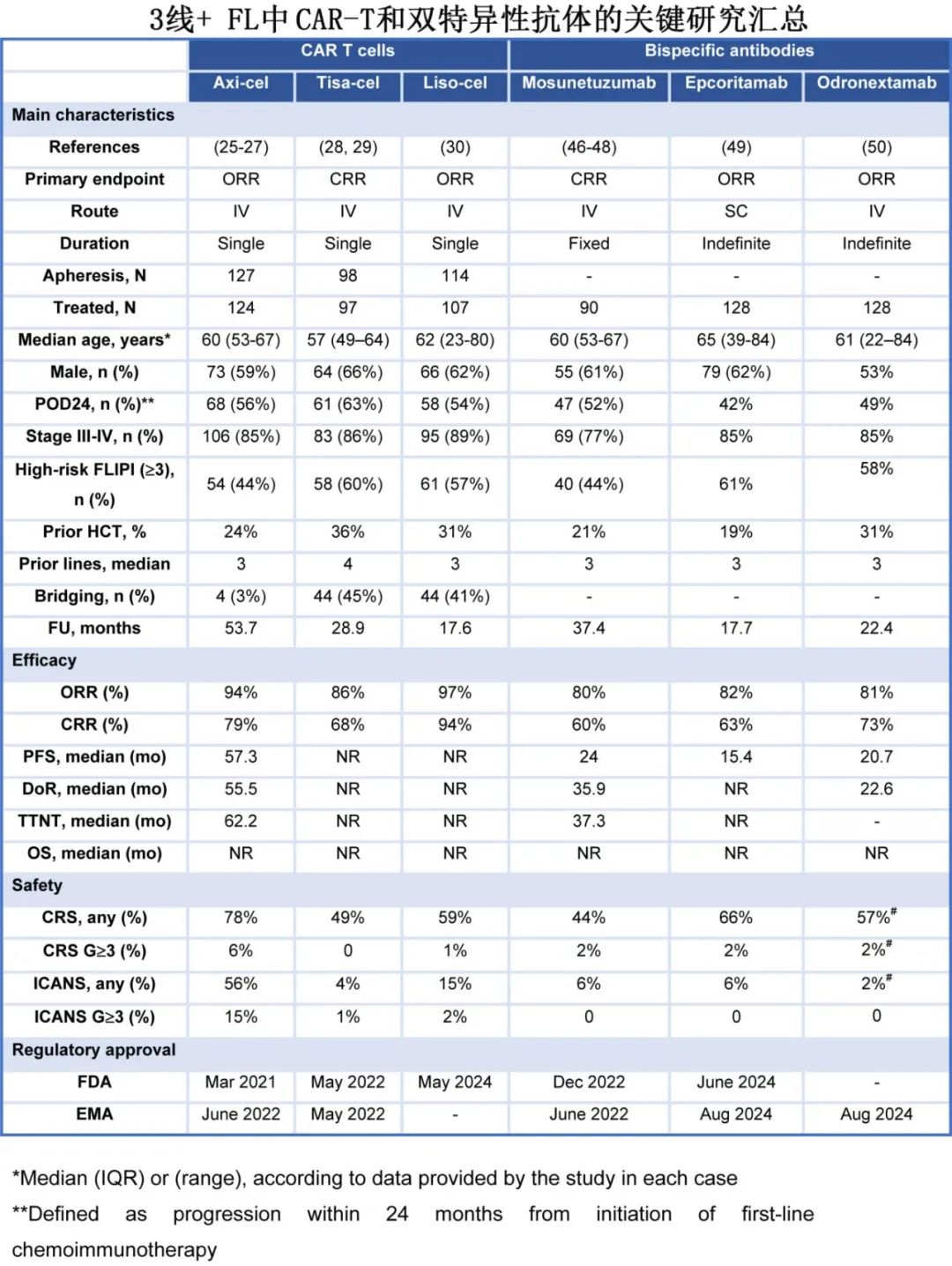
在 ZUMA-5 中,axi-cel 的总缓解率(ORR)为 94%(完全缓解率[CRR]为79%);CRS 和 ICANS 的发生率分别为 78%(6%为≥3 级)和 56%(15%为≥3 级)。在 ELARA研究中,与 ZUMA-5 相比,患者既往治疗线数更多(中位数分别为 4 和 3),POD24 患者比例更高(分别为 63%和 56%),桥接治疗的使用比例更高(分别为 45%和 3%)。在结果方面,tisa-cel 的ORR为 86%(CRR 68%),且与 axi-cel 相比安全性更佳,任何级别(≥3 级)的细胞因子释放综合征(CRS)和免疫相关不良事件(ICANS)发生率分别为 49%(0)和 4%(1%),导致其门诊给药更多(18%)。在 TRANSCEND FL 中,既往治疗线的中位数和 POD24 的百分比与 ZUMA-5 相似,但 41%的患者需要桥接治疗,13%为门诊管理;liso-cel 的ORR为 97%(CRR为 94%),安全性与 tisa-cel 相似,≥3 级 CRS(1%)和 ICANS(2%)的发生率较低。在 ZUMA-5 和 ELARA 中,通过总代谢肿瘤体积(TMTV)证明的基线高肿瘤负荷与疗效相关(ELARA 的数据尚未公布)。值得注意的是,对疗效有影响的 TMTV cutoff值与 CIT 中的历史值一致,并且与大 B 细胞淋巴瘤(LBCL)相比显著更高。对于 POD24,liso-cel 在该亚组中实现最高的CRR。关于单采前苯达莫司汀暴露,已知在 LBCL 中有负面影响,在 TRANSCEND-FL 和 ZUMA-5 中近期暴露(<6个月)不常见,但在后者中与PFS缩短相关,但在 ELARA 中未报告。在所有 3 种 CAR-T 产品均持久缓解,但目前尚未显示明显的平台期。在FL中,T细胞重定向研究随访时间最长的为 ZUMA-5(53.7 个月),其中位PFS为 57 个月,4 年PFS率为 53%;tisa-cel 的 2 年PFS率为 57%,liso-cel 的 1 年PFS率为 81%(中位数未达到)。反应的持久性与更高的峰值扩增有关,但与功能性 CAR-T 细胞的持久性无关。正在进行随机 3L+研究,以比较标准治疗(CIT 或 R 2 )与 CAR-T(ZUMA-22 中为 axi-cel 和 LEDA 中为 tisa-cel)。
FL的真实世界数据有限,随访时间较短。CIBMTR 登记组报告了 151 例 axi-cel治疗的结果,疗效与 ZUMA-5 相似(CRR 84%),无论试验资格、年龄、既往使用苯达莫司汀(未提供洗脱期)以及既往治疗方案如何;仅有 9%接受桥接治疗。毒性也与关键试验相当,证实 axi-cel 导致ICANS的发生率较高。法国 DESCAR-T 登记组也展示了 3L+ FL的结果(62 例[89%]接受tisa-cel 和 8 例[11%]接受axi-cel),CRR为 88%,重度CRS(1%)和 ICANS(4%)非常有限,与 tisa-cel 可控的短期不良事件特征一致。总之,所有这些数据都表明CAR-T的疗效出色,不良事件严重程度与LBCL相似。
双特异性抗体
FL中现有的 BsAbs靶向 B 细胞上的 CD20 和 T 细胞上的 CD3,触发免疫介导的肿瘤细胞杀伤。三种具有 1:1 结构的 BsAbs 获批用于 3L+ 级。 基于单臂研究,三种1:1结构的BsAbs已获批用于3L+ FL,且具有不同的目标剂量、路径和时间表。首先获批的是莫妥珠单抗(mosunetuzumab)(中位给药周期数 8 个)的ORR为 80%(CRR 60%),CRS发生率为 44%,主要为低级别且发生于第一个周期;仅有 6%出现ICANS。Epcoritamab 和 odronextamab 均持续给药直至疾病进展,显示出相似的 ORR(约 80%)和 CRR(分别为 63%和 73%),任何级别 CRS 的发生率略高(分别为 66%和 54%),但与莫妥珠单抗相比≥3 级 CRS 发生率相似(均不常见)。另一种具有 2:1 结构的双特异性抗体格菲妥单抗的初步结果显示 CRR 为 70%,但其开发重点在LBCL和套细胞淋巴瘤。
CAR-T
鉴于3L+的结果,正在进行的研究也在探索高危FL患者的二线(2L)治疗。其中TRANSCEND FL 是首次探索,纳入23 例符合 POD24 和/或改良 GELF 标准的患者给予 liso-cel 进行二线 CAR-T治疗;该群体在安全性(52% CRS [均为1-2级],17% ICANS [3级为4%])和疗效(CRR 为96%)方面与 3L+ 相似。随机 ZUMA-22 研究也在招募需要治疗的二线 POD24 患者;这两项研究将有助于确定CAR-T是否适合 POD24 FL的二线治疗。
双特异性抗体
鉴于BsAbs在安全性和有效性方面的良好表现,多项研究正在探索其联合其他方案。在 2L+ 治疗环境中的随机 3 期研究包括莫妥珠单抗-来那度胺对比 R 2 (Celestimo研究)、epcoritamab-R 2 对比 R 2 (EPCORE FL-1)以及odronextamab-来那度胺对比 R 2 (OLYMPIA-5研究)。所有 2L+ 研究均为1年固定周期治疗;预计Celestimo 研究最早完成(2025年)。
BsAbs也在一线治疗中进行探索。在 MorningSun 研究中,纳入低肿瘤负荷患者给予单药莫妥珠单抗,30例患者中的CRR为 83%(43%发生CRS,主要为 1 级)。两项由研究者发起的研究分别纳入 45 例和 23 例可评估疗效的患者给予 SC 莫妥珠单抗治疗,CRR分别为 76%(51%发生 CRS)和 83%(68%发生 CRS,均为 1 级)。正在进行的一线 3 期研究包括莫妥珠单抗-来那度胺对比 CIT(MorningLyte)、epcoritamab-R 2 对比 CIT(EPCORE FL-2)、odronextamab 对比 CIT(OLYMPIA-1)以及 odrongextamab 联合化疗对比 CIT(OLYMPIA-2)。所有这些研究都是概念性转变。前三个研究进一步探索了基于BsAb的无化疗试验性方案,有可能超越 CIT,要么作为单一药物(OLYMPIA-1),它们要么在 R 2 的基础上用BsAb完全替代抗 CD20 单抗(MorningLyte),要么在 R 2 的基础上进行初始“补充”(EPCORE FL-2)。与 2L+研究不同,这三个 1L 研究要求试验臂含BsAb维持阶段,以模拟抗 CD20 单抗标准治疗的 30 个月总时长。只有 OLYMPIA-2 在两个试验臂的诱导期间保留化疗,并以随机方式探索在BsAb+化疗诱导后是否需要BsAb维持。长期结果将有助于评估不同研究中诱导期间的BsAb方案以及维持对缓解持续时间、感染和 T 细胞耗竭的影响。
符合治疗标准的患者的一线治疗仍是基于 CIT,首选方案包括抗 CD20 单克隆抗体联合苯达莫司汀或 CHOP,具体方案取决于患者特征和当地方案。对于 POD24 患者,如果患者对 CIT 实现长期缓解,二线治疗通常依赖于R 2 ;如果CIT获得长期缓解,则可以考虑不同的化疗方案。应注意的是,在 B 细胞淋巴瘤中,在 CAR-T 治疗前 6-12 个月内不建议使用苯达莫司汀,对于预计在近期使用CAR-T 的患者应避免使用。鉴于其疗效,T细胞重定向治疗应优先用于 3L+患者;其他可用方案(包括泽布替尼-奥妥珠单抗和tazemetostat)应留给不符合T细胞重定向标准或处于治疗后期线的患者。T细胞重定向治疗的选择取决于患者偏好、疾病负担、年龄、体能状态和既往治疗,根据每个病例权衡每种方案的获益风险比。
从概念上讲,单次 CAR-T 输注可能比长期使用 BsAb 更便捷,然而后勤和财务方面的限制、CAR-T 制备所需的时间以及在社区医院和许多国家难以获得 CAR-T 可能是重大障碍。此外,CAR-T 与严重的 CRS 和 ICANS 风险较高有关,通常需要长期住院,因此只能在资源充足的专门中心进行管理。此外,还有其他毒性方面的担忧,特别是感染(非复发死亡率的主要原因)、长期血细胞减少症以及继发性恶性肿瘤,尽管后者的发生率似乎较低,而且在大多数情况下与 CAR-T 细胞没有直接关系。
而双特异性抗体是现货型,在大多数中心广泛可得,并且与可预测的低级别 CRS 相关,ICANS 非常罕见。因此双特异性抗体可针对更广泛的患者群体,并主要进行门诊管理;但仍需要 CRS/ICANS 培训和密切监测,并采取适当的感染预防措施。SC 途径可能与改善的药代动力学和安全性特征有关,可能会进一步增加其便利性。到目前为止,两者在FL中对总生存期和治愈潜力的影响仍不清楚,也不利于优先选择。然而就疗效而言,在 3L+ FL中进行的间接匹配比较显示 CAR-T 优于双特异性抗体,表明在 3L+中可能优先选择 CAR-T。重要的是,初步报告表明在LBCL中双向序贯治疗(先使用BsAbs后使用 CAR-T ,反之亦如此)是可行的。即使此类数据在滤泡性淋巴瘤中仍稀缺,但这也为特定患者的两种治疗顺序都留下了合理空间。
双特异性抗体有可能在早期治疗中取代抗 CD20 单抗,但仍存在一些疑问,包括治疗时长、维持治疗的价值以及 CD20 阴性复发的风险。尽管在二线治疗中初步结果很有希望,但出于安全考虑,可能会阻碍将 CAR-T 应用于惰性疾病早线治疗的热情。因此,鉴于BsAb使用方便且可联合,在早期治疗中BsAb可能更受青睐,尤其是在一线治疗中。由于不太可能开展 CAR-T 对比BsAb的随机研究,正在进行的研究的长期结果和真实世界数据将是比较这两种选择并确定 CAR-T 在治疗原则中最佳位置的关键。无论如何,在考虑将 CAR-T 应用于一线治疗之前,需要更好的工具来可靠地选择诊断时高危患者。协调两种方法的一个解决方案是 BsAbs 联合方案,可提供 CAR-T 中存在的2个信号,如格菲妥单抗(CD20/CD3) 和englumafuspα (CD19/4-1BBL),其在 LBCL 中显示出有前景的结果,并且可以代表 2L 甚至 1L FL 中 CAR-T 的潜在更安全的替代方案。
总之,FL的治疗前景正在迅速发展,有许多研究正在评估T细胞重定向疗法治疗R/R和一线FL。人们急切地等待着结果,以确定它们在FL治疗中替代 CIT 的潜力,并重塑这种惰性肿瘤的治疗方案。
参考文献
Iacoboni G,Morschhauser F.Building the Future Management of Follicular Lymphoma with T-Cell Redirecting Strategies.Blood . 2024 Nov 14:blood.2024025699. doi: 10.1182/blood.2024025699.
链接:http://www.lewenyixue.com/2024/12/02/%E3%80%90Blood%E3%80%91%E7%BB%BC%E8%BF%B0%EF%BC%9ACAR-T%E5%92%8C%E5%8F%8C%E7%89%B9%E5%BC%82%E6%80%A7/