胃癌遗传异质性:欧洲大型GWAS揭示亚型特异性风险位点及胃食管结合部癌的共同遗传病因
在全球化的医疗研究领域,胃癌作为全球癌症相关死亡的主要原因之一,其遗传异质性一直是科研工作者关注的焦点。本文通过深入分析胃癌的遗传风险结构,揭示了不同亚型胃癌的遗传特点,并探讨了胃食管结合部腺癌与Barrett食管的遗传联系。这项研究不仅为理解胃癌的发病机制提供了新的视角,也为未来的临床治疗和疾病预防策略提供了潜在的分子靶点。
01▼研究背景
胃癌(Gastric Cancer, GC)是一种临床上具有高度异质性的恶性肿瘤,根据其解剖位置可分为胃贲门(cardia)和非胃贲门(non-cardia)类型。此外,根据组织病理学特点,胃癌又可进一步细分为Lauren's弥漫型(diffuse)和肠型(intestinal)。不同亚型的胃癌可能涉及不同的病理机制,例如,肠型胃癌可能源自胃黏膜的化生-癌变序列,而弥漫型胃癌则不表现出癌前病变。了解这些亚型的遗传风险结构对于胃癌的早期诊断和治疗具有重要意义。
02▼研究方法
本研究采用了多步骤的方法来剖析胃癌的遗传异质性。首先,研究者进行了一项包含5814名患者和10999名对照的全基因组关联研究(Genome-Wide Association Study, GWAS),这些患者均有组织病理学确诊的胃腺癌。为了识别GWAS位点中的风险基因,研究者进一步进行了转录组关联研究(Transcriptome-Wide Association Study, TWAS)和表达量性状位点(Expression Quantitative Trait Locus, eQTL)研究,这些研究基于胃底和胃窦黏膜的基因表达数据。此外,为了测试胃贲门癌与食管腺癌(Oesophageal Adenocarcinoma, OAC)/Barrett食管(Barrett's Oesophagus, BO)是否存在遗传上的共同病因,研究者还使用了欧洲人群的GWAS样本。
03▼研究结果
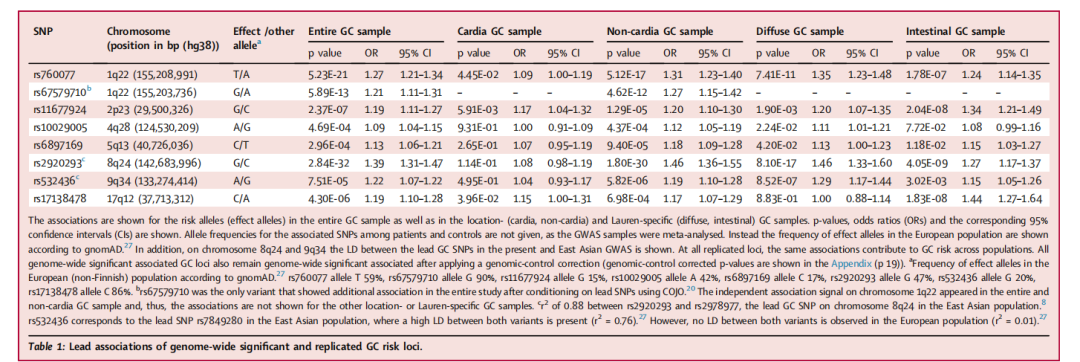
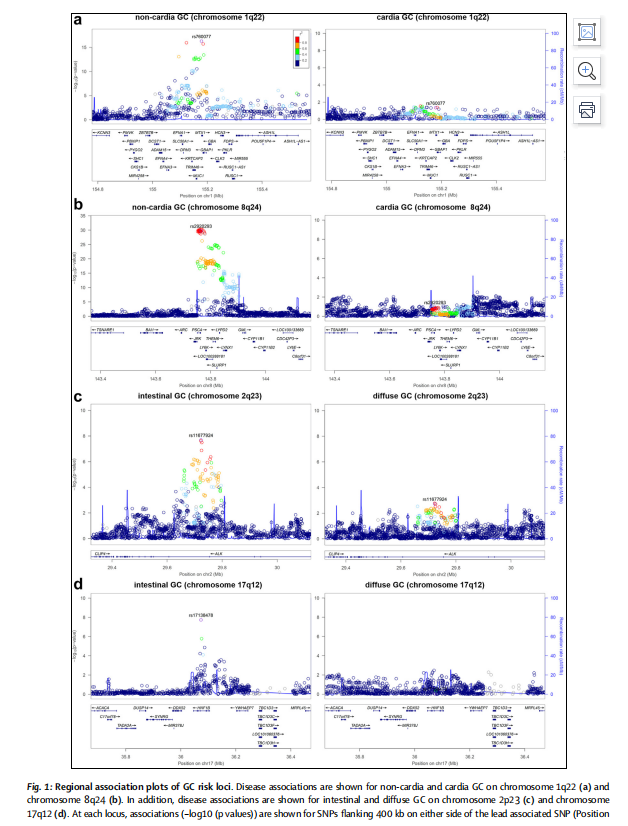
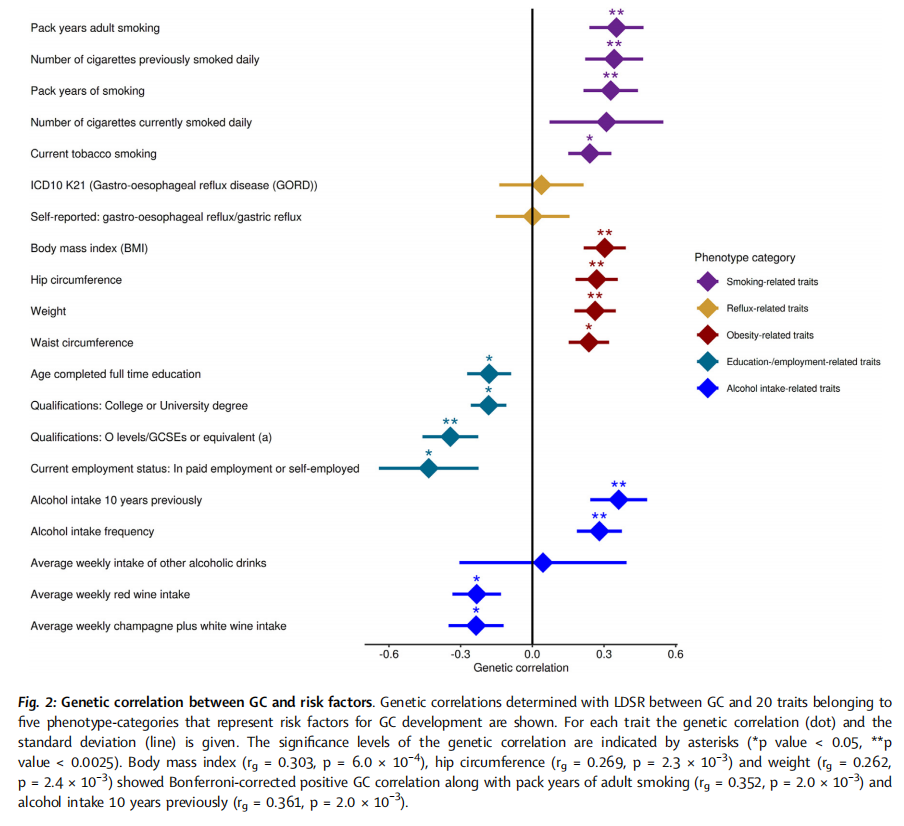
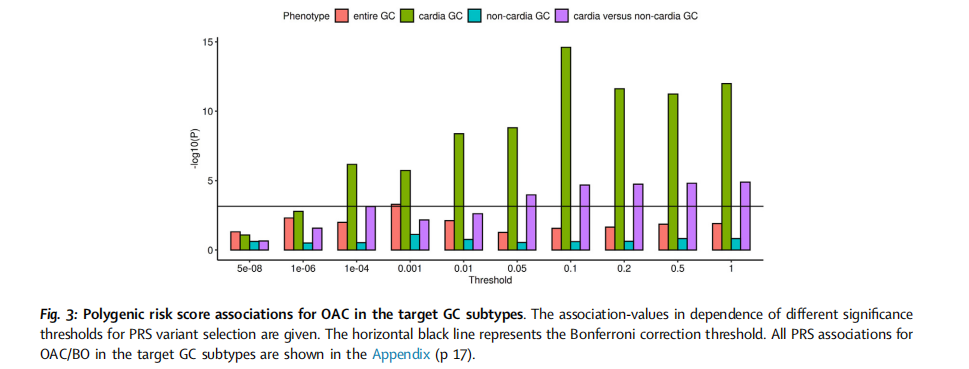
GWAS的结果显示,胃癌的遗传异质性根据其亚型而显著不同。研究新鉴定了两个风险位点,并复制了五个已知的胃癌风险位点,这些位点均表现出亚型特异性的关联。转录组数据分析表明,MUC1、ANKRD50、PTGER4和PSCA基因的上调表达可能是四个GWAS位点上胃癌发生的机制。在另一个风险位点上,研究发现血型O对非胃贲门和弥漫型胃癌具有保护作用,而血型A则增加了两种胃癌亚型的风险。此外,针对胃贲门癌和OAC/BO的GWAS显示,这两种癌症实体在多基因水平上共享遗传病因,并在单标记水平上鉴定了两个新的风险位点。
04▼总结讨论
这项研究的发现强调了胃癌的遗传异质性,并根据位置和组织病理学提供了不同的遗传风险结构。特别是,MUC1、ANKRD50、PTGER4和PSCA基因的发现为理解胃癌的分子机制提供了新的线索。血型O和A与胃癌风险的关联也揭示了可能影响胃癌风险的遗传因素。此外,胃贲门癌与OAC/BO在遗传上的共同病因表明,胃食管结合部的腺癌可能共享一些分子机制,这一发现对于未来的临床治疗策略具有重要意义。尽管本研究在胃癌的遗传结构研究方面取得了重要进展,但研究者也指出了其局限性,包括未能识别罕见风险变异以及样本量不足以开发用于疾病预测的胃癌多基因风险评分。未来的研究需要涵盖导致胃癌发生的整个遗传变异范围,以更全面地理解胃癌的遗传风险结构。
通过这项研究,我们不仅对胃癌的遗传基础有了更深入地认识,也为胃癌的精准医疗和个性化治疗提供了可能的途径。随着基因组学技术的不断进步和大样本GWAS数据的积累,我们期待未来能够发现更多与胃癌发生发展相关的遗传标记,并为胃癌患者提供更为精确的预防、诊断和治疗方案。
链接:http://www.lewenyixue.com/2024/11/21/%E8%83%83%E7%99%8C%E9%81%97%E4%BC%A0%E5%BC%82%E8%B4%A8%E6%80%A7%EF%BC%9A%E6%AC%A7%E6%B4%B2%E5%A4%A7%E5%9E%8BGWAS%E6%8F%AD%E7%A4%BA%E4%BA%9A%E5%9E%8B/