核医学成像对于神经母细胞瘤(NB)的诊断、分期、反应评估和长期随访至关重要, 需要儿科肿瘤学家和核医学医师之间的密切合作。目前的放射性核素检查包括碘-123标记的 123 I-mIBG闪烁扫描、单光子发射计算机断层扫描(SPECT)/计算机断层扫描(CT)、不同示踪剂的正电子发射计算机断层扫描(PET)/CT 以及 PET/磁共振成像(MRI)等混合成像。虽然核医学成像在 NB 中起着至关重要的作用,但也有一些局限性,关于该疾病的现有文献分散且零散,难以整体理解。
近日, 西班牙儿科血液学和肿瘤学会 (SEHOP) 和 西班牙核医学和分子成像学会 (SEMNIM) 神经母细胞瘤西班牙小组 的专家们在 Clinical and Translational Oncology 发文回顾了神经母细胞瘤中放射性核素成像的特点、诊断准确性、优势和局限性,并为负责管理NB患者的多学科团队提出了实用建议,对相关证据进行了分组和总结 , 我们一起来了解下。

https://doi.org/10.1007/s12094-024-03755-3
1
神经母细胞瘤的核医学成像
1.1 123I-mIBG闪烁扫描
MIBG 是一种肾上腺素类似物,于20 世纪 70 年代开发用于肾上腺髓质显像。 123 I-mIBG 闪烁显像(单独使用或最好与 SPECT/CT 联合使用)是一线核显像方法,用于:
-
NB 的初始分期
-
监测治疗反应
-
监测随访期间的复发性疾病
-
选择适合 131 I-mIBG 治疗的患者
-
诊断性 123 I-mIBG的性能已得到广泛研究。敏感性在 88% 到 93% 之间,特异性在83% 到 92% 之间,在一些研究中甚至更高。
为了检测 NB 转移,目前的标准核成像技术是 123 I-mIBG 全身平面闪烁显像和 SPECT-CT,以明确病理摄取的解剖位置,特别是当转移位于生理性摄取区域附近时,例如肝脏或膀胱。SPECT/CT 可将容积核成像与 CT 解剖成像相结合。优化的 CT 可以减少儿童所需的检查次数和镇静程序。然而,SPECT/CT 研究须因人而异,并且只有在有适当理由的情况下才能进行,因为 CT 辐射暴露会增加,并且要应用优化的低剂量儿科方案。此外, 123 I-mIBG 全身平面闪烁扫描也可用于治疗反应评估,最好与 SPECT/CT 一起使用,且所有评估都应使用相同的成像方法。
123 I-mIBG闪烁显像相比 MRI 等其他成像技术有许多优势。治疗后,MRI 扫描无法区分存活和死亡肿瘤组织,因此,由于治疗后非活动性 NB 转移、手术或放疗后的反应性变化或无 NB 受累的淋巴结肿大,可能会出现假阳性结果。与 MRI 不同, 123 I-mIBG成像不受这些治疗后变化的影响,因此在评估治疗反应方面具有高度特异性。此外,诊断和治疗后的 123 I-mIBG标准化半定量评分已被反复证明具有预后价值。诱导后评分>3与标准治疗的生存率较低相关,因此可识别出可从实验性试验中获益的“超高风险”患者。最后, 123 I-mIBG允许选择具有mIBG亲和性的患者进行 131 I-mIBG治疗。
另一方面, 123 I-mIBG闪烁显像也有局限性。约 10% 的患者在诊断时患有mIBG非亲和性肿瘤,并且在治疗期间存在亲和性丢失的潜在风险。此外, 123 I-mIBG闪烁显像对小病变的空间分辨率和灵敏度有限,尽管这些限制可以通过 SPECT/CT 成像部分克服。与其他成像技术相比, 123 I-mIBG闪烁显像的其他缺点是采集时间较长,可能需要镇静和甲状腺保护。
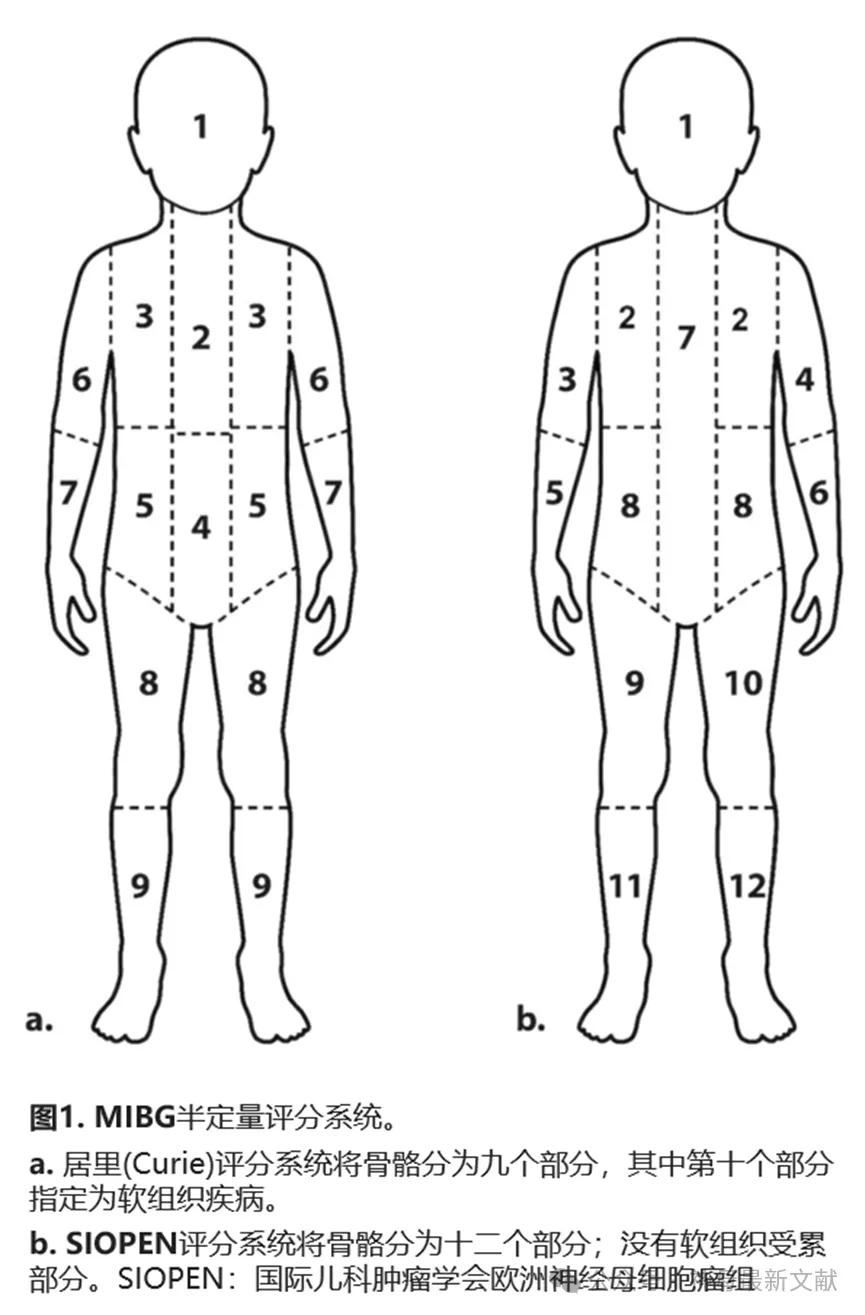
评分系统
有人提出采用 mIBG 检测结果的半定量评分系统(或评分)来客观评估 NB 患者的疾病负担和分布。这些评分可提供预后信息,可指导适当的治疗,并与治疗反应和生存率有很好的相关性。
目前有两种国际认可和接受的评分系统:居里(Curie)评分系统和 SIOPEN 评分系统(图 1)。这两种评分系统最初都是基于 mIBG 平面成像结果。尽管如此, 123 I-mIBG SPECT 或 123 I-mIBG SPECT/CT 可用于改善靠近生理摄取区域的病变解剖位置。
居里(Curie)评分系统将骨骼分为9 个部分,将第 10 个部分划分为软组织部分。该方法的扩展评分如下:0:无转移性病变;1:每个节段仅 1 个病变部位;2:每个节段多于 1 个病变部位;3:弥漫性病变面积 > 50% 的节段。患者的居里(Curie)评分 (CS) 通过将 10 个节段的评分相加得出,最高分为 30 分。COG 使用 Curie评分系统。
SIOPEN 评分将骨骼分为 12 个节段。该方法的扩展评分如下:0:无异常,1:一个离散病灶,2:两个离散病灶,3:> 三个离散病灶或弥漫性受累< 50% 骨,4:弥漫性(> 50% 的节段受累),5:弥漫性受累 > 50–95% 整个骨;6:均匀、弥漫性全骨受累。与居里评分系统不同,不包括软组织。患者的SIOPEN 评分是通过将全部 12 个单独骨骼节段的得分相加而计算出来的,最高分为 72 分。SIOPEN 评分系统的预后价值已在来自美国和欧洲的两个大型独立 4 期、mIBG亲和性、高危 NB 患者队列中得到验证。
1.2 PET
目前,PET 与 CT 结合使用 2-脱氧-2-[氟-18]氟-D-葡萄糖( 18 F-FDG PET/CT)或最近推出的放射性示踪剂相结合,是评估 123 I-mIBG 阴性或弱阳性 NB 的推荐技术,对于那些在治疗过程中或治疗后未能摄取 123 I-mIBG,或放射成像或临床发现提示比 123 I-mIBG 成像检测到的范围更广的 NB 也有帮助。 18 F-FDG-PET/CT是最适用于不摄取 123 I-mIBG的NB的技术。值得注意的是,10% 的 NB 为非mIBG亲和型。 18 F-FDG-PET/CT仍是这些病例的首选技术,在临床实践中常用作NB评估的PET示踪剂,部分原因是 18 F-FDG多年来一直是唯一可用的PET示踪剂。然而,值得注意的是,现在有了更新的 PET 示踪剂,为非mIBG亲和的 NB 的成像提供了更多选择。
PET/CT 甚至比 SPECT/CT更优于 123 I-mIBG。这些优势包括卓越的空间分辨率、肿瘤与背景组织之间的更高对比度、精确的病变量化、与横截面成像直接相关的完整断层成像、一次完成成像的能力、图像采集速度提高两到三倍,并且辐射负荷没有显著差异。PET 图像与 CT(有或无对比增强)或MRI 图像的实时配准可提高诊断准确性,并可能提供有关放射治疗计划和手术干预的更多信息。
18 F-FDG 是 18 F标记的葡萄糖类似物,在糖酵解部位聚集,包括大多数肿瘤和感染/炎症区域。 18 F-FDG PET 对 NB 的特异性低于 123 I-mIBG,因此被认为是二线技术。
18 F-FDG PET/CT 和 123 I-mIBG 扫描可以相互补充,这两种检查方式有时可以显示单独使用时无法看到的病变部位。同时扫描可能有助于评估疾病的全部范围,尤其是在治疗决策点。不过,放射线暴露可能是一个需要考虑的问题。此外,一些作者建议在大龄、晚期或MYCN扩增时进行 18 F-FDG PET检查。对于高风险复发性 NB 患者,它还可能有助于定位可触及的活检部位。
其他 PET 放射性示踪剂或放射性药物由于近期商业化和临床应用而越来越多地用于 NB,包括 6- 18 F-氟多巴胺 ( 18 F-FDOPA) 和间- 18 F-氟苄胍 ( 18 F-mFBG)、 124 I-mIBG 和 68 Ga-生长抑素类似物 (也称为 68 Ga-DOTA)。这些示踪剂将在“新型 PET 示踪剂”部分进一步讨论。
2
神经母细胞瘤核医学治疗指征
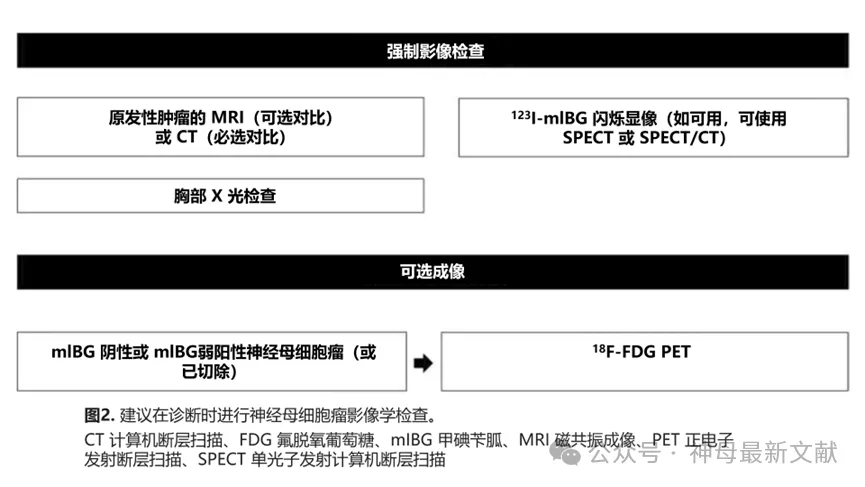
2.1 诊断成像
123 I-mIBG扫描是 NB 标准诊断评估的基本组成部分。对于原发性肿瘤的局部分期,MRI 通常是首选检查,因为它无需放射即可提供更好的分辨率,尤其是当怀疑有脊髓压迫或硬膜外或颅内疾病的椎旁肿瘤时。增强 CT 也是一个选择。然而, 123 I-mIBG 的亲和力对于表征肿瘤至关重要。如果 NB 不亲和 mIBG,或者无法确定 mIBG 检测到的范围以外的进一步损害,则可能需要使用 PET 等替代成像技术(图 2)。
2.2 初步分期
金标准分期技术是 123 I-mIBG 闪烁显像。强烈推荐在平面闪烁显像中添加 SPECT-CT,这已成为伽马照相机成像的标准。对于诊断时 mIBG 阴性或弱阳性的患者,建议使用 18 F-FDG PET/CT。
熟悉当前的分期系统对于全面理解其在疾病分期中的作用至关重要。传统上,NB 分期使用国际神经母细胞瘤分期系统 (INSS)进行,该系统基于原发性肿瘤切除的等级和局部区域淋巴结受累的病理评估。因此,分期是在术后确定的。目前,分期是按照最近定义的国际神经母细胞瘤风险组分期系统 (INRGSS) 进行,允许进行手术前分期(表 1)。在该分期系统中,局限性肿瘤标记为L,转移性肿瘤标记为M;这两个阶段根据诊断时的可切除性细分为 L1/L2,并细分为 M/Ms 以定义预后较差的转移性亚组。定义 L1 或 L2 的手术风险基于一组预先确定的影像定义风险因素 (IDRF),这些因素描述了肿瘤与与高手术并发症风险相关的重要结构(主要血管、神经和气道)之间的关系(表 2)。当存在 IDRF 时,手术作为初始治疗是禁忌的。因此,L2 患者可能需要前期治疗。Ms 患者是婴儿,预后较好,转移有限,如骨髓、皮肤和肝脏。


自 2014 年以来,COG 和 SIOPEN 临床试验已使用 INGRSS 代替 INSS 进行 NB 分期。INGRSS是术前 NB 分期的金标准,因为它具有可重复性。它对于比较临床试验结果以及改善外科医生和其他临床医生之间的沟通至关重要。建议使用 INGRSS,因为它是临床实践中最常用的系统,也是 COG 和 SIOPEN 临床试验中使用的系统。
双侧骨髓穿刺和活检用于评估骨髓转移性疾病的存在,并进行生物学研究以评估疗效和早期复发检测(微小残留病检测)。
一旦确定了阶段,就必须对患者进行分类以优化治疗。NB 的特征之一是其临床异质性。虽然低风险疾病的儿童可以接受观察或接受手术,但中风险患者需要化疗、切除和/或放疗,具体取决于组别。高风险患者接受强化多模式治疗,包括化疗、手术、自体干细胞拯救的清髓性化疗、外照射和免疫治疗。因此,适当对患者进行风险分层对于优化治疗至关重要。
在过去的几十年中,许多临床和生物学因素已被纳入 NB 风险分类系统,用于在治疗前对患者进行分类。不同的合作组织,如 COG、SIOPEN、CCLG 或 GOPH,使用了不同的预后因素来定义风险组,这使得在不同研究中比较治疗方法变得困难。
2.3 治疗反应监测
原发性肿瘤和转移性肿瘤的治疗反应通过影像技术进行评估,包括核医学研究,最常见的是 123 I-mIBG 闪烁显像或 18 F-FDG PET(用于mIBG 非亲和性肿瘤)。放射性核素扫描和组织学评估(用于量化骨髓受累程度)也是治疗反应评估的重要组成部分。应结合每个单独组成部分的反应(包括软组织、骨骼和骨髓疾病)来确定总体反应。
123 I-mIBG闪烁显像可区分残留的原发性肿瘤与 CT 和 MRI 上可见的治疗后变化。在这种情况下,居里评分系统或 SIOPEN 评分系统用于评估转移反应。没有证据表明一种评分系统优于另一种。GOPH在一项对 58 名年龄超过 1 岁的 4 期 NB 患者的回顾性研究中比较了诱导治疗后居里评分和 SIOPEN 评分的预后价值。结果非常相似。然而,该研究并未包括诱导期以外的居里评分或SIOPEN 评分的评估。
2017 年,神经母细胞瘤临床试验联盟(Neuroblastoma Clinical Trials Consortium)、COG、SIOPEN 和 GPOH 制定了修订版国际神经母细胞瘤疗效标准 (INRC),用于评估新诊断和复发性或难治性 NB 的治疗反应。这些标准为评估治疗反应提供了一种标准化的方法。它结合了 123 I-mIBG 居里或SIOPEN 评分或 18 F-FDG 亲和病变的数量来确定原发性肿瘤和转移瘤的治疗反应。可以使用 123 I-mIBG SPECT 或 123 I-mIBG SPECT/CT进行评分。所有评估都应一致使用相同的方式。
18 F-FDG PET/CT 也可用于评估治疗反应以及区分残留疾病与治疗后改变。
2.4 随访期间监测复发疾病
所有临床实践建议中,评估治疗反应和随访的推荐时间点并不相似。
对于低风险和中等风险的 NB,建议采用LINES 2009(欧洲低风险和中等风险神经母细胞瘤研究)中提出的随访计划,该计划基于低风险 NB 的欧洲标准临床实践 (ESCP) 方案。该随访计划将所有“非高风险”NB 患者的治疗归入一个方案。该方案建议至少在完成治疗后的第一年每 12 周使用超声、CT 或 MRI 对原发肿瘤部位进行一次成像,然后每年一次,持续五年。对于转移性评估,如果完成治疗后残留骨骼 123 I-mIBG 呈阳性,该方案建议每 4-6 个月进行一次 123 I-mIBG 扫描,直至呈阴性或进展。如果一年内病情稳定,建议每年扫描一次,最长五年。
同样,对于 HR-NB,建议采用SIOP-Europe 高危神经母细胞瘤研究 1.8 (SIOPEN) 中的时间表,该时间表基于 HR-NB 的 ESCP 协议:(1)第一年每三个月对原发部位进行一次成像(超声、CT、MRI),第二年和第三年每六个月一次,之后每年一次,直至五年;(2) 对于转移性评估,采用与 LINES 2009 研究相同的时间表:如果残留骨骼 123 I-mIBG 为阳性,则每 4-6 个月进行一次 123 I-mIBG 扫描,直至转阴或出现进展。如果一年内病情稳定,建议每年扫描一次,直至五年。
在 HR-NB 中, 123 I-mIBG 也用于确定诱导治疗后的疗效和治疗继续计划。有足够应答的患者继续接受标准治疗,包括巩固治疗。如果反应不充分,则应提供其他替代方案。转移性反应的定义为:(1) 诱导后 SIOPEN 评分 ≤3,且较基线减少 ≥ 50%,或 18 F-FDG PET/CT 显示骨病变 ≤ 3 个,且较基线减少 ≥ 50%;(2) 骨髓完全缓解或轻微病变(根据 INRC);(3) 任何其他转移部位完全缓解。
至于长期随访,应按照 COG 长期随访建议对患者进行长期随访,以收集有关长期毒性、晚期复发和第二种恶性肿瘤的信息。
2.5 预后
INRG 分期和MYCN扩增是最重要的 NB 预后因素。其他风险因素包括年龄 ≥ 18 个月和其他不良特征。然而, 123 I-mIBG 半定量评分已被证明具有预后价值,无论是绝对值还是相对值(即治疗后减少值)。
诊断时, 123 I-mIBG摄取程度可预测 1 岁以上转移性疾病患儿对化疗的反应。初始化疗后,皮质骨和骨髓中持续存在 123 I-mIBG 摄取与预后不良相关。在对 HR-NB 患儿进行串联大剂量化疗 (HDC) 和自体造血细胞移植的情况下,诊断和诱导结束 (EOI) 时的CS(居里评分)可能识别出更有利的患者组。接受串联 HDC 治疗且诊断时 CS ≤ 12 或 EOI 时 CS = 0 的患者的 EFS 优于CS 高于这些截止点的患者。
除病变识别外, 18 F-FDG PET 还可用于肿瘤表征和预后评估。近年来,一些出版物显示了 18 F-FDG PET/CT 在 NB 中的重要预后价值。Man 等人发现代谢肿瘤体积 (MTV) 和总病变糖酵解 (TLG) 是肿瘤进展的重要预测因素,与PFS有很好的相关性。此外,MTV 是 OS 的唯一独立预后因素。2023年,一项对8项研究(共325名参与者)的系统评价和荟萃分析表明,最大SUV越高,OS越短。此外,其他作者开发了一个整合放射组学特征和临床风险因素的组合模型,该模型对高危儿童 NB 患者的无事件生存期显示出更准确的预测性能,有助于设计治疗策略、个体化治疗和随访。这些数据凸显了 18 F-FDG PET/CT 在补充当前风险分层系统方面的潜在作用。然而,还需要进一步验证和标准化。
3
临床和技术要求
3.1 123 I-mIBG闪烁显像
表3总结了日常实践中使用 123 I-mIBG 闪烁显像的临床和技术建议。这些建议基于之前的指南、 123 I-mIBG 产品特性摘要、SIOPEN 临床试验方案以及作者的经验。



需要强调的是,必须停用所有可能干扰 123 I-mIBG 摄取和/或保留的药物,尤其是:(1) 三环类抗抑郁药(如阿米替林amitriptyline);(2) 拟交感神经药物(鼻喷雾剂中的血管收缩剂,如苯肾上腺素、麻黄素、伪麻黄碱);(3)某些降压药(拉平他乐labetalol、利血平reserpine),(4) 含有拟交感神经药物的常用哮喘和咳嗽药物。钙通道阻滞剂(地尔硫卓diltiazem、硝苯地平nifedipine、维拉帕米verapamil)经常被列入干扰 mIBG 摄取的药物名单,然而目前还缺乏确切的证据,因此可能没有必要停用这些药物。
必须进行甲状腺阻断,以防止甲状腺吸收从 123 I-mIBG 分子中解离出来的游离放射性 123 I,从而避免不必要的辐射。饱和碘化钾溶液或碘酸钾片(可粉碎并溶于水)可成为有效的甲状腺阻断方法(表 3)。
了解正常的 123 I-mIBG生物分布对于避免误解是必要的。 123 I-mIBG在唾液腺、鼻咽、心肌、肝脏和肾上腺中摄取正常,并通过肾集合系统、膀胱,有时通过肠道(尤其是结肠)排泄。泪腺偶尔会显示低度 123 I-mIBG 摄取,通常是对称的。必须考虑到这种摄取,因为它可能与外壳重叠并导致假阳性。脾脏的摄取要么非常低,要么根本不存在。月经周期期间子宫可能会摄取 123 I-mIBG。正常摄取的部位还包括锁骨上、肋间和肾旁区域的棕色脂肪(通常双侧)。应结合断层成像进行解读 123 I-mIBG 扫描结果。
3.2 18 F-FDG PET/CT
表4总结了日常实践中使用 18 F-FDG PET/CT 的临床和技术建议。这些建议基于之前的指南、 18 F-FDG 产品特性总结以及作者的经验。

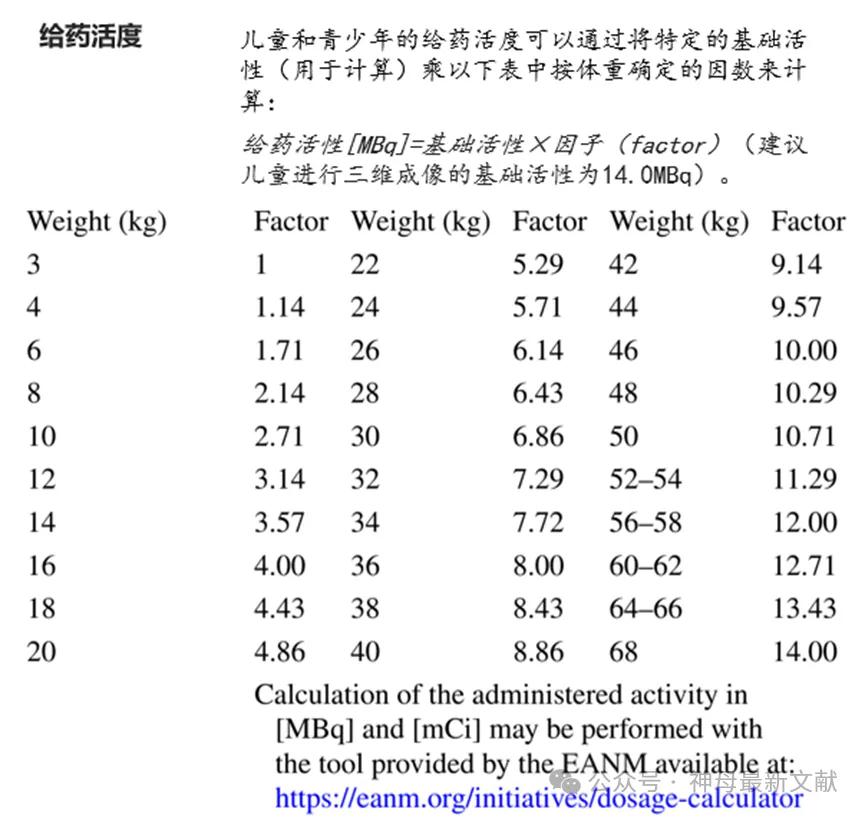

18 F-FDG 在儿童体内的正常生理分布包括脑、唾液腺、韦氏环淋巴组织、眼肌、胸腺、心脏、肝脏、脾脏、肠道、睾丸、长骨骨骺、乳腺以及青春期女性的妇科器官。 18 F-FDG 还通过肾脏、输尿管和膀胱进行生理性消除。此外,棕色脂肪在儿童和青少年体内经常被激活。骨髓活性各不相同,即使使用 CT 相关性评估骨髓受累情况也具有挑战性。
4
新型 PET 示踪剂
目前,PET 放射性药物包括代谢和受体介导化合物以及各种实验性示踪剂。使用新型示踪剂进行成像扫描具有潜在优势,例如提高图像分辨率、能够检测到更多斑点、缩短无需镇静的检查时间、减少辐射暴露(包括避免甲状腺摄取)。然而,一个明显的缺点是可用性有限和缺乏验证。此外,一些示踪剂与 123 I-mIBG 具有相同的缺点:无法检测非亲和性肿瘤和甲状腺摄取。其中一些示踪剂也可用于治疗目的。讨论使用这些新型 PET 示踪剂的临床和技术要求超出了本文的范围。强烈推荐 Bar-Server 等人于 2023 年出版的全面而出色的儿科核医学实用指南( A practical guide for pediatric nuclear medicin e. Berlin [Heidelberg]: Springer; 2023 ),其中包含有关这些要求的详细信息。
4.1 18 F-FDOPA PET
18 F-FDOPA是 L-DOPA(L-二羟基苯丙氨酸),多巴胺、去甲肾上腺素和肾上腺素的前体,用放射性同位素 18 F标记。
18 F-FDOPA摄取对 NB 具有相对特异性;当可用时,它被视为 123 I-mIBG 的首选 PET 替代品。2018年 EANM 指南提到 18 F-FDOPA 作为 123 I-mIBG 阴性或弱阳性 NB 的替代示踪剂(超说明书指征)。它也可以被认为是 68 Ga-生长抑素类似物NB 显像的更好替代方案。当怀疑 NB 复发时,它也可能发挥作用, 因为与 123 I-mIBG 闪烁显像相比,它在检测软组织复发/转移和骨病变方面具有显著优势(p < 0.001 )。
4.2 68 Ga-生长抑素类似物
有 3 种用 68 Ga标记的生长抑素类似物肽:(1) 68 Ga -DOTA-TOC;(2) 68 Ga-DOTA-NOC;(3) 68 Ga-DOTA-TATE。它们的主要区别在于它们对 77–89% NB 细胞中存在的不同生长抑素受体(SSTR)的亲和力不同。SSTR2 表达水平较高与 68 Ga-DOTA-TATE 摄取水平较高相关,由于存在2型生长抑素受体,该药物对 NB 具有亲和力。临床上对特定肽的选择通常取决于当地的可用性,因为诊断结果似乎相对接近。
一些证据表明, 68 Ga-生长抑素类似物 PET/CT 对NB 分期和评估的敏感性高于传统 123 I-mIBG闪烁显像,尽管前瞻性数据稀缺。它们是 123 I-mIBG的二线 PET 替代品,具有治疗诊断应用潜力。
这些示踪剂还有其他一些优点。使用 68 Ga-DOTA-肽进行成像对儿科患者来说是安全可行的,并且具有实际意义,例如患者准备简单、药物间相互作用少。 68 Ga来自发生器,因此更容易获得,并且对于没有回旋加速器的中心来说很实用。它的半衰期短(68 分钟),可以在1天内进行成像,且辐射暴露量低于 123 I标记的示踪剂。此外,它的摄取可用于识别儿科患者中肽受体放射性核素治疗 (PRRT) 的潜在候选药物,例如镥-177( 177 Lu-DOTA-奥曲肽),尽管这仍在研究中。肽受体放射性核素治疗的安全性和可行性已在小群难治性或复发性 NB 患者中得到证实。最后, 68 Ga-生长抑素类似物的摄取可能具有预后价值。
4.3 18 F- mFBG
18 F-mFBG是用放射性同位素 18 F标记的 mIBG 氟化类似物。它通过与 123 I-mIBG 相同的去甲肾上腺素转运体摄取机制在细胞中积累,具有相似的生物分布。然而, 18 F-mFBG 更亲水性,具有组织摄取和肾脏清除速度更快的优势。
一项临床前研究报告称,体内肿瘤摄取量比 123 I-mIBG高三倍。给药后一小时,45% 的给药活性物质被排出,3-4 小时后可达 95%。在临床研究中,与 123 I-mIBG 扫描相比, 18 F-mFBG PET/CT 检测到的 NB 定位更多。2023 年,Samim等人报告称,在 14 名患者的 20 次配对扫描中,11 次 18 F-mFBG PET/CT 的 SIOPEN 评分高于 123 I-mIBG 。Wang等于 2023 年发表了一 40 例患者的文章,这些患者均通过 CS 进行评估,与 123 I-mIBG SPECT/ CT 相比, 18 F-mFBG PET/CT 有 46% 的患者 (p < 0.001) 评分增加,更重要的是,8 例患者的分期上升。因此, 18 F-mFBG PET/CT 有望用于未来的 NB 分期和治疗反应评估。然而,由于采用回旋加速器生产,临床经验和可用性有限。
4.4 124 I-mIBG
MIBG 成像也可使用 PET 放射性同位素 124 I进行。 124 I-mIBG 具有与 123 I-mIBG 类似的摄取机制和生物分布。一些研究评估了 124 I-mIBG PET/CT 在诊断成像和 131 I-mIBG 治疗前剂量测定中的作用。然而,其诊断用途有许多局限性,包括诊断目的的高辐射暴露、与 18 F或 68 Ga 标记放射性示踪剂相比图像质量较差、成本高或缺乏经验。
4.5 11 C-mHED
11 C标记的羟基麻黄碱( 11 C-mHED)是另一种去甲肾上腺素类似物。 11 C-mHED 具有高度亲水性,可通过 NET 在髓质交感神经组织中快速蓄积(数分钟内),并在神经嵴肿瘤中滞留时间长。由于肝脏和肾脏会迅速从血液中消除,因此建议在施用示踪剂后 30 分钟内进行最佳成像。
11 C的半衰期很短,只有 20 分钟,这既是优点也是主要限制。这是一个优点,因为它产生的辐射暴露量比 123 I-mIBG 少得多。然而,它也是一个限制,因为它需要现场回旋加速器、复杂的放射化学标记程序和严格的时间安排。这种示踪剂的临床证据有限,但表明在检测 NB 病变方面具有很高的诊断准确性。
5
结论
-
三级儿科肿瘤科需要高度专业化的多学科团队来诊断、治疗和跟踪 NB 患者。
-
核医学成像对于诊断成像、分期、治疗反应监测、随访、预后和放射性核素治疗计划至关重要。
-
推荐使用 INRG 治疗前分类方案作为风险分层系统,以及 SIOPEN mIBG 方法评分系统。
-
123 I-mIBG联合 SPECT-CT 是分期和疗效评估的金标准。对于mIBG 阴性或弱阳性患者,建议进行 18 F-FDG PET/CT 检查。
-
须强调 18 F-FDG PET/CT 在诊断、分期和监测非mIBG阳性NB治疗反应方面的关键作用。该诊断工具非常准确,有助于预测疾病进展、反映肿瘤负担并确定患者的预后。此外,它可用作高危神经母细胞瘤患者的补充工具。
-
核医学成像在诊断NB以及以绝对值或相对值评估治疗反应时也具有预后价值,但需要进一步实施标准化指南以便在多中心环境中进行比较。
与 123 I-mIBG闪烁显像图像相比,新型 PET 放射性示踪剂可实现高分辨率、高质量的三维图像。它们需要更短的采集时间、更低的辐射量,并可避免甲状腺毒性。这些放射性药物中的几种已在成人神经内分泌肿瘤患者的临床实践中使用,并取得了优异的效果。它们的主要缺点是缺乏对儿科人群的验证。考虑优先确定它们是否可以取代 123 I-mIBG 闪烁显像。 18 F-FDOPA PET 和 68 Ga-生长抑素类似物PET 将成为当前金标准( 123 I-mIBG闪烁显像)的第一和第二替代方案。
责编

制作
排版 | 车洁 校对 | uu
▼滑动查看更多▼
Neuroblastoma (NB) is the most common extracranial solid cancer in children. Despite intensive multimodality treatment, long-term survival of patients with high-risk NB, which comprises more than half of all cases, remains poor. Nuclear medicine is key in diagnosis, staging, response assessment and long-term follow-up of NB. The emergence of novel tracers and the increasing complexity of studies require updated guidelines for nuclear medicine imaging in NB. Standardising diagnostic techniques are essential for improving study comparability and ensuring test quality. This article aims to provide a comprehensive review of NB radionuclide diagnostic imaging, including its characteristics, accuracy, advantages, and limitations. It offers practical recommendations to multidisciplinary teams responsible for treating patients with NB. This review summarises the opinions of leading experts from the Neuroblastoma Spanish Group within the Spanish Society of Paediatric Haematology and Oncology (SEHOP) and the Spanish Society of Nuclear Medicine and Molecular Imaging (SEMNIM).
DOI: 10.1007/s12094-024-03755-3
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/11/21/CTO%20%7C%20%E7%A5%9E%E7%BB%8F%E6%AF%8D%E7%BB%86%E8%83%9E%E7%98%A4%E6%82%A3%E8%80%85%E5%A6%82%E4%BD%95%E4%BD%BF%E7%94%A8%E6%A0%B8%E5%8C%BB/

















赶快来坐沙发