Nature:我国学者开发通用的临床功能蛋白质组学策略——TMEPro,为胰腺癌诊断与治疗提供全面资源
世界卫生组织国际癌症研究机构 (IARC) 于今年年初发布的最新评估数据显示 【1】 ,2022年,全球癌症新增病例1996万例,全球癌症死亡病例974万例,大约五分之一的男性或女性一生中会患上癌症,而大约九分之一的男性和十二分之一的女性会死于癌症。而我国是名副其实的全球癌症第一大国,2022年癌症新增病例约480万 (占全球总数的24%) ,癌症死亡病例约260万 (占全球总数的26.7%) 。
在众多癌症类型中, 胰腺导管腺癌 (PDAC,胰腺癌的最主要类型) 特别值得关注,它是最致命的癌症之一,5年生存率低于10%,中位生存时间小于6个月 【2】 。到2024年,PDAC已成为癌症相关死亡的第三大原因 【1】 。
缺乏可靠的早期诊断生物标志物、高度异质性的肿瘤微环境 (TME) 以及对几乎所有现有治疗方法的顽强抵抗,是PDAC患者预后不良的主要原因。令人遗憾的是,长期以来,关于PDAC癌细胞与基质细胞之间相互信号传递的蛋白质组水平的功能信息在很大程度上是缺失的,这也严重影响了PDAC的预防诊断和治疗。
2024年11月,南方科技大学 田瑞军 、华中科技大学同济医学院附属同济医院 秦仁 义 、中国科学院分子细胞科学卓越创新中心 高栋 等人在国际顶尖学术期刊 Nature 上发表了题为: Clinical functional proteomics of intercellular signalling in pancreatic cancer 的研究论文。
该研究开发了一种 多维蛋白质组学策略—— TMEPro 。这是一种普遍适用的临床功能蛋白质组学策略,同时也是一个全面资源,以帮助更好地理解PDAC肿瘤微环境和促进发现PDAC的新型诊断标志物和治疗靶点。
肿瘤微环境 (TME) 是癌症的一个重要标志。值得注意的是,PDAC具有一种非典型的、高度间质性的TME,富含许多非恶性基质细胞和广泛的细胞外基质 (ECM) 成分,促进肿瘤的的增殖、转移和耐药。
近年来,基于质谱 (MS) 的蛋白质组学在研究胰腺癌中具有时空分辨率的信号转导而越来越受欢迎。此前有研究表明,致癌KRAS通过GAS6-AXL和IGF1-IGF1R等信号轴驱动胰腺星状细胞 (PSC) 和胰腺癌细胞 (PCC) 之间的相互信号传导,以调节共培养系统中PCC的增殖和凋亡。
PDAC的全面蛋白质组学和基因组特征揭示了蛋白质表达、翻译后修饰和基因组改变与临床信息的相关性,并确定了分子亚型。然而,这些研究的一个共同局限性是,对整体组织的全局分析不能完全阐明PDAC的细胞复杂性和异质性的影响。
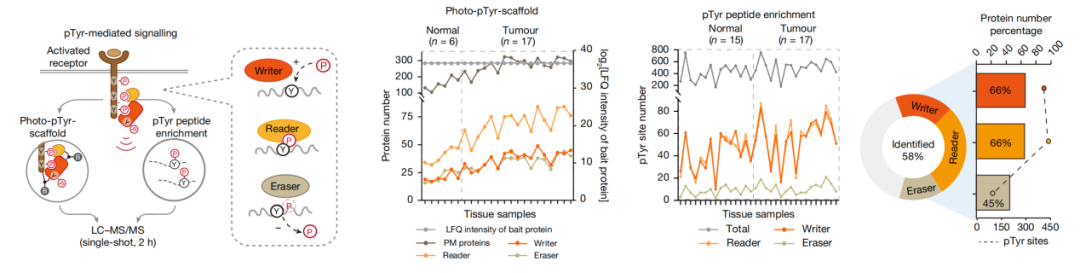
在这项最新研究中,研究团队通过对分泌组、pTyr蛋白质修饰组和STAT3相互作用组的全局分析,研究了从PCC到PSC的旁分泌信号,并发现PSC来源的LIF是作用于PCC的关键旁分泌介质,从而影响疾病进展和药物反应。
通过多维生物信息学分析和时空整合分泌蛋白和质膜 (S-PM) 的功能蛋白质组,研究团队开发了一种普遍适用的临床功能蛋白质组学策略—— TMEPro ,用于在蛋白质组学规模上全面探索PDAC-TME中癌细胞和基质细胞之间配体-受体相互作用介导的全面信号图谱。
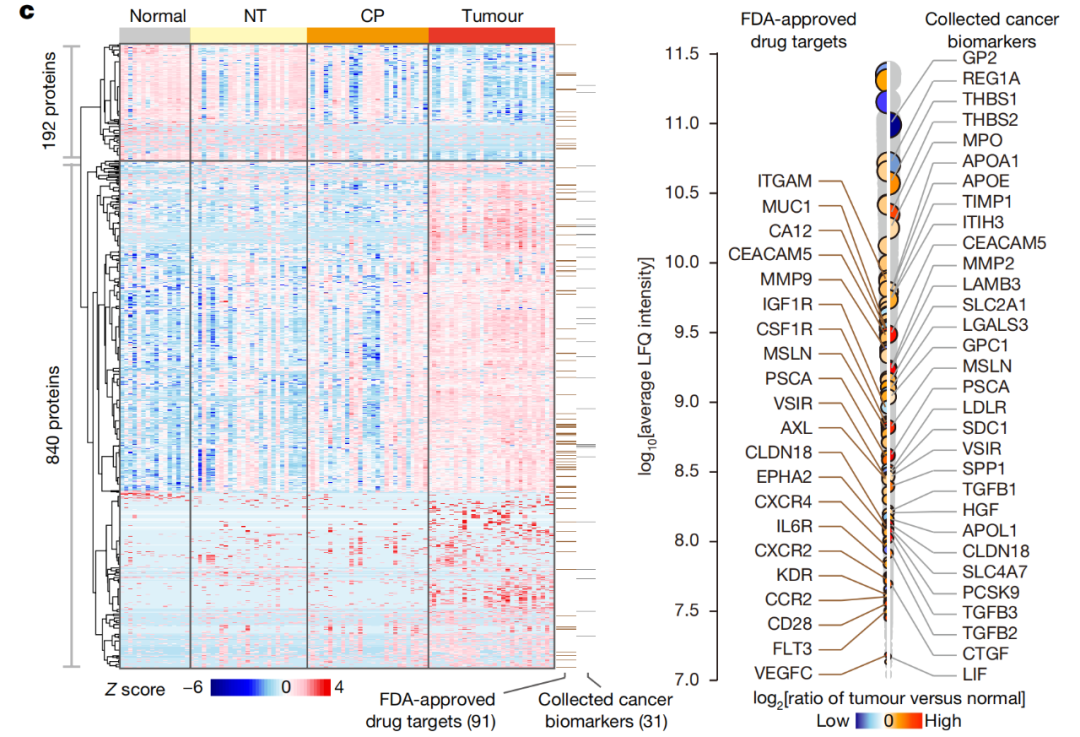
研究团队对100个人类胰腺组织样本的糖基化分泌蛋白和质膜蛋白质组进行了非常深入的分析,共鉴定出2741种S-PM蛋白、6181种非冗余N-糖基化位点和80种新的N-糖基化蛋白,覆盖了已知S-PM蛋白质组的一半以上。S-PM蛋白质组的注释显示,76%的蛋白质具有细胞间通信作用,包括跨膜受体和分泌配体,这对细胞间信号传递至关重要。
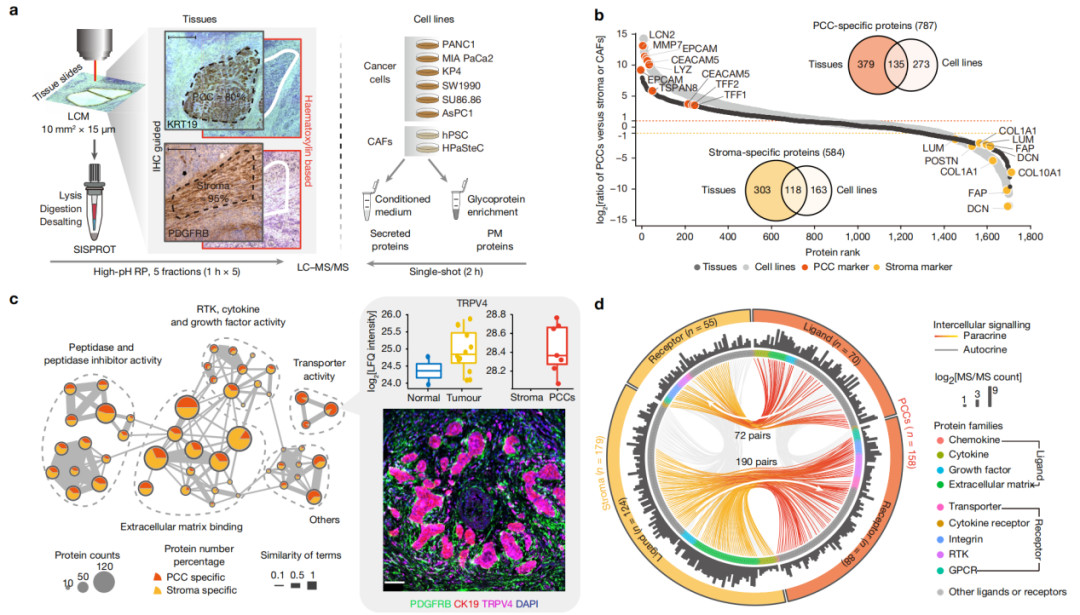
空间分辨和细胞类型特异性蛋白质组分析揭示了PDAC中的细胞间信号传导
通过TMEPro,研究团队确定了PCC和基质细胞的起源,并揭示了潜在的旁分泌串扰,特别是通过酪氨酸磷酸化介导的串扰。在基因工程PDAC小鼠模型中,研究团队构建了胰腺肿瘤进展过程中的时间动力学。在功能上,研究团队还揭示了由基质PDGFR-PTPN11-FOS信号轴介导的基质细胞和癌细胞之间的相互信号传导。
在PDAC中酪氨酸磷酸化介导的细胞间信号传导的功能分析
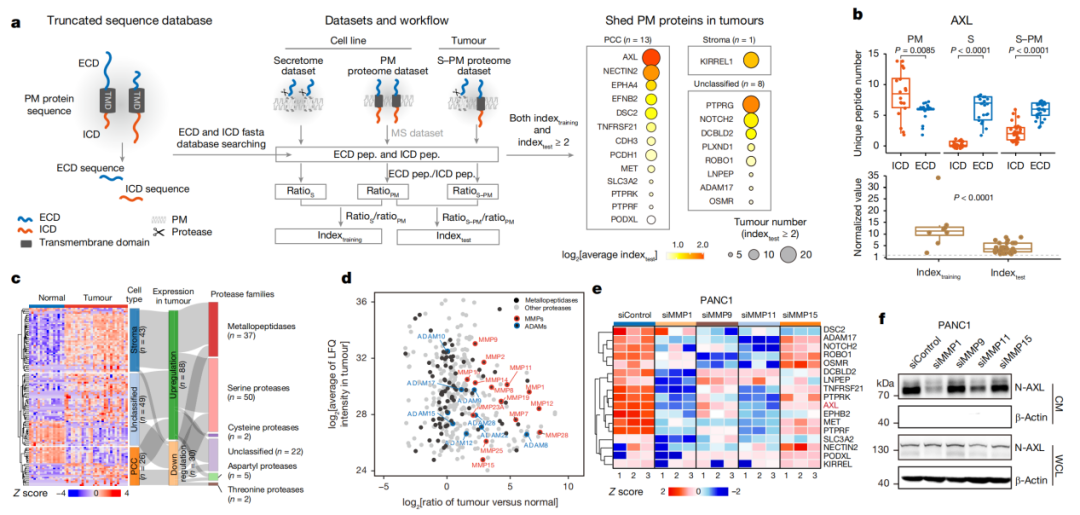
与此同时,研究团队还对PDAC肿瘤中质膜蛋白的一般脱落机制展开探索,并发现基质金属蛋白酶介导的AXL受体酪氨酸激酶外结构域的脱落在PDAC-TME中提供了一个细胞间信号调控的另一个维度。更重要的是,脱落的AXL水平与淋巴结转移有潜在的相关性,而抑制AXL脱落及其激酶活性在抑制癌细胞生长方面表现出显著的协同作用。
总的来说,这项发表于 Nature 的研究描绘了由分泌配体和PM受体介导的PDAC中PCC和间质细胞之间的细胞间信号网络的全景图—— TMEPro 。TMEPro整合了具有时空分辨率的多维蛋白质组信息,全面描述了PDAC患者和基因工程小鼠PDAC模型中PCC和基质细胞之间的功能相互作用,为PDAC的科学研究、预防诊断和临床治疗提供了极具价值的全面资源。
1. https://doi.org/10.3322/caac.21834
2. https://doi.org/10.3322/caac.21660
3. https://www.nature.com/articles/s41586-024-08225-y
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/11/20/Nature%EF%BC%9A%E6%88%91%E5%9B%BD%E5%AD%A6%E8%80%85%E5%BC%80%E5%8F%91%E9%80%9A%E7%94%A8%E7%9A%84%E4%B8%B4%E5%BA%8A%E5%8A%9F%E8%83%BD/
THE END