Cell子刊:复旦大学迟喻丹团队等破解胶质瘤引发癫痫的隐秘链路

编辑丨王多鱼
排版丨水成文
胶质瘤 ,作为中枢神经系统最为常见的原发性恶性脑肿瘤,占据了该类肿瘤80%的比例,其中 胶质母细胞瘤 (GBM) 以其高度恶性、侵袭性和短暂的生存期,成为医学界亟待攻克的重大挑战。GBM的中位生存期仅为12-14个月,约10%至30%的患者在早期便会伴发癫痫症状,这些症状不仅严重影响患者的生活质量,还进一步加剧了治疗难度。GBM的高度异质性和与癫痫活动之间复杂而未知的关系,不仅使其病理机制的深入理解变得异常困难,也极大地阻碍了有效治疗方案的研发。因此,探究GBM与癫痫发生之间的内在联系,成为提升患者生存质量并推动治疗创新的关键任务。
2024年11月11日,复旦大学脑科学转化研究院 迟喻丹 研究员、 舒友生 教授,华山医院 秦智勇 教授及华东师范大学 田阳 教授团队合作,在 Cell 子刊 Neuron 上发表了题为: Potassium Ion Channel Modulation at Cancer-Neural Interface Enhances Neuronal Excitability in Epileptogenic Glioblastoma Multiforme 的研究论文。
该研究 不仅首次揭示了致痫性胶质瘤中肿瘤与神经元的复杂相互作用机制,还为癌症与神经科学的交叉研究提供了全新的视角,更在癌症基础转化研究领域迈出了重要的一步。

为了深入探讨胶质瘤与癫痫之间的关联,研究团队首先对806名 胶质母细胞瘤 (GBM) 患者进行了详细的临床分析,其中700例为无癫痫发作史的GBM患者,另外106例患者则以癫痫作为首发症状。通过对这些患者的脑部发病区域和病理特征进行深入梳理,研究团队发现,额叶区域不仅是GBM的高发地带,而且该区域的皮层受累程度较为显著。
为了验证这一临床发现,研究团队进一步建立了基于患者样本的异种移植模型 (PDX) ,该模型成功模拟了临床患者的病理特征,并通过对小鼠皮层局部场电位的分析,发现神经元的同步性显著增强,并观察到癫痫发作间期样事件的频繁出现 (图1) 。这些实验结果有效支持了临床观察,进一步表明肿瘤内在特征的差异是引发癫痫发作的潜在机制。
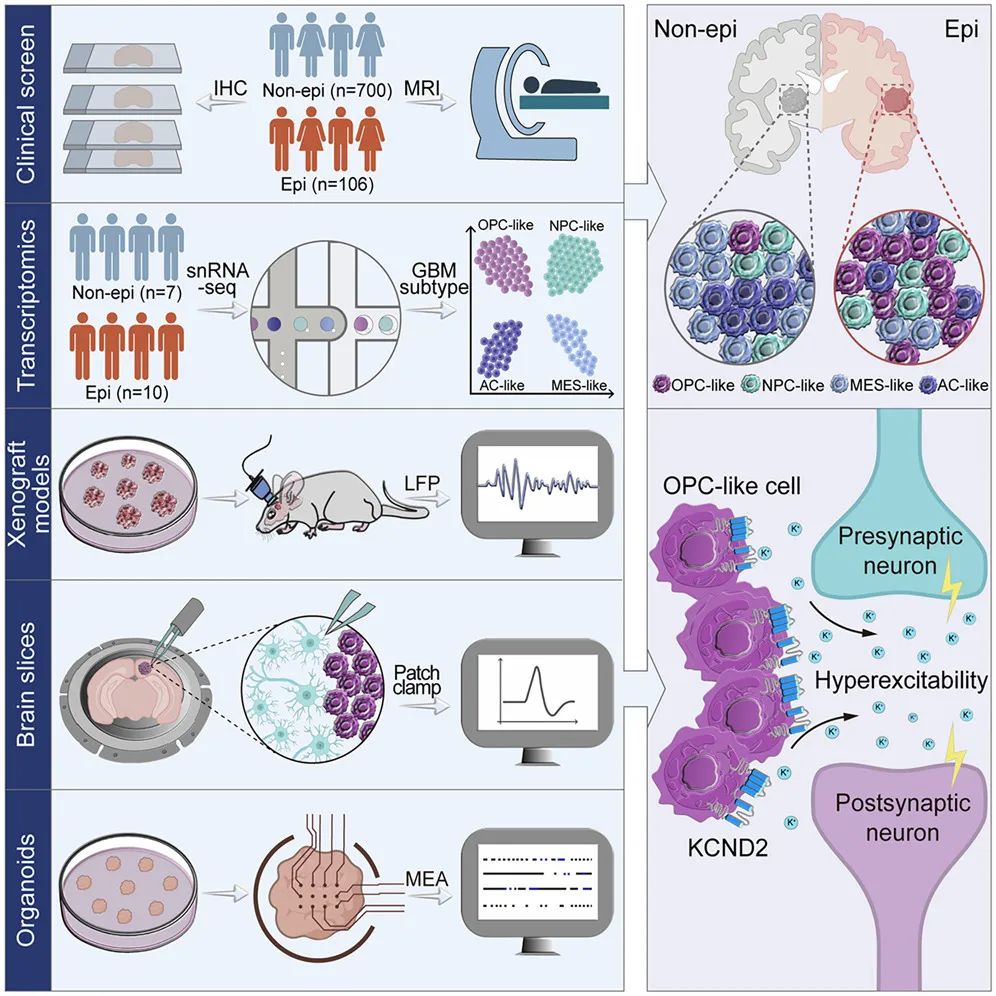
图1. 致痫性胶质瘤的临床发现与研究思路
研究团队随后采用了单细胞测序技术,对GBM患者肿瘤组织进行了深入分析。通过比较无癫痫发作与以癫痫为首发症状的患者的肿瘤细胞群体,研究发现肿瘤细胞在恶性转化过程中向祖细胞样亚型发生了转变,尤其是在肿瘤的边缘区域,OPC样细胞 (少突胶质前体细胞) 明显富集。对OPC样细胞异种移植模型小鼠的局部场电位 (LFP) 监测和全细胞膜片钳记录进一步发现这一变化与瘤周神经元网络活动的异常增强以及癫痫样活动的频繁出现密切相关。
研究发现,肿瘤与神经元之间的通讯受离子稳态失衡的显著影响,尤其是在致痫性GBM患者中,钾离子通道KCND2的异常高表达及其空间分布变化显著增强了肿瘤边缘神经元的兴奋性。这一发现揭示了钾离子通道在肿瘤-神经界面中的关键作用,并为癫痫治疗提供了新的潜在靶点。通过构建患者来源的异种移植模型和类器官模型,研究团队进一步验证了KCND2在肿瘤与神经元相互作用中的重要作用,揭示了肿瘤-神经串扰过程中通过钾离子通道调节神经元兴奋性的全新机制 (图2) 。
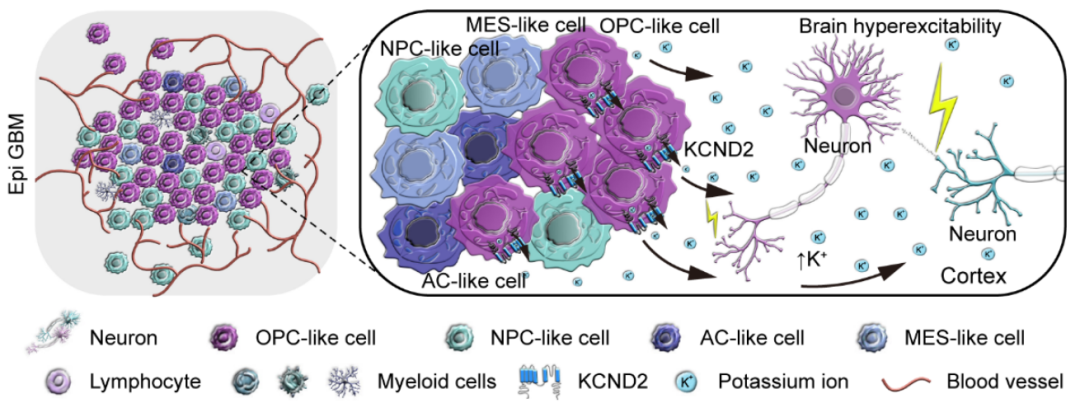
图2. 肿瘤边界与神经系统之间的关键链路
该研究 不仅为揭示胶质瘤与癫痫之间的复杂关系提供了新的机制理解,也为未来针对GBM及其癫痫症状的治疗方案提供了理论基础。 通过深入探讨钾离子通道在肿瘤-神经界面中的作用,研究团队为未来的药物研发和临床干预提供了新的研究方向和潜在靶点。
复旦大学脑科学转化研究院 迟喻丹 研究员、 舒友生 教授,华山医院 秦智勇 教授及华东师范大学 田阳 教授为论文通讯作者。 复旦大学 脑科学转化研究院博士生 张叶 、 段威 ,华山医院 陈灵朝 医生和 陈峻叡 医生为论文共同第一作者。 复旦大学 脑科学转化研究院邱志欣研究员、邵志成研究员、徐伟、范琪、华东师范大学刘原东、王诗迪为该论文做出了重要贡献。
迟喻丹课题组长期招聘博士后和研究生 ,致力于癌症基础转化研究,采用单细胞转录组学、空间转录组学、代谢组学、蛋白组学等多组学技术,结合临床前动物模型,探索靶向药物与免疫治疗的联合策略。课题组欢迎对肿瘤学、神经生物学、免疫学及相关领域有浓厚兴趣的优秀人才以博士后、研究生、工作人员等身份加入我们的团队。感兴趣的候选人请将个人简历及相关材料发送至chiy@fudan.edu.cn。期待与您共同携手,为提升癌症患者的精准治疗贡献力量,共同开创基础与临床研究相结合的新未来。
论文链接 :
链接:http://www.lewenyixue.com/2024/11/13/Cell%E5%AD%90%E5%88%8A%EF%BC%9A%E5%A4%8D%E6%97%A6%E5%A4%A7%E5%AD%A6%E8%BF%9F%E5%96%BB%E4%B8%B9%E5%9B%A2%E9%98%9F%E7%AD%89%E7%A0%B4%E8%A7%A3%E8%83%B6/