【Blood】综述:T细胞和NK细胞淋巴瘤的诊断和分类
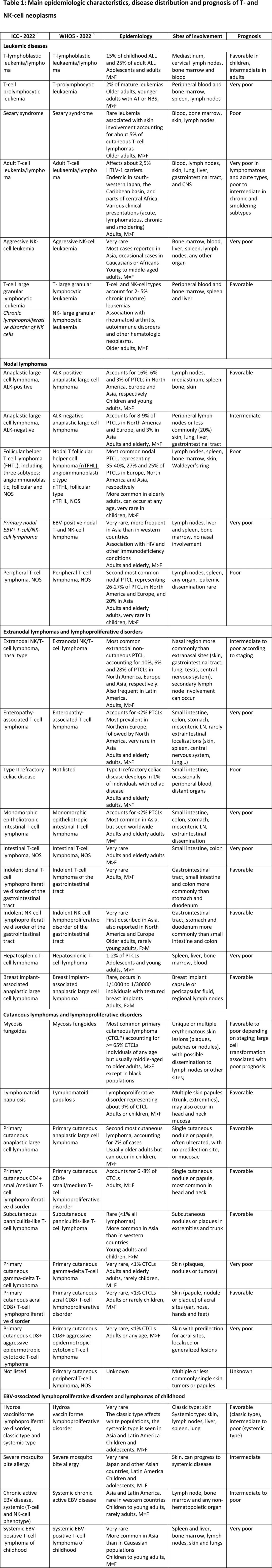
T 细胞淋巴瘤是一个通用术语,含T 细胞和NK细胞系免疫细胞的恶性肿瘤,包括不成熟 T 细胞的肿瘤(即 T 淋巴母细胞淋巴瘤/白血病)及成熟 T 和 NK 细胞的恶性肿瘤,后者通常称为“外周”或“成熟”T细胞淋巴瘤 (PTCL)。2022年ICC和WHO分类(第5版)整合了血液学、免疫学、病理学和遗传学最新信息,分为超过30种T/NK 细胞源性肿瘤(表1)。
在生理条件下,人体免疫系统比 B 细胞含有更多的 T 细胞,一般而言组织中的反应性淋巴浸润往往含有高比例的 T 细胞。虽然大多数淋巴母细胞淋巴瘤起源于 T 前体细胞(85-90%的病例),但PTCL仅占非霍奇金淋巴瘤的不到15%,且发生率和相对患病率存在显著的地理差异。尽管罕见,但 PTCL 在生物学和临床上具有多样性,可能存在于淋巴结、皮肤或各种结外器官中,或仅累及血液和骨髓。
大多数 PTCL 临床呈侵袭性,采用B 细胞淋巴瘤的治疗方法通常具有挑战性,但也有部分以 T 细胞或 NK 细胞克隆性扩增为特征的罕见疾病并不完全符合恶性肿瘤的病理学标准,并且遵循慢性或惰性临床病程,称为“淋巴增殖性疾病”(LPD),以便将其与更具侵袭性的 PTCL 区分开来。
T/NK细胞淋巴瘤的准确诊断对临床管理至关重要,多依赖于组织活检。由于组织学表现可能具有异质性,并与许多良性淋巴增殖和 B 细胞淋巴瘤重叠,因此诊断通常具有挑战性。疾病位置、形态学和免疫表型仍是指导诊断的主要特征,通常辅以包括克隆性和高通量测序突变检测在内的遗传学分析。
鉴于 T 细胞肿瘤的临床和生物学多样性以及复杂性,正确的诊断和精确的分类对于准确预测和有效治疗至关重要。《Blood》近期发表综述,在当前概念和科学知识的背景下,对 T 细胞淋巴瘤的分类和诊断进行了全面概述。现翻译全文供参考,水平有限如有错误敬请谅解,如需原文请联系zhaolongfei169。

T细胞和NK细胞肿瘤的分类
30年前Blood发表的修订版欧美分类 (Revised European-American Classification,REAL)奠定了淋巴肿瘤分类的现代原则,这些原则结合临床特征、病因学、起源细胞、形态学、表型和遗传学特征来识别“真实的”临床病理学亚型。定义具体淋巴瘤亚型的特征之间差异很大,但几乎所有亚型的诊断都需要多个特征来定义。虽然很少有病原被确认,但有许多预先存在的状态容易导致T细胞和NK细胞肿瘤,包括影响正常细胞功能(DNA修复机制,转录调节,免疫反应)的胚系突变,以及获得性突变(表2)。
自2001年以来,REAL分类概念的发展一直是WHO血液淋巴系统肿瘤分类的基础。直到2022年,WHO专著 (Blue Books) 一直是病理学家、临床医生和科学家使用的主要国际标准。但在2022年对2017年 WHO 分类发布了两项单独的更新,即ICC和WHO第五版,它们在 T/NK 细胞肿瘤遵循相同的原则,并提供整合临床、病理学和遗传学特征方面最新知识的综合框架,并形成本综述进一步讨论的基础。这两种分类在很大程度上相似,但也存在一些微小和显著差异(表1)。因此,专业协会建议在血液病理学诊断实践中诊断 T 细胞和 NK 细胞肿瘤时平行报告两个术语。
T细胞和NK细胞肿瘤的起源细胞
“细胞起源”是许多 T 细胞和 NK 细胞肿瘤的基本属性和定义性特征,定义为基于表型和基因表达谱的肿瘤性 T 细胞或 NK 细胞的生理对应物。在分类方案中,第一个主要分歧发生在未成熟(前体)和成熟(外周)T细胞肿瘤的分离中。基于细胞起源,在“T淋巴母细胞淋巴瘤/白血病”下可识别两个不同亚型:一个显示早期 T 细胞前体 (ETP) 表型,对应于从骨髓迁移至胸腺的最早可识别的 T 细胞前体,另一个更具有异质性,表型特征与分化的胸腺细胞相似。成熟 T 细胞和 NK 细胞肿瘤可以根据细胞起源(固有[innate]或适应性[adaptive]免疫细胞 ) 分为两组。
固有型肿瘤包括来源于 NK 细胞或非常规 T 细胞( γ-δT细胞、α-βNKT细胞或粘膜相关恒定 T 细胞) 的肿瘤。γ-δT细胞(CD4-CD8-或CD4-CD8 +)占 T 细胞的<5%,优先分布于皮肤、粘膜和脾脏红髓。因此,来源于固有细胞的淋巴瘤倾向于发生在皮肤(原发性皮肤γδT细胞淋巴瘤)、粘膜(原发性肠道 T 细胞淋巴瘤、结外 NK/T 细胞淋巴瘤[ENKTCL])和脾脏(肝脾 T 细胞淋巴瘤[HSTL])。固有型 PTCL 通常具有细胞毒性表型,呈临床侵袭性。部分亚型由特定的细胞起源定义,例如原发性皮肤γδT细胞淋巴瘤,而其他亚型(如HSTL)在精准细胞系方面表现出多样性,可能反映出归巢的重要性和离散性固有细胞亚群共有的功能特性。
来源于适应性免疫系统的淋巴瘤则更普遍,起源于淋巴结(大多数适应性免疫的免疫细胞驻留在淋巴结)。适应性免疫应答的特征为激活诱导的初始 T 细胞分化为抗原特异性效应 T 细胞和记忆 T 细胞,这些 T 细胞表达 T 细胞受体 (TCR) α-β,并识别 MHC I 类或 II 类分子背景下的抗原。在功能上它们分为两类:主要具有辅助功能的 CD4 阳性 T 细胞和主要具有细胞毒性功能的 CD8 阳性细胞。激活后CD4+ 辅助性 T 细胞可分化为各种功能亚型,如Th1、Th2、Th17、调节性 (Treg) 或滤泡辅助性 T 细胞 (TFH),T细胞淋巴瘤可能起源于这些不同的功能亚型中的每一种。根据细胞起源定义的最明确的疾病亚型为滤泡辅助性 T 细胞淋巴瘤 (TFHL),TFHL有几种组织学亚型,但均具有正常 TFH 细胞的共同基因表达特征和表型。同样,初步数据表明,PTCL 非特指型亚群 (PTCL-NOS) 具有类似于正常 Th1 或 Th2 细胞的分子学特征,表明其细胞来源为 Th1 或 Th2 功能亚群。
采样和诊断工具
T 细胞和 NK 细胞肿瘤的诊断和监测仍是病理学中最具挑战性的领域之一。根据临床表现,通常需要检查来自不同来源的多个诊断性生物样本,如淋巴结、外周血、骨髓、其他结外部位以及脑脊液或其他体液。对于组织病变,手术活检是首选方法,可进行充分的组织病理学评估和额外辅助技术评估。手术切除活检不实用时可以使用侵入性较小的粗针(core needle)或小活检(small-volume biopsies),但与手术切除活检相比其灵敏度和特异性较低。粗针活检辅以细针穿刺(fine needle aspiration)活检进行流式细胞分析可满足初始管理的需要。重要的是,需要多个粗针以采集足够的材料用于辅助检测,并获得足够的存档生物样本用于未来的需要,例如临床试验入组。疑似 PTCL 复发的患者应考虑进行再活检,因为其可能显示不同谱系(B细胞甚至髓系)的增殖,或具有不同临床意义的各种反应性或感染过程。非典型形态、异常 T 细胞表型和/或克隆性证据可提示 NK-或 T 细胞淋巴细胞增多(血液或体液中)的肿瘤性质或组织浸润。
组织学和细胞学
诊断的主要手段仍是对涂片或组织切片进行形态学评价,以建立鉴别诊断,并对生物样本进行分诊,用于下游免疫表型分析和遗传学检测。
免疫表型分析
免疫表型分析对于评估 T 细胞和 NK 细胞肿瘤至关重要,用于免疫表型分析的两种主要临床方法为多参数流式细胞术 (MFC) 和免疫组化。MFC可实现单细胞分辨率,能够在短时间内评估同一细胞和大量细胞上的多个标志物;但对新鲜组织的要求和组织结构的丧失限制了其使用,因此主要用于液体标本,但如果结合组织学检查也可以获得有价值的信息。而免疫组化适用于福尔马林固定石蜡包埋的组织,除细胞表型外还可提供重要的结构信息。图1和表3总结了最常见亚型的表型和常用抗体。
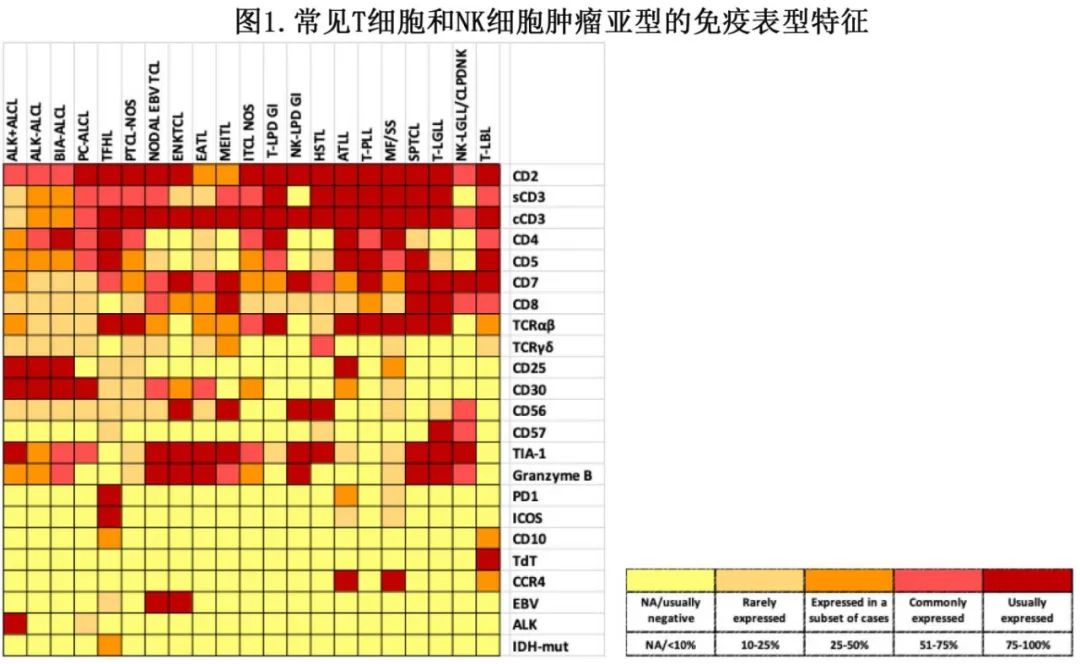
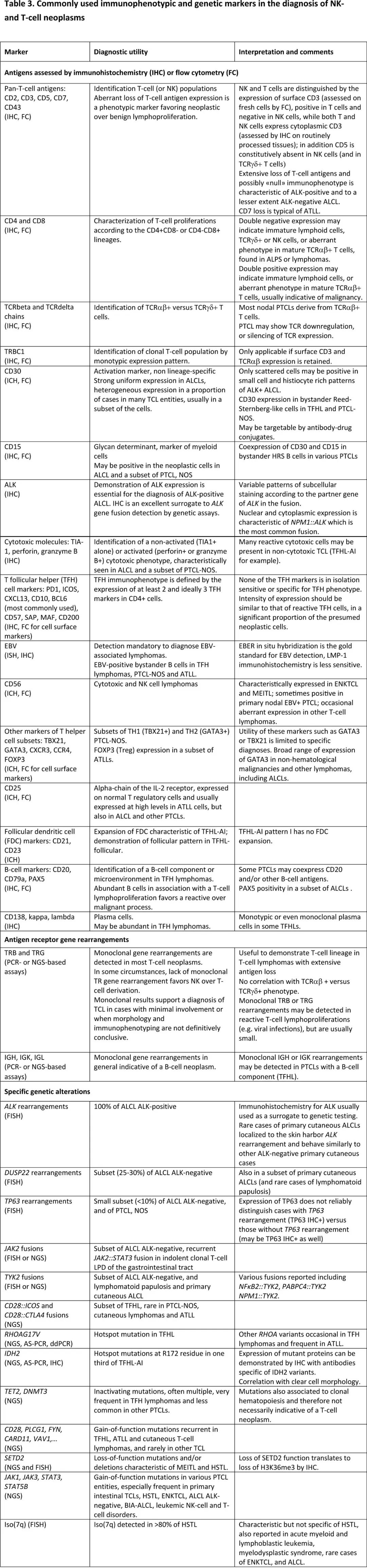
免疫表型分析可确定细胞谱系和分化、异常抗原表达(T细胞标志物的缺失或弱表达)、克隆性的表型替代物(单型 TRBC1 表达)或其他谱系标志物的异常共表达(例如CD20)、癌基因的异位表达,以及评估反映细胞进程和微环境的标志物。
分子遗传学检测
由于没有广泛可用的替代 IHC 方法来确定克隆性,因此 TR 基因座重排评估是诊断 T 细胞增殖的重要辅助技术,以便区分肿瘤过程和许多反应性模拟物。流式细胞仪单型 TRBC1 表达分析现已广泛应用于常规诊断实验室,主要用于血液、骨髓和其他液体样本,但由于肿瘤细胞含量较低而阻碍了其在组织穿刺中的应用;此外其应用仅限于 TCRαβ+细胞群,因此不适用于 sCD3 阴性或 TCRγδ+增殖。在许多情况下可通过 PCR 和高通量测序 (HTS) 分析进行克隆性检测以确诊PTCL 或 T 细胞 LPD。虽然基于 TR 的克隆方法总体上较为灵敏,但也可能在反应性环境下产生假阳性结果。具体而言,在解释小克隆时需要谨慎,分析通常应一式两份运行,以确认重现性。与之不同,检测特定致病性突变的超灵敏方法可能对克隆性更敏感和更特异。
大多数成熟 T 细胞肿瘤的特征为基因组复杂,只有罕见亚型携带疾病定义性或高度复发性基因改变,例如ALK+ ALCL、T-PLL;其余亚型与影响各种细胞通路的各种突变相关,包括表观遗传学、TCR和细胞因子信号通路、免疫生物学和细胞周期基因及其他(图2)。
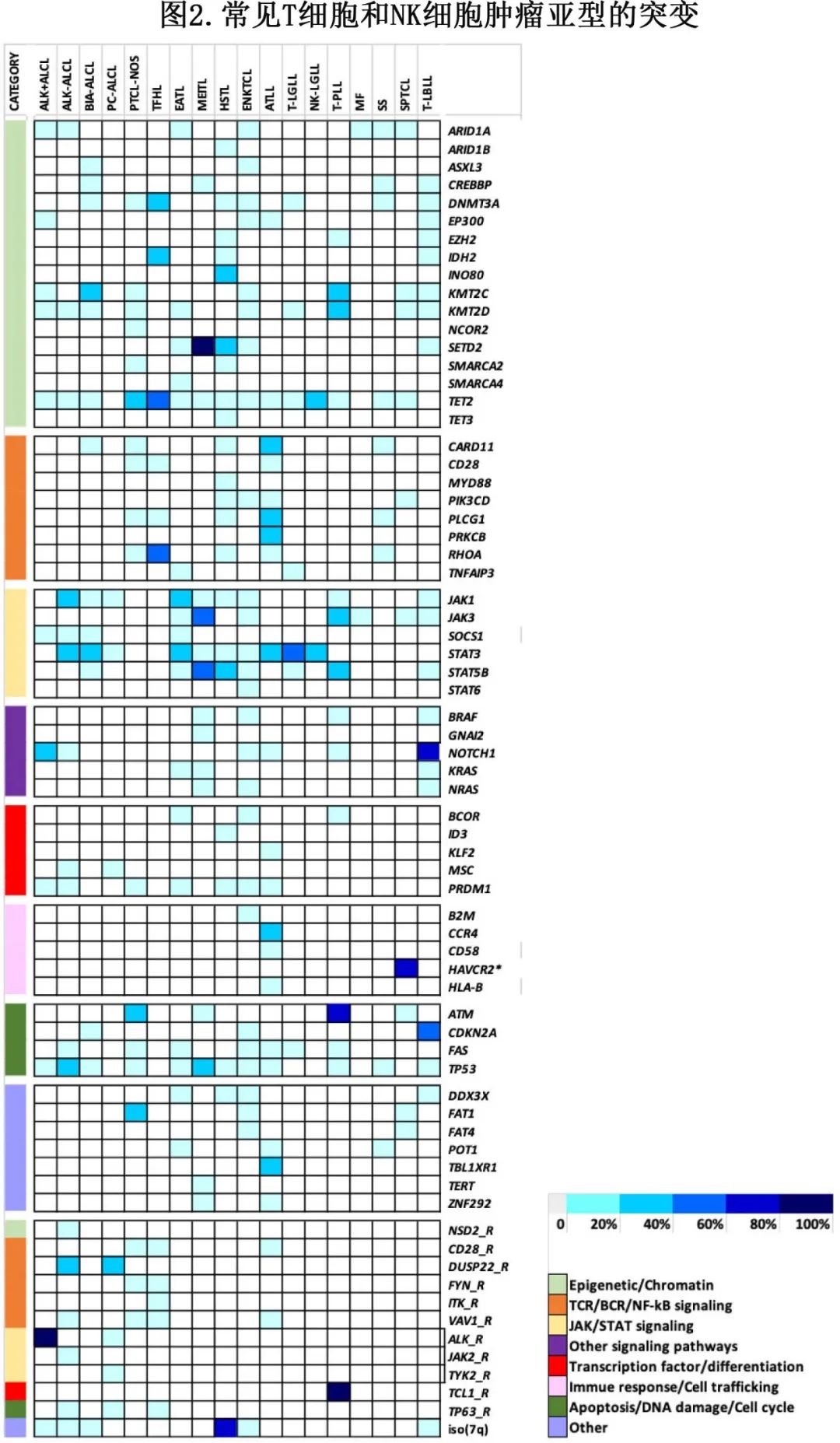
FISH 可评估最常见的基因重排或融合以及特定拷贝数变异。基因变异(点突变或小插入缺失)的检测可能依赖于某些热点的靶向检测,但更常通过高通量测序(HTS)panel得到实现(表3)。HTS数据除了提供诊断信息外(特别是对于具有常见热点突变相关的亚型或基因改变的组合,即FHTL、T和NK大颗粒淋巴细胞增殖、肠T细胞淋巴瘤),还可产生与治疗决策相关的信息,因为许多 PTCL 相关基因病变适合靶向干预。应注意的是,假定的 PTCL 中的 HTS 需要较高的测序深度和充分的过滤,以识别等位基因频率较低 (1-2%) 的变体,因为肿瘤细胞的比例通常较低。此外,必须谨慎解释经常发现的 TET2 和 DNMT3A 突变,其可能部分反映出潜在的克隆性造血。
基于 RNA 的基因表达谱 (GEP) 在确定基于 PTCL 分子亚型的特征(反映离散 T 细胞亚群和微环境的生物学)方面发挥重要作用。广泛的 GEP 方法尚未广泛转化为诊断实践,但新的简化测定法正在开发中,可能提供临床实用性。
新出现的数据表明,血浆循环肿瘤 DNA(ctDNA) 分析(定量、靶向测序或甲基化分析)也是有价值的生物标志物,可用于PTCL 患者诊断预测、评估治疗前负荷和治疗反应以及早期检测复发。
确诊的实用方法
T 肿瘤和 NK 肿瘤的诊断通常需要了解宿主背景、临床表现和实验室检查结果以及病理学特征。可能指导诊断的宿主因素包括罕见的遗传因素和其他易患特定疾病的风险因素(表2)。有的情况下,特征性的临床表现(如自身免疫、播散性淋巴结肿大、皮疹及 TFH 淋巴瘤所见的 B 症状等)也可能有助于指导诊断。其他疾病(如噬血细胞性淋巴组织细胞增生症)的特异性较低,但可能代表少数 PTCL 患者的表现体征。然而对于大多数PTCL病例,其诊断是基于(因怀疑血液疾病、恶性肿瘤或其他全身性疾病而进行的)淋巴结、骨髓或结外组织活检的病理学检查,或作为“偶发”的诊断结果。对于皮肤 T 细胞肿瘤,临床表现和大体外观非常典型,因此可以做出临床诊断。
在大多数情况下,PTCL的确诊需要根据宿主因素和临床特征整合病理结果。重要的临床特征包括年龄和性别、种族、既往病史和共存疾病(遗传倾向、免疫抑制、自身免疫性疾病)、(慢性)感染(例如EBV、HIV)或受累部位和程度以及相关症状。对来自流行地区的患者应进行HTLV-1血清学检测,并建议对确诊的PTCL患者(特别是PTCL-NOS患者)进行HTLV-1血清学检测。基于临床病理的诊断见后文。表1总结了T细胞肿瘤的皮肤表现,不再进一步讨论。
CD30阳性间变性大细胞和T细胞淋巴瘤
间变性 大 细胞(包括 CD30 强且均一染色的所谓“标志性细胞”)的团聚性生长是 ALCL 的明确特征。两种系统性 ALCL 定义为存在或不存在 ALK 表达,通常表现为淋巴结肿大,但主要累及任何结外组织;另外两种 ALCL 类型根据其在皮肤或乳房假体附近的表现来定义。除 ALK 阳性 ALCL 的罕见变体外,形态学常明显为恶性,核分裂丰富,有时坏死。在淋巴结中,肝窦受累具有特征性,但并不总是存在,可能酷似转移癌或黑色素瘤。图3所示的诊断工作流程考虑了由大的间变性CD30+ 细胞组成的淋巴瘤以及具有更多异质性 CD30 表达的 T 细胞淋巴瘤,也需要 ALK 检测,因为它们可能是 ALK 阳性 ALCL 的变体。

ALCL的鉴别诊断包括形态和/或免疫表型重叠的几种淋巴瘤亚型,包括 EBV 阳性 T 或 NK 细胞淋巴瘤、肠病相关 T 细胞淋巴瘤、转化型蕈样肉芽肿和PTCL-NOS。ALK阴性 ALCL 和 PTCL-NOS 之间的边界仍然模糊且有所变动,但其区别在临床上很重要,因为CD30+ PTCL-NOS的预后似乎劣于 ALK 阴性 ALCL。最近在共表达 CD30 和 CD15 的 PTCL 中发现的复发性 JAK2 融合表明,应在 ALK 阴性 ALCL 谱中考虑这些病例,而不是像最初提出的那样直接归类为PTCL-NOS。携带 DUSP22 重排的 ALK 阴性ALCL(25-30%的病例)在生物学上不同于缺乏 DUSP22 重排的ALCL,因其通常缺乏 STAT3 活化,强烈表达LEF-1,较少表达细胞毒性分子,并具有独特的转录组学和甲基化特征。然而DUSP22状态的预后价值更有争议。DUSP22-R的存在无法区分全身性和原发性皮肤病例,但可排除BIA-ALCL。其他涉及TP63、VAV1、JAK2、TYK2的重排不太常见,也并非ALK阴性ALCL特有,但在某些情况下可能可有用。
T/NK细胞增殖累及淋巴结
淋巴结肿大是 PTCL 的最常见表现,主要结内亚型为ALCL(上文讨论)、TFH淋巴瘤、原发性淋巴结EBV+ T细胞或 NK 细胞淋巴瘤以及PTCL-NOS(表1)。形态谱分布较宽(图4,下文讨论)。此外,T淋巴母细胞或成熟白血病(尤其是 ATLL 和T-PLL)或皮肤或结外 NK/T 细胞肿瘤也可能累及淋巴结。建议对所有 PTCL 病例进行 EBV 检测。
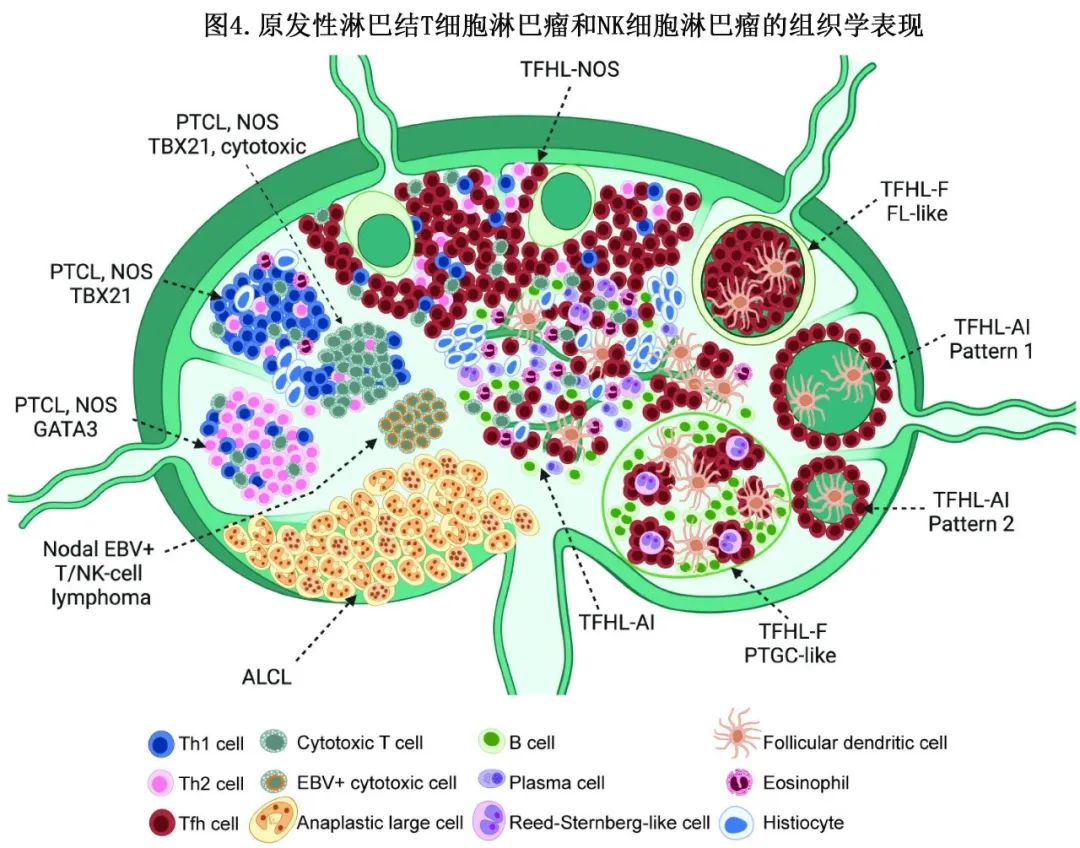
当考虑由非典型小/中等大小 T 细胞群组成的 PTCL 时,必须排除淋巴母细胞增殖,尤其是如果细胞为母细胞样或观察到有丝分裂率较高。通过IHC显示,未成熟 T 细胞表达TdT(末端脱氧核苷酸转移酶)和不同的细胞表面 T 细胞抗原,如 CD4 和 CD8 双阳性或双阴性表达。鉴别诊断包括多克隆 TdT 阳性 T 淋巴母细胞的惰性 T 淋巴母细胞增生,其可能与各种良性或恶性疾病相关。另一种可能被误解为 T 淋巴母细胞淋巴瘤或 PTCL 的良性疾病为自身免疫性淋巴增生综合征 (ALPS),通常见于婴儿或儿童;ALPS显示组织和血液中双阴性 CD4-CD8-细胞毒性 T 细胞扩增。另一个值得注意的陷阱为Kikuchi-Fujimoto病,一种年轻成人女性疾病,表现为颈部淋巴结肿大、全身症状和自身免疫表现;淋巴结包括大量CD8+细胞毒性T细胞浸润坏死性淋巴组织细胞,可能与 PTCL 混淆。
与嗜酸性粒细胞、组织细胞(有时伴微肉芽肿)、B细胞和浆细胞混合的多形 T 细胞浸润是鉴别诊断中最具挑战性的情况之一,包括各种良性疾病。包括药物诱导的接种后反应或病毒感染,如传染性单核细胞增多症,可能包括非典型CD8+细胞并携带寡或单克隆 TR 基因重排。血管免疫母细胞型滤泡辅助性 T 细胞淋巴瘤(TFHL-AI或AITL)是典型亚型,表现为肿瘤CD4+ T细胞和各种反应性细胞的多形浸润,背景为明显的分枝血管和滤泡树突状细胞增殖,可通过 CD21 或 CD23 免疫染色突出显示。TFH标记物(BCL6、CD10、PD1、ICOS和CXCL13)的免疫组化在这种情况下有助于确诊。此外还需要检测TFH标志物,以确定肿瘤细胞分布在生发中心或退行性滤泡周围的TFHL-AI不常见的模式,以及TFHL-NOS和滤泡的其他亚型。在某些情况下,TFHL-AI早期受累的肿瘤细胞负荷非常低,即使进行免疫染色也可能难以识别。在这些情况下,流式细胞分析和活检分子学检测是诊断的有用辅助手段,尤其是 RHOA Gly17Val 突变分析在 TFHL-AI 的早期检测中很有价值。在约60%的 TFHL-AI 患者中发生的这种热点突变对 TFHL 具有相当的特异性,而 TET2 和 DNMT3A 突变不仅在 TFHL 中也在PTCL-NOS中非常普遍,可能反映潜在的克隆性造血。此外,外周血流式细胞分析也可检测大多数 TFHL 患者中共表达 CD10 或 ICOS 的异常CD4+ T细胞,即使是淋巴细胞减少。TFHL-NOS是一种CD4+ PTCL,不包含典型的TFHL-AI 微环境,但表达 TFH 表型,表现为表达至少两个(理想情况下是三个)TFH标志物。在 TFHL 的滤泡亚型中,该模式可能类似于滤泡性淋巴瘤,或生发中心进行性转化,肿瘤性 T 细胞通常强烈表达多种 TFH 标志物。TFHL亚型的共同特征在于经常存在形态异质性,且通常为 EBV 阳性和克隆性 B 细胞和浆细胞增殖,包括表达CD30 和 Reed-Sternberg 细胞的再结合。这种 B 细胞增殖可能与 B 细胞淋巴瘤或结节性淋巴细胞为主型霍奇金淋巴瘤相混淆。在疑难病例中,诊断可能需要使用B细胞和T细胞克隆试验或突变分析。淋巴上皮样 PTCL 是上皮样组织细胞中含量较高的 PTCL 的形态学描述,呈弥漫性或皮质旁生长模式,可能对应于 TFHL 或PTCL-NOS。
一旦排除其他 PTCL 亚型(包括结外 PTCL 亚型和 T 细胞白血病),则PTCL-NOS是排除诊断。从本质上讲,它在生物学和临床上是异质性的。两种分子亚型(即TBX21-PTCL-NOS/Th1和GATA-3-PTCL-NOS/Th2)由 GEP 定义,具有不同水平的基因组复杂性(GATA-3 亚型中较高,以TP53、CDKN2A/B或 RB1 的双等位基因缺失/突变为特征)和预后(PTCL-TBX21亚型较好)。除 CD4 阳性表型外,TBX21-PTCL-NOS/Th1亚型还包含活化CD8+ T细胞毒性特征伴 DNMT3A 突变且预后劣于 DNMT3A-WT TBX21-PTCL-NOS的独特病例子集。可通过使用4种标志物(TBX21、CXCR3、GATA-3和CCR4)的免疫组化算法和基于纳米字符串的分析重现分子亚型。但这些结果需要在更大的队列中得到证实,且目前 ICC 和 WHO 分类在常规临床实践中均不需要对 PTCL-NOS进行分子分型。
NK/T细胞肿瘤的结外表现
结外亚型(表1)最好在解剖学表现的背景下进行讨论。鼻型结外 NK/T 细胞淋巴瘤通常发生于成人的鼻区,以男性为主,但可见于任何其他结外器官,包括皮肤和软组织,甚至脑。根据定义,肿瘤必须为 EBV 阳性。而BIA-ALCL仅发生于假体包膜周围的乳腺。其他特定亚型包括胃肠道中的 T 细胞和 NK 细胞淋巴增殖以及肝脾 T 细胞淋巴瘤 (HSTL)。
胃肠道中的T细胞和NK细胞淋巴增殖
胃肠道是仅次于皮肤的第二常见结外部位,可涉及 T/NK 细胞肿瘤,总结见图5。
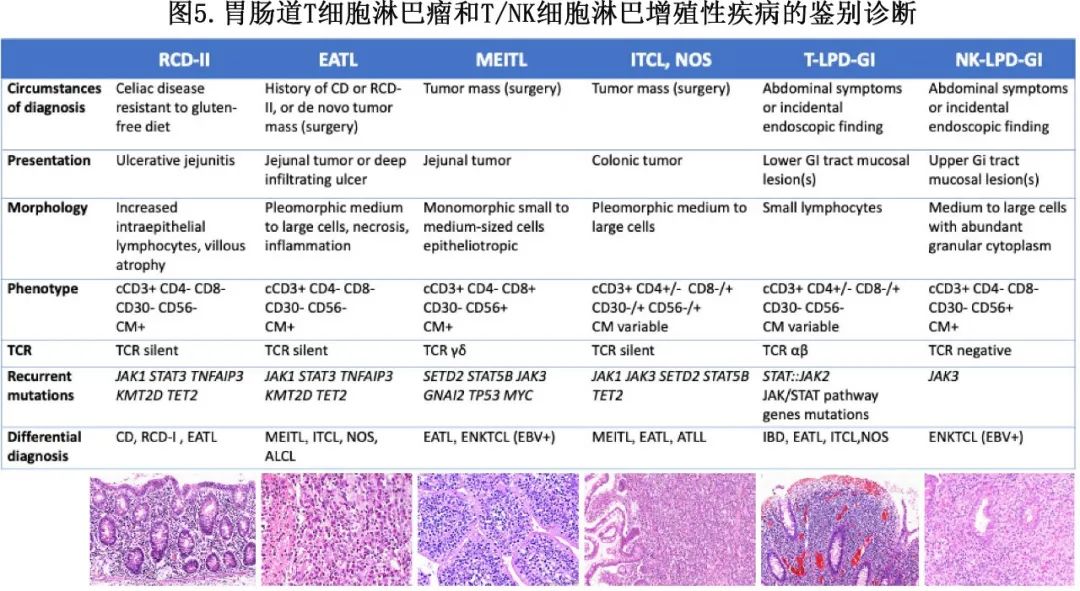
肠病相关T细胞淋巴瘤 (EATL) 和单形嗜上皮性肠T细胞淋巴瘤 (MEITL)是两种主要的原发性肠道 PTCL 亚型,它们常在因淋巴瘤肿块引起的穿孔或梗阻而行手术切除时被诊断。EATL 和 MEITL 具有独特的流行病学、形态学、免疫表型和突变模式,尤其是在 EATL 中常见的 SETD2 突变。肠道 T 细胞淋巴瘤-NOS罕见,适用于不符合 EATL 或 MEITL 的侵袭性肿瘤、II型难治性乳糜泻和胃肠道 T/NK 细胞LPD,表现为消化系统或腹部症状,通常通过内镜粘膜活检确诊。RCD-II是一种原位肿瘤/异常IEL的上皮内增生,表现为异常免疫表型(sCD3或CD8或TCR表达缺失),伴有单克隆TR基因重排和JAK1或STAT3突变。在胃肠道惰性克隆性T细胞LPD中,粘膜包含小型单一淋巴样细胞弥漫性浸润;浸润可能含有表型异常的 T 细胞,但需要在基因组水平证明克隆性来证实诊断。该情况也命名为“胃肠道惰性 T 细胞淋巴瘤”,通常遵循慢性和复发过程,但罕见病例可转化为侵袭性PTCL。来源于 NK 细胞的类似的胃肠道惰性 LPD在形态学上更不典型,根据定义应为 EBV 阴性,而与ENKTCL不同(ENKTCL可能累及胃肠道)。在与原发性肠道疾病的鉴别诊断中需要考虑的其他 T/NK 细胞肿瘤亚型包括ATLL、ALCL和慢性活动性 EBV 疾病。
肝脾T 细胞淋巴瘤
HSTL的表现可能酷似炎性全身性疾病伴 B 症状、脾肿大而无明显肿瘤综合征或淋巴结肿大。HSTL患者在诊断时缺乏白血病细胞,但表现为血细胞减少,尤其是血小板减少和贫血。由于很少进行脾切除术,通常通过骨髓活检或肝活检来确诊,显示仅有中等大小的淋巴细胞浸润窦内,具有CD3 +、CD5-、CD4-/CD8-、CD56 + 表型和TIA1 +/GranzymeB-/穿孔素-非活化细胞毒性特征。肿瘤性 T 细胞通常表达γδT细胞受体,很少表达αβ表型。HSTL的特征为在大多数情况下为等臂染色体7q,SETD2 和 STAT5B 常突变。
外周血和骨髓受累
在存在淋巴细胞增多的情况下,需要通过形态学、MFC免疫表型、染色体分析或分子遗传学分析检查血涂片和/或骨髓,以确定 T 细胞肿瘤。常见的白血病 T 细胞和 NK 细胞肿瘤包括 T 细胞前淋巴细胞白血病 (T-PLL)、Sézary综合征 (SS)、成人 T 细胞淋巴细胞白血病 (ATLL)、侵袭性 NK 细胞白血病 (ANKL)、T细胞大颗粒淋巴细胞白血病 (T-LGLL)(图6)。

此外,罕见的PTCL(如ALCL ALK + 和TFHL)可能在就诊时或疾病过程中发生白血病播散。T-PLL是一种罕见的成熟 T 细胞白血病,以明显的淋巴细胞增多、B症状、肝脾肿大为特征,25%的患者存在淋巴结或结外受累。其主要诊断标准包括淋巴细胞>5×10 9 /L伴T-PLL 表型,证实 T 细胞克隆性和 14q32 或 Xq28 异常,或表达 TCL1A/B 或 MTCP1。
Sézary综合征是一种侵袭性皮肤 T 细胞淋巴瘤,特征为红皮病、淋巴结肿大和循环非典型淋巴细胞(Sézary细胞高于1x10 9 /L),其诊断在很大程度上依赖于临床表现、血液中克隆性CD4+、CD7-(通常为KIR3DL2 + Sézary细胞)和皮肤活检组织病理学。
ATLL 起源于 HTLV-1 感染的克隆扩增 T 细胞,常表现为广泛的淋巴结肿大和外周血受累,有时伴皮肤和其他结外受累部位。ATLL肿瘤细胞在血涂片上称为“花细胞(flower cells)”,在组织切片中显示不同的形态,表达 CD4 和CD25,但缺乏CD7。ATLL的诊断可通过 HTLV-1 抗体的血清学检测证实,或者更具体地说,通过证明肿瘤细胞中前病毒 HTLV-1 DNA 的单克隆整合证实。
ANKL 是一种罕见的系统性 NK 细胞肿瘤,大多数病例与 EBV 相关,常见于亚洲种族的中青年,通常表现为肝脾肿大、B症状、血细胞减少噬血细胞综合征和不同程度的白血病扩散,呈暴发性病程。外周血和骨髓检查是最常见的诊断程序。
而T细胞大颗粒淋巴细胞白血病 (T-LGLL) 是一种慢性惰性疾病,常发生于患有自身免疫疾病的老年患者,可无症状或表现为血细胞减少、中度脾肿大和白血病。血液或骨髓涂片检查以及MFC显示,含嗜天青颗粒和活化细胞毒性表型(CD3+、CD8+、CD57+、TCRαβ+、CD56-)的淋巴细胞数量增加(0.5×10 9 /L)和克隆性 TR基因重排。在CD4 +、CD4-/CD8-或TCRγδ+ 表型的极少数情况下,证明 STAT3 或 STAT5B 突变或有助于诊断。具有相似特征但显示 NK 细胞表型的患者称为 NK-LGLL或慢性NK 细胞淋巴增殖性疾病。
未来方向和结论
在过去的二十年内,人们对 PTCL 的生物学和遗传学的认识有了重大进展,这些发现形成了现代分类的基础。基于新的生物学知识应用这些诊断范例可实现新的临床干预,如在 TFHL 中使用表观遗传学药物。然而总体而言,由于这些进展的转化医学存在挑战,精准治疗的发展一直受到限制。通过应用高分辨率基因组工具(如光学基因组图谱、WGS、ATAC-seq、ctDNA分析和单细胞表征方法)可以更广泛地了解肿瘤细胞(包括微环境)的表型、表观遗传学和遗传学特征,有望获得具有重要治疗应用的新见解。对此,希望下一代淋巴瘤分类可以提供一个整合所有新知识的统一平台,以推进患者治疗。
参考文献
Leval LD,Gaulard P, Dogan A.A practical approach to the modern diagnosis and classification of T-and NK-cell lymphomas.Blood . 2024 Oct 31;144(18):1855-1872. doi: 10.1182/blood.2023021786.
链接:http://www.lewenyixue.com/2024/11/12/%E3%80%90Blood%E3%80%91%E7%BB%BC%E8%BF%B0%EF%BC%9AT%E7%BB%86%E8%83%9E%E5%92%8CNK%E7%BB%86%E8%83%9E%E6%B7%8B%E5%B7%B4/