随着DNA测序和分析技术变得更加便捷且成本降低,这些技术逐渐被纳入常规肿瘤学实践。目前临床医生可以使用多种检测手段,而全基因组测序(Whole-Genome Sequencing, WGS)因为能够解析整个(可获取的)基因组中的各种变异类型,被认为是提供信息最全面的单一检测方法。
儿童肿瘤的治疗通常依赖于特定的基因特征,因此,WGS在儿童肿瘤学中的应用特别具有价值。此外,由于部分儿童肿瘤的基因基础尚未被充分探索,WGS也有更大几率发现具有临床价值的基因变异。即便在已有的标准护理(SOC)检测中使用了扩展的分子分析方法(如靶向DNA和RNA测序面板),WGS仍然能提供额外的关键信息。
尽管全基因组测序(WGS)在临床中的应用日益普及,但目前仍缺乏充分的证据支持其在儿童肿瘤学实践中的常规使用。已有的研究多集中于特定患者群体,例如高风险疾病的儿童。然而,这些研究主要探索了WGS的潜在益处,而其在实时临床护理中的实际影响尚未被充分评估。目前,尚不清楚将WGS整合到常规临床实践中,是否能为所有疑似肿瘤的儿童提供超出标准护理(SOC)分子检测的临床价值。
2024年5月,由 Sam Behjati 团队发表于 Nature Medicine 题为 Benefits for children with suspected cancer from routine whole-genome sequencing 的文章, 通过比观察性研究,揭示了WGS作为常规检测手段,不仅为检测整合提供了机会,还可以为实施基因指导的精准治疗创造了条件。

在本研究, Sam团队从英国两个三级儿童肿瘤中心(剑桥大学医院 CUH 和伦敦大奥蒙德街医院 GOSH)分别招募 130和152名儿童,分别覆盖了90% 和93%的患者。前者是实体瘤中心,后者是血液病中心。这些患者覆盖了75种肿瘤类型,在总体上可以代表英国儿童肿瘤学和血液学的常见疾病。 不过骨肿瘤、低级别脑肿瘤患者以及12岁以上青少年血液肿瘤患者的代表性不足。详细分组可见图一。
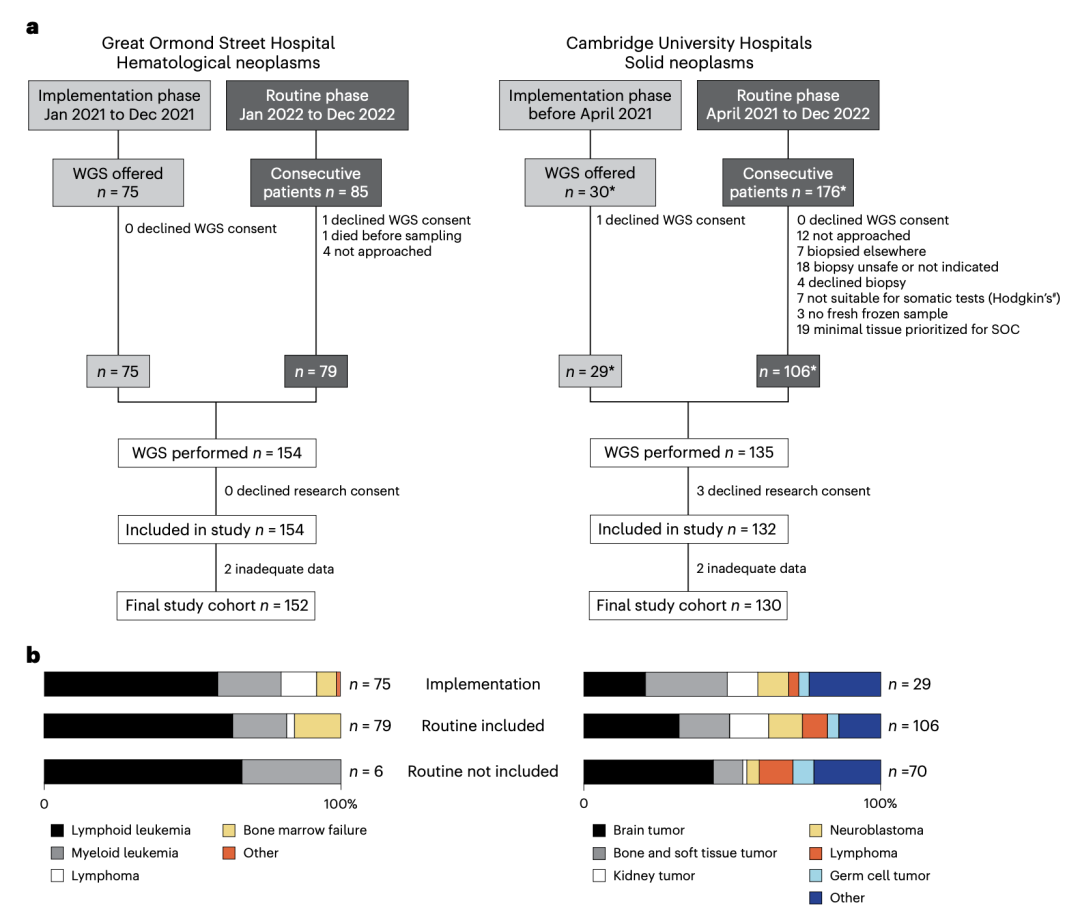
每个中心的研究分为两个阶段:
1) 实施阶段(Implementation phase)
在该阶段,患者非连续性地被纳入研究,由主治医生根据实际情况选择。选择标准主要基于样本采集与存储的可行性,因为这处于服务早期的建立阶段。
2) 常规检测阶段(Routine testing phase)
该阶段旨在向每位患者提供WGS检测,不再限于挑选特定患者,以便将WGS作为常规检测手段全面融入临床实践
研究结果可以从四个方面总结:1) WGS与标准护理(SOC)对比 2) 临床益处总结 3) 患者医疗管理变更中的独特WGS发现 4)儿童肿瘤基因组的新发现
-
在WGS与标准护理(SOC)对比中, WGS不仅完全再现了这些SOC检测的结果(包括未发现相关疾病特征的情况),还在108个实例(83个病例,占29%)中揭示了额外的诊断、风险评估、治疗和胚系特征。其中,80个发现直接带来了临床益处,如诊断改进或治疗机会。
-
这80个新发现带来的临床益处在69例患者(282例中的24%)涵盖了以下三个方面:
辅助诊断(n=40, 14%):WGS通过加速预期的检测结果或提供额外的诊断信息,帮助确认诊断。
-
-
提供了骨髓衰竭、预期癌症易感性、新发癌症易感性排除等方面的快速诊断。
-
具体包括14例骨髓衰竭、7例癌症易感性确诊、1例癌症易感性排除和2例风险变异鉴定。
-
-
包括诊断明确化(8例)、识别新实体(3例)、SOC分子检测差异澄清(2例)、风险分类澄清(2例)、以及检测最小残留疾病的标准化(1例)。
提供治疗机会(n=20, 7%):WGS发现了一些可通过现有药物靶向的变异,为患者提供了新的治疗方案。
-
包括检查点抑制剂(4例)、RAS通路抑制剂(8例)、以及其他靶向治疗(8例)
改变患者管理(n=20, 7%):WGS的独特发现直接改变了患者的治疗管理。
-
通过详细和审慎的案例审查,本研究共识别了20例WGS发现导致管理变更的案例。举例说明; 在一名胸部神经母细胞瘤患儿中,WGS发现了与乳腺癌易感性相关的PALB2框移突变。这一发现导致治疗方案的调整,即放射治疗的照射范围被修改,以避免乳房发育区受到辐射。尽管该患儿之前也接受了SOC检测(包括核型分析、拷贝数阵列及神经母细胞瘤易感基因的直接测序),但PALB2基因未被纳入检测范围,因为该基因通常不在神经母细胞瘤的易感性筛查中。因此,这一WGS发现属于SOC检测无法发现、且未被预期检测的变异,直接导致治疗调整。在所有的这些发现中,胚系变异在调整患者管理方面尤为突出。 这些案例表明,WGS能够发现SOC检测无法识别的重要变异,为临床决策提供了关键的基因信息,从而优化治疗方案并避免不必要的强化治疗。
-
在本研究的6例病例中,全基因组测序(WGS)揭示了此前未知的基因特征,这些特征可能成为未来研究的方向(见表4)。这些新发现包括独特的分子肿瘤实体、疾病定义性突变以及已知致癌突变的变异形式。在一例婴儿高级别脑肿瘤中,检测到了ATNX1–NUTM2D基因融合,这是首次在儿童中发现的此类融合。该肿瘤无法通过组织学或SOC分子检测(包括甲基化分析阵列)进行分类,并且其特征在数万个参考数据点中独一无二。这些发现推动了新的研究假设,并为某些难以分类的肿瘤提供了明确的诊断信息,展现了WGS在儿童肿瘤基因组研究中的重要价值。
总而言之, 本研究表明, 全基因组测序(WGS)在儿童肿瘤诊疗中具有显著优势。 WGS能够发现标准护理(SOC)检测无法识别的重要变异,提升诊断精度,加速治疗决策,并支持个性化治疗,如发现胚系易感性变异促成长期筛查和治疗优化。此外,WGS通过整合多项检测,减少了对组织样本的需求,这在儿童肿瘤中尤为关键。同时,随着WGS数据的积累,基因型–表型关联数据库可以被创建,为未来研究提供宝贵资源。
本研究也揭示了一些改进空间:目前RNA测序仅限于基因融合检测,缺乏基因表达分析,影响了WGS的全面应用;报告时间在某些情况下无法及时满足临床需求,需要针对不同疾病类型进行优化。此外,WGS的效用依赖于各单位的本地解读能力,解读水平的不均衡可能影响结果的应用价值。尽管WGS整合检测具有降低成本的潜力,但还需进一步的经济分析来评估其在不同医疗环境中的可行性。随着系统优化和成本降低,WGS有望成为儿童肿瘤学中的核心工具,推动更高效、更精准的临床护理和研究。
撰文

责编

制作
排版 | Sheila 校对 | uu
▼滑动查看更多▼
Clinical whole-genome sequencing (WGS) has been shown to deliver potential benefits to children with cancer and to alter treatment in high-risk patient groups. It remains unknown whether offering WGS to every child with suspected cancer can change patient management. We collected WGS variant calls and clinical and diagnostic information from 281 children (282 tumors) across two English units (n = 152 from a hematology center, n = 130 from a solid tumor center) where WGS had become a routine test. Our key finding was that variants uniquely attributable to WGS changed the management in ~7% (20 out of 282) of cases while providing additional disease-relevant findings, beyond standard-of-care molecular tests, in 108 instances for 83 (29%) cases. Furthermore, WGS faithfully reproduced every standard-of-care molecular test (n = 738) and revealed several previously unknown genomic features of childhood tumors. We show that WGS can be delivered as part of routine clinical care to children with suspected cancer and can change clinical management by delivering unexpected genomic insights. Our experience portrays WGS as a clinically impactful assay for routine practice, providing opportunities for assay consolidation and for delivery of molecularly informed patient care.
DOI: 10.1038/s41591-024-03056-w
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/10/23/Nature%20Medicine%20%EF%BD%9C%20%E5%B8%B8%E8%A7%84/



