Nature | 三阴性乳腺癌治疗新突破:AKT抑制剂与EZH2抑制剂的联合威力
【CMT&CHTV 医学前沿·临床经典】
导语:本文介绍了一项创新研究,该研究通过联合应用AKT抑制剂和EZH2抑制剂,为TNBC患者带来了新的治疗希望。
2024年10月9日,哈佛大学医学院的研究人员在国际顶尖学术期刊 Nature 上发表了题为“AKT and EZH2 inhibitors kill TNBCs by hijacking mechanisms of involution”一文,旨在探索AKT抑制剂和EZH2抑制剂联合治疗三阴性乳腺癌(TNBC)的潜力和机制。
研究背景
TNBC是乳腺癌中最为凶险的亚型,因其缺乏雌激素受体、孕激素受体和HER2的表达,使得内分泌治疗和HER2靶向治疗无效。尽管PI3K通路在TNBC中频繁异常激活,但针对该通路的抑制剂在临床试验中的效果并不理想。超过70%的TNBC患者存在PIK3CA、AKT1或PTEN的突变,但如何有效利用这一治疗靶点仍是一个挑战。本文的研究团队通过深入探索,发现了一种基于AKT抑制剂的联合治疗方案,可能为TNBC的治疗带来革命性的进展。
在乳腺癌中,PI3K信号通路经常被过度激活。在表达激素受体(HR+)的 Luminal型肿瘤中,最常见的突变影响PIK3CA基因,该基因编码PI3K的催化亚单位p110α。因此,选择性抑制PI3Kα的药物,与雌激素受体(ER)拮抗剂联合使用,已被批准用于治疗晚期HR+患者。然而,在基底样三阴性乳腺癌(TNBC)中,PTEN突变更为普遍,这些肿瘤可以通过PI3K的p110β亚单位发挥作用。因此,可能需要针对下游成分(如AKT)的药物来抑制这些肿瘤中的PI3K信号。
目前,已有的一项Ⅲ期TNBC试验中,AKT抑制剂联合紫杉醇并没有改善治疗效果,其他药物的研究仍在进行中。因此,目前尚不清楚PI3K通路抑制剂在这种侵袭性乳腺癌亚型中的作用。
鉴于PI3K抑制剂在 Luminal型肿瘤中的有效性,研究者们探索了是否可以通过调节细胞状态来增加TNBC对AKT抑制剂的敏感性。EZH2是PRC2复合体的催化组分,通过在组蛋白H3的第27位赖氨酸上添加甲基化标记(H3K27me3)来促进基因沉默。EZH2在干细胞维持中扮演着重要角色,其过度表达促进了多种癌症的发展,包括TNBC。在小鼠实验中,EZH2也必需于维持 Luminal祖细胞和限制 Luminal细胞的分化,而其靶向过表达则推动了导管内增生。EZH2抑制剂不影响已形成的乳腺癌生长,但在TNBC中,EZH2的过度表达与肿瘤的侵袭性和转移能力增强有关,EZH2的抑制会限制TNBC的转移。
因此,研究者们最初假设EZH2抑制剂可能通过将这些分化程度较低的肿瘤转化为更类似于 Luminal状态,从而增加TNBC对AKT抑制剂的敏感性。幸运的是,已有几种EZH2抑制剂被开发出来,其中一种名为Tazemetostat的药物已经获得FDA批准用于其他适应症。
研究设计
本研究是一项基础研究与临床前研究的结合,旨在探索AKT抑制剂与EZH2抑制剂联合治疗TNBC的效果。研究团队首先在体外对多种TNBC细胞系进行了药物敏感性测试,然后通过动物模型评估了联合用药的疗效。此外,研究还利用计算机学习方法,开发了一种用于预测药物敏感性的分类器。研究中使用了包括细胞计数、活细胞成像、RNA测序、ATAC-seq、CUT&RUN和ChIP-qPCR等多种实验技术,以确保结果的准确性和可靠性。
研究结果
研究结果显示,AKT抑制剂与EZH2抑制剂的联合使用在多个TNBC模型中诱导了显著的肿瘤缩小。这种联合疗法首先促使基底样TNBC细胞向分化程度更高的 Luminal样状态转变,然后通过激活正常乳腺退化过程中的信号通路来杀死这些细胞。此外,研究还发现,通过联合用药可以显著提高TNBC细胞对治疗的敏感性,且这种敏感性可以通过机器学习模型进行预测。在动物模型中,联合用药展现了良好的耐受性和治疗效果,为TNBC的治疗提供了新的策略。
肿瘤显著缩小
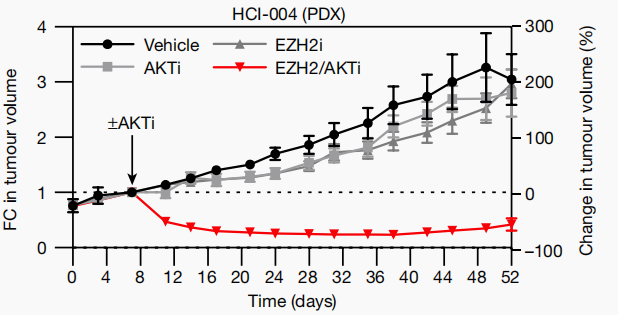
在多个TNBC模型中,AKT抑制剂(ipatasertib)和EZH2抑制剂(tazemetostat)的联合使用触发了显著的肿瘤缩小。具体而言,MDA-MB-468和SUM149PT异种移植物在28天内分别缩小了42-73%(图1f,g),生存期从46天增加到116天,尽管治疗已经停止(扩展数据图3d)。此外,EZH2/AKT抑制剂也在患者衍生的异种移植物(PDX)模型中显示出效果。例如,HCI-004肿瘤缩小了60-88%,其中一例达到了完全缓解(图1)。这些结果在多个PDX、异种移植物和GEMM模型中得到了证实,这在TNBC中是罕见的,突显了这种联合治疗的潜在治疗价值。
图1 肿瘤缩小
细胞分化诱导
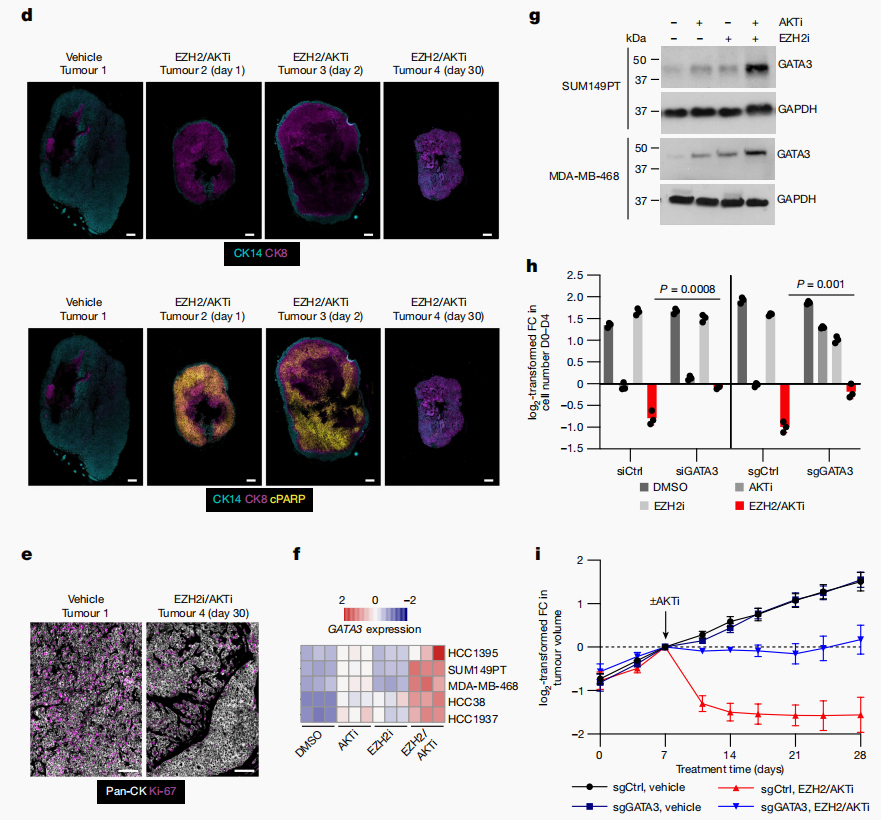
RNA测序(RNA-seq)分析显示,联合治疗在细胞死亡发生前24小时,触发了与基底和乳腺干细胞相关的基因(如KRT5, KRT14和VIM)的强烈抑制,同时伴随着 Luminal标记物(如GATA3和ELF3)的上调。这表明EZH2和AKT抑制剂共同推动了基底样TNBC细胞向更类似于 Luminal的状态转变,这一转变在体内也得到了证实(图2d)。此外,GATA3的表达对于肿瘤缩小至关重要,其缺失阻止了AKTi和EZH2i之间的协同作用(图2h,i)。
图2 需要EZH2/AKT抑制剂组合使用才能达到最大分化和治疗反应
治疗敏感性的预测
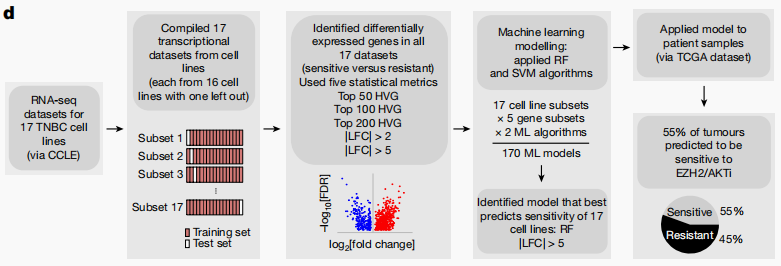
通过计算机学习方法,研究者开发了一种分类器,可以预测TNBC对EZH2/AKTi的敏感性。利用CCLE RNA-seq数据,通过随机森林(RF)算法训练的模型能够准确预测细胞系的敏感状态。当这一模型应用于TCGA Firehose TNBC肿瘤样本时,预测出55%的肿瘤对EZH2/AKTi敏感(图3)。这一发现为未来临床试验中敏感性的预测提供了可能。
图3 使用计算机学习识别敏感的TNBC细胞状态
治疗机制的深入理解
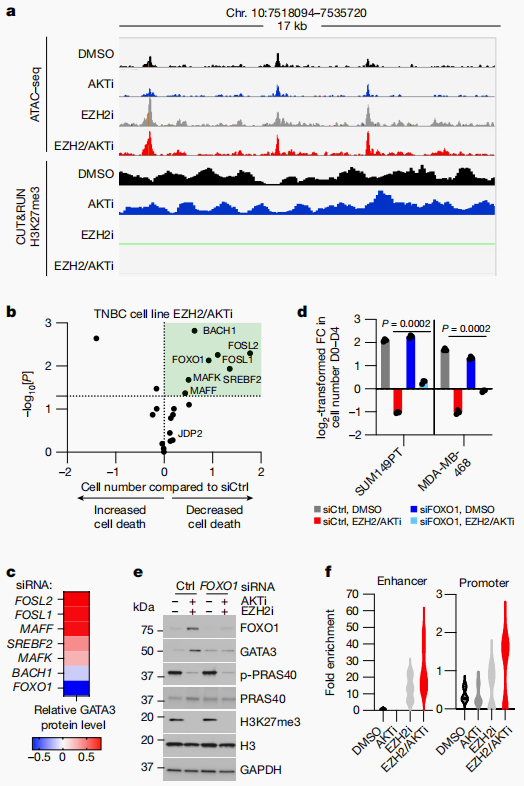
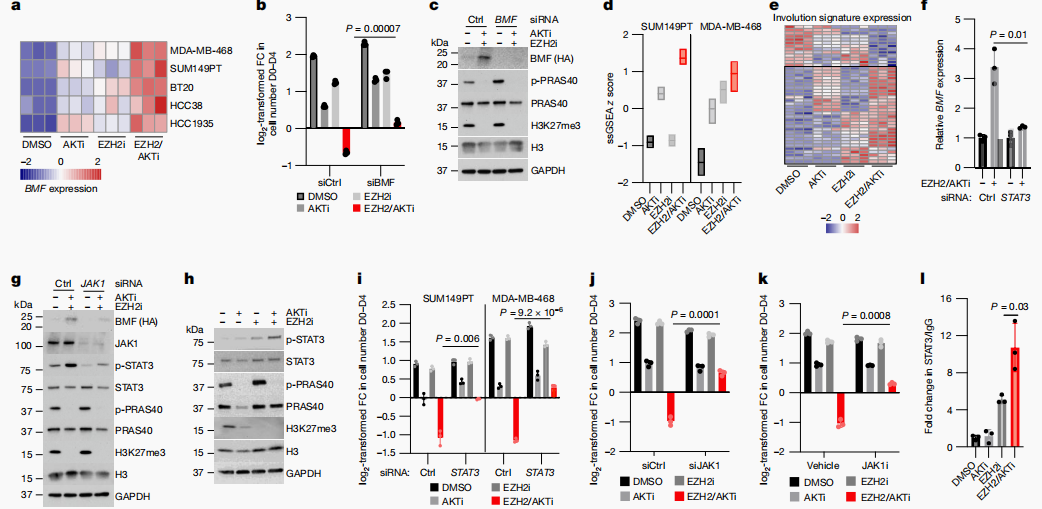
研究进一步揭示了AKTEZH2抑制剂如何通过诱导GATA3和BMF的表达来促进TNBC细胞的分化和凋亡。通过Hi-C数据和CUT&RUN分析,研究者发现GATA3增强子区域在EZH2抑制后变得可接近,而AKT抑制剂则通过去磷酸化FOXO1来增强其转录活性,从而促进GATA3的表达(图4)。此外,BMF的上调是通过JAK1-STAT3途径实现的,这一途径在TNBC细胞中被EZH2/AKTi激活(图5)。这些发现不仅为TNBC的治疗提供了新的靶点,也为理解TNBC的生物学行为提供了新的视角。
图4 EZH2和AKT抑制剂驱动分化染色质与FOXO1协同作用
图5 AKT和EZH2抑制剂通过选择信号触发细胞死亡、驱动内卷化
治疗抵抗性的逆转
研究还发现,通过诱导表达GATA3和使用STING激动剂,可以使对EZH2和AKT抑制剂产生抵抗的细胞变得敏感。这一发现表明,通过特定的分子干预,可以逆转TNBC细胞的治疗抵抗性,为克服治疗抵抗提供了新的策略。
总结讨论
本研究的结论强调了AKT抑制剂与EZH2抑制剂联合治疗在TNBC中的潜力。这种联合疗法通过诱导TNBC细胞的分化和激活退化信号通路,有效地杀死了肿瘤细胞。此外,研究还揭示了如何通过机器学习模型预测患者对这种联合疗法的敏感性,为未来的个性化治疗提供了可能。尽管这一发现还需要在临床试验中进一步验证,但它无疑为TNBC的治疗提供了新的视角和希望。
参考文献
SCHADE A E, PERURENA N, YANG Y, et al. AKT and EZH2 inhibitors kill TNBCs by hijacking mechanisms of involution. Nature[J]. 2024. https://www.nature.com/articles/s41586-024-08031-6. [2024-10-9]. DOI:10.1038/s41586-024-08031-6.
链接:http://www.lewenyixue.com/2024/10/23/Nature%20%7C%20%E4%B8%89%E9%98%B4%E6%80%A7%E4%B9%B3%E8%85%BA%E7%99%8C%E6%B2%BB%E7%96%97%E6%96%B0%E7%AA%81%E7%A0%B4/






赶快来坐沙发