【Nature子刊】郑州大学郭文治团队:有前景的肝癌预后评估生物标志物和治疗新策略
【导读】 肝细胞癌(HCC)是肝脏最常见的恶性肿瘤,预后不佳。跨膜蛋白209(TMEM209)参与多种生物学过程,如物质转运和信号转导,在肿瘤组织中大量表达。然而,TMEM209与HCC之间的关系尚未完全阐明。
10月16日,郑州大学郭文治研究团队在期刊《Cell Death Discovery》上发表了研究论文,题为“TMEM209 promotes hepatocellular carcinoma progression by activating the Wnt/β-catenin signaling pathway through KPNB1 stabilization”,本研究中,生物信息学分析和临床样本验证表明,TMEM209在HCC中上调,与生存期缩短相关。功能上,TMEM209在体外促进HCC细胞的增殖、迁移、侵袭和上皮间质转化,并促进肿瘤生长和转移。机制上,TMEM209在KPNB1依赖的情况下促进HCC的增殖和转移。具体来说,TMEM209可以与KPNB1结合,从而竞争性阻断KPNB1与E3泛素连接酶RING finger和CHY锌指结构域蛋白1(RCHY1)之间的相互作用,防止K48相关的KPNB1降解。最终,Wnt/β-catenin信号通路被激活,促进HCC恶性表型的进展。 总之,研究人员阐明了HCC进展中TMEM209/KPNB1/Wnt/β-catenin轴的分子机制。TMEM209是HCC的一种潜在的生物标志物和治疗靶点。

https://www.nature.com/articles/s41420-024-02207-9#Sec10
背景信息
01
原发性肝癌(PLC)是全球第六大最常见的恶性肿瘤,也是第三大导致癌症相关死亡的原因。肝细胞癌(HCC)约占PLC的90%。尽管近年来在治疗模式方面取得了进展,包括针对HCC的手术、靶向治疗、放疗和联合治疗,但患者的预后仍不令人满意。肝脏丰富的血液供应使得HCC具有高度增殖性和侵袭性。由于对驱动HCC进展的机制缺乏深入了解,因此对其临床治疗带来了重大挑战。因此,迫切需要彻底研究其潜在机制,并识别新的生物标志物和治疗靶点。
跨膜蛋白(TMEMs)横跨生物膜,在包括信号转导、催化、蛋白质支架、蛋白质稳定性和物质运输在内的多种过程中起着重要作用。尽管大多数TMEMs的功能尚不清楚,但越来越多的证据表明,某些TMEMs在肿瘤中的功能失调可发挥致癌或肿瘤抑制作用,从而影响肿瘤的增殖、转移和耐药性。作为TMEMs的成员之一,跨膜蛋白209(TMEM209)最初被发现是小鼠肝脏中的核膜蛋白,其后在其高尔基体、囊泡和细胞质中也观察到了其分布。高通量测序表明TMEM209变异与淋巴瘤有关,全基因组分析表明TMEM209可能是克隆性造血干细胞的靶点。肺癌研究提出,TMEM209在肿瘤组织中高度表达,促进其增殖,表明TMEM209可能作为一种致癌基因发挥作用。此外,TMEM209还涉及蛋白质稳定性调节,特别是能增加NUP205蛋白质的表达。然而,TMEM209与HCC之间的关系的研究尚未完全阐明,TMEM209在HCC中的作用和机制仍有待阐明。
TMEM209通过Wnt/β-catenin信号通路促进HCC细胞的生长和转移
02
研究人员对TMEM209敲低的MHCC-97H细胞进行了RNA测序和基因集富集分析(GSEA)。结果表明,Wnt/β-catenin信号通路与TMEM209的表达密切相关。研究人员评估了细胞核和细胞质中β-catenin的蛋白水平。与预期一致,沉默TMEM209抑制了β-catenin在细胞核内的聚集,并促进其在细胞质内的聚集。此外,在TMEM209敲低的细胞中,Wnt/β-catenin信号通路的关键下游蛋白c-Myc, CDK4, Axin2, GLUL和LECT2的水平降低。而且,过表达TMEM209产生相反的结果。由于前期研究表明β-catenin的突变与肿瘤的进展相关,因此研究人员通过分析TCGA数据来探讨TMEM209的表达与β-catenin突变的关系。结果显示β-catenin突变与TMEM209表达无明显相关性。因此,本研究结果表明,TMEM209促进了β-catenin的核转位和Wnt/β-catenin通路的激活。
随后,研究人员进行了实验,以验证TMEM209通过Wnt/β-catenin信号通路的参与。CCK-8和克隆形成实验显示XAV939显著抑制tmem209刺激的细胞增殖。迁移实验显示XAV939可抑制TMEM209过表达诱导的细胞迁移和侵袭能力。因此,TMEM209可通过激活Wnt/β-catenin信号通路促进肝癌细胞的增殖和转移。
KPNB1通过Wnt/β-catenin信号通路促进肝癌细胞的增殖和转移
03
在确定KPNB1与TMEM209的调节关系后,研究人员研究了KPNB1在Wnt/β-catenin信号通路中的作用及其在HCC中的潜在功能。研究人员观察到,KPNB1过表达导致典型的Wnt/β-catenin通路相关因子(如胞核内β-连环蛋白、CDK4、c-Myc、Axin2、GLUL和LECT2)水平升高,而KPNB1沉默则导致相反的趋势。此外,Wnt/β-catenin信号通路的抑制显著缓解了KPNB1过表达诱导的增殖和转移。因此,研究人员证实KPNB1通过激活Wnt/β-catenin通路加速HCC的进展。
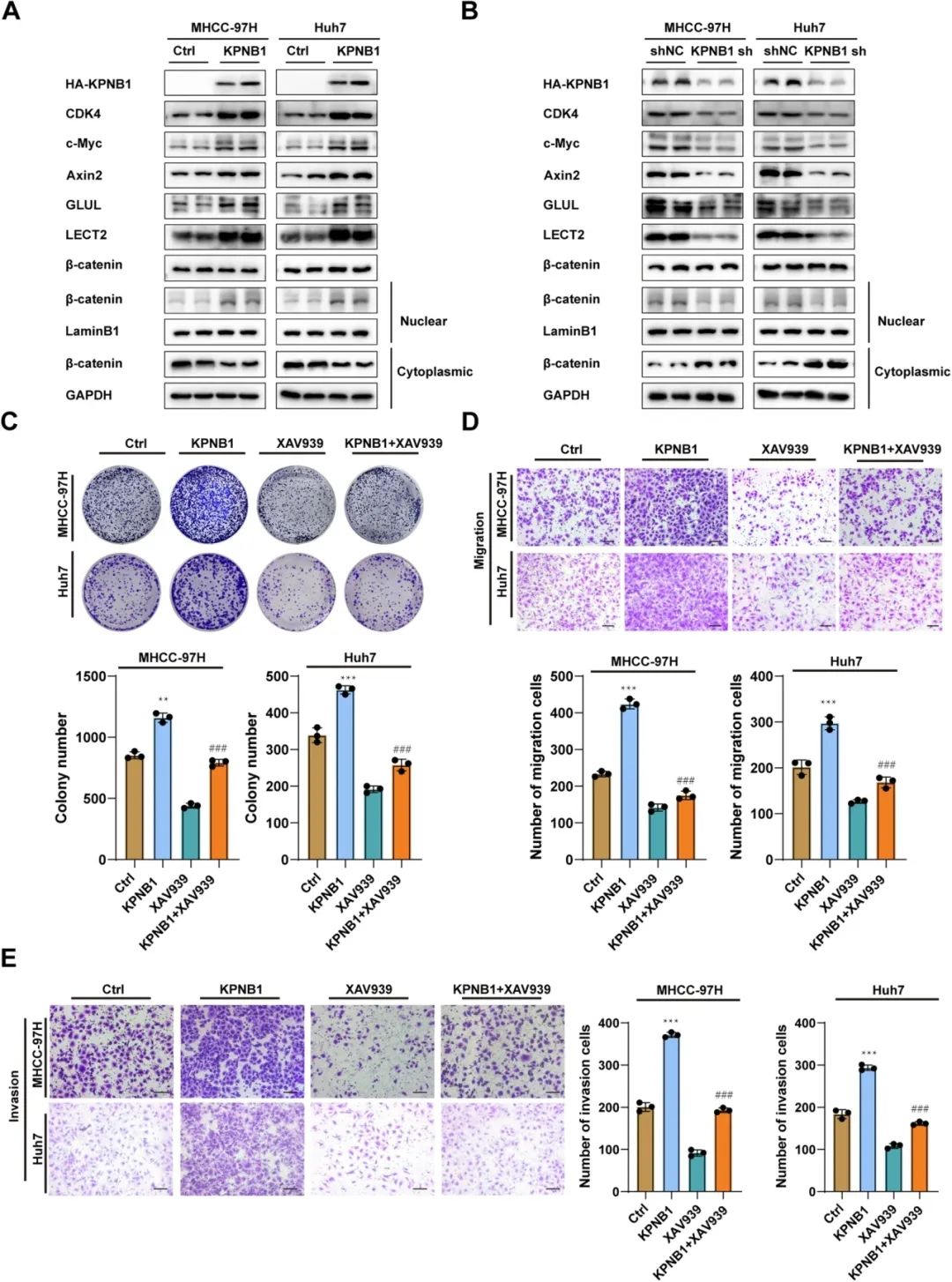
KPNB1通过Wnt/β-catenin信号通路促进细胞增殖和转移
TMEM209在体外和体内均可促进HCC的增殖和转移,其依赖于KPNB1
04
接下来,研究人员分别用KPNB1-sh慢病毒(shKPNB1)或对照慢病毒(Ctrl)感染过表达TMEM209的细胞。蛋白质免疫印迹分析显示,KPNB1敲低抑制了TMEM209诱导的β-catenin核聚集和CDK4、c-Myc、Axin2、GLUL和LECT2的激活。迁移实验表明,TMEM209对细胞迁移的促进作用被抑制。同样,克隆形成实验显示,通过shKPNB1慢病毒转染,TMEM209诱导的细胞克隆形成被消除。
最后,研究人员进行了体内实验。研究人员将对照细胞(Ctrl)、过表达TMEM209的细胞(TMEM209)、沉默KPNB1的细胞(shKPNB1)以及过表达TMEM209并沉默KPNB1的细胞(TMEM209+shKPNB1)注射到裸鼠的皮下、尾静脉或肝脏中。在皮下肿瘤模型中,TMEM209组的肿瘤体积和重量高于Ctrl组和TMEM209+shKPNB1组。重要的是,沉默KPNB1减缓了TMEM209诱导的肿瘤生长。肿瘤图像直观地反映了各组肿瘤的大小和重量差异。同样,原位移植肿瘤模型和肺转移模型的肺组织HE染色也显示出类似的结果。因此,研究人员证实了TMEM209在HCC中的作用依赖于KPNB1。
结论
05
综上所述,本研究结果揭示了TMEM209的作用和临床意义,并证实了TMEM209/KPNB1/Wnt/β-catenin轴在HCC进展中的关键调控作用。本研究表明,TMEM209可能是一个有前景的生物标志物,靶向TMEM209及其调控轴可能成为治疗HCC患者的一种新的潜在治疗策略。
【参考资料】
https://www.nature.com/articles/s41420-024-02207-9#Sec10
链接:http://www.lewenyixue.com/2024/10/21/%E3%80%90Nature%E5%AD%90%E5%88%8A%E3%80%91%E9%83%91%E5%B7%9E%E5%A4%A7%E5%AD%A6%E9%83%AD%E6%96%87%E6%B2%BB%E5%9B%A2%E9%98%9F%EF%BC%9A/