Cell Stem Cell | 隋鹏飞课题组揭示肺基底干细胞线粒体代谢调控新机制
肺基底干细胞在维持气道上皮稳态和修复损伤过程中发挥着至关重要的作用,其功能紊乱与多种肺部疾病的发生密切相关,如慢性阻塞性肺病 (COPD) 。在COPD患者中,气道上皮表现出肺基底干细胞的异常增生、纤毛细胞减少和上皮分化障碍等病理特征。同时,气道上皮细胞呈现异常的线粒体形态,提示线粒体代谢在调节肺基底干细胞功能及命运决定中具有重要作用。然而,这一机制仍未完全阐明。因此,深入了解线粒体代谢如何影响肺基底干细胞功能,对于揭示肺部疾病的发生机制以及开发靶向干细胞的治疗策略具有重要意义。
2024年10月18日,中国科学院上海分子细胞卓越创新中心 隋鹏飞 课题组在 Cell Stem Cell 期刊上发表了文章 Mitochondrial pyruvate carriers control airway basal progenitor cell function through glycolytic-epigenetic reprogramming 。该研究 揭示了控制肺基底干细胞命运决定的代谢机制,并提出靶向干细胞代谢的肺部疾病治疗策略。
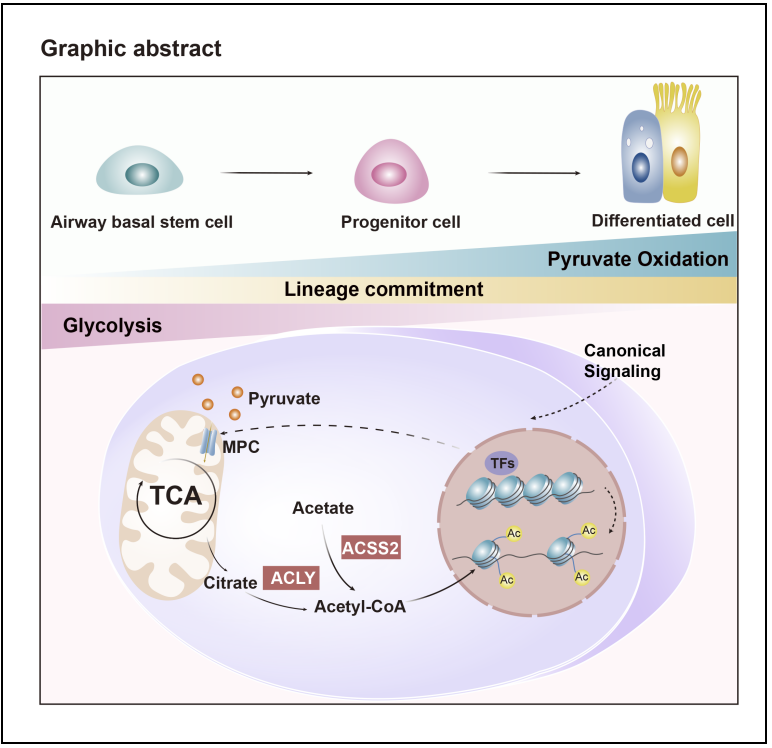
本研究首先发现,肺基底干细胞在分化过程中经历代谢重编程,其中线粒体丙酮酸氧化过程显著上调,线粒体丙酮酸转运体 Mpc2 表达水平增加。通过使用MPC小分子抑制剂UK-5099进行体外类器官培养和连续传代实验,研究表明抑制MPC活性可以抑制肺基底干细胞的分化,从而实现其长期体外扩增。在多次传代过程中,细胞始终保持肺基底干细胞的分化潜能。进一步构建突变体小鼠并进行体内谱系追踪实验,发现抑制肺基底干细胞的丙酮酸代谢赋予其快速增殖的潜能,导致上皮中肺基底干细胞异常增生。在损伤条件下,肺基底干细胞的丙酮酸代谢紊乱干扰了上皮结构的重建,导致大多数上皮细胞滞留在KRT13+或KRT5+KRT8+分化中间状态,阻碍上皮的修复进程。这些表型与COPD病理状态下的气道上皮特征非常相似。机制上,发现MPC敲除导致肺基底干细胞中柠檬酸含量显著下降,进而减少乙酰辅酶A的合成,影响组蛋白乙酰化水平,干扰分化相关基因的表达,从而建立了丙酮酸代谢与表观遗传修饰的调控环路。靶向该调控通路,外源性补充柠檬酸可以纠正异常的细胞行为,提升COPD患者肺基底干细胞向功能性纤毛细胞分化的效率。
本研究揭示了线粒体丙酮酸代谢在肺基底干细胞命运决定中的核心作用,构建了代谢与表观遗传的调控环路。这一发现为肺部疾病的治疗提供了新的思路。
该研究由中国科学院上海分子细胞卓越创新中心隋鹏飞课题组与上海市第六人民医院任涛研究组合作完成。 中国科学院上海分子细胞卓越创新中心博士生李雅雯、何亚琳及上海市第六人民医院郑琦为本文的共同第一作者,隋鹏飞研究员和任涛教授为该论文的共同通讯作者。 本研究得到分子细胞卓越创新中心朱学良研究员、柳欣研究员、周小龙研究员、王广川研究员及袁怀瑞研究员的大力支持。
https://doi.org/10.1016/j.stem.2024.09.015
制版人:十一
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/10/19/Cell%20Stem%20Cell%20%7C%20%E9%9A%8B%E9%B9%8F%E9%A3%9E/
THE END