人体肠道菌群主要特征的专家共识
人体肠道菌群主要特征的专家共识
摘 要
从19世纪科学家开始探索肠道菌群与人体健康的关系,到近年来提出“肠-脑轴”“肠-X轴”等新的概念,肠道菌群对人体健康的影响早已成为不争的事实。然而,由于人体肠道菌群的组成具有地域和个体差异性,且易受到外在因素(如膳食、药物、运动等)和内在因素(种族、年龄和血型等)的影响,因此,目前国内外对“人体健康肠道菌群”尚无明确的定义。研究表明,健康人体肠道存在的基石物种对肠道菌群的物种多样性和功能多样性具有较大的贡献,而肠道菌群的失调则会引发一系列健康问题,可通过改善膳食营养结构、生活方式,补充益生菌、益生元等调节肠道菌群。本文依据国内外科学文献,在研究与分析影响肠道菌群主要因素的基础上,凝练出人体肠道菌群的主要特征并形成共识,旨在为深入研究“健康肠道菌群”及相关技术开发与行业发展提供参考。
关键词:肠道菌群;基石物种;双歧杆菌;乳杆菌;益生菌
正 文
人体肠道微生物数量约为100万亿个,主要分布在小肠、结肠等部位。近年来,肠道微生物与人体健康的关系一直是学术界和产业界关注的焦点,而肠道菌群对人体健康的影响,也从“菌群-肠道”逐步拓展到“肠-脑轴”“肠-X轴”(如“肠-肝轴”“肠-肾轴”等)。在过去的10年中,关于肠道菌群的科研文献超8万篇,为深入研究肠道菌群与健康的关系奠定了重要基础。然而,目前对于什么是健康肠道菌群,什么是调节肠道菌群的关键菌种等问题,仍无明确的标准与定论。
研究表明,人体肠道菌群的组成具有地域差异性和个体差异性,且易受到外在因素和内在因素的影响。基于目前文献研究证据,本文主要探讨人体肠道菌群的影响因素、主要组成与特征以及肠道菌群紊乱导致的健康问题等,并分析以膳食、生活方式、微生态制剂等不同途径对肠道菌群的靶向调节和整体生态调节,通过专家研讨方式凝练形成《人体肠道菌群主要特征的专家共识》,以期为改善肠道菌群的健康状态及益生菌功能性评价方法,促进行业的高质量发展提供参考。
1 人体肠道菌群的研究历程
早在19世纪,科学家就开始关注肠道微生物对人体健康的影响。1899年,法国巴黎儿童医院的Tissier[1]从健康母乳喂养的婴儿粪便中分离到第1株双歧杆菌,当时称为分叉杆菌(Bacterium coli,现双歧杆菌为Bifidobacterium),并发现双歧杆菌与婴儿患腹泻的频率及营养状态有关。1908年,俄罗斯科学家梅契尼科夫在其著作《Prolongation of Life》中正式提出“酸奶长寿”的理论,即酸奶中的乳酸菌可能通过抑制肠道腐败菌生长而预防疾病和衰老[2]。1992年,Bocci[3]提出肠道菌群是“被忽略的人体器官”。
长期以来,受到传统培养技术和采样技术的制约,难以全面认识肠道微生物的种类和数量。直到20世纪,基于分子生物学理论的技术[4-8](寡肽探针、末端限制性长度多态性分析、变性梯度凝胶电泳及实时定量PCR等手段)与模式动物(无菌动物、基因工程动物)等的出现[9-11],有力推动了肠道微生物的研究。21世纪初,随着测序技术的发展,宏基因组、代谢组等多组学技术被应用于肠道菌群与人体健康的研究领域,标志着肠道微生物组研究时代的到来。目前,对肠道菌群的研究主要是针对采集的粪便样本,采用培养与测序技术,揭示结肠末端的肠道菌群数量和组成,尚未全面客观认识肠道微生态系统[9]。2007年,美国开展了“人类微生物组计划”(Human Microbiome Project)。2008年,欧盟启动了肠道元基因组第7框架项目(MetaHIT)。2021年,全球肠道健康研究资助基金(Global Grants for Gut Health),聚焦于“人类健康中的生命早期微生物组”的研究。
未来,应用无创原位采集肠道菌群样本的技术替代目前粪便为样本的研究方法,对于深入认识人体肠道菌群具有重要意义。亟待培养组学技术的发展来突破99%肠道未培养/难培养微生物的资源挖掘,而结合人工智能与大数据技术则可有效构建人体肠道菌群物种数据库、功能基因数据库、耐药基因数据库等,为人体健康肠道菌群特征的描述提供更为丰富的科学依据,实现国家战略性微生物资源的高效利用和高质量发展。
2 影响肠道菌群稳态的主要因素
肠道菌群虽是一个相对稳定的状态,但又不是一成不变的,其组成和结构在个体间差异很大,多种因素对肠道菌群多样性产生影响。
2.1 宿主基因型
研究表明,肠道菌群与种族、宿主基因型及血型有关。Stearns等[12]开展的大型多种族队列研究表明:黄种人婴儿肠道含有更多的双歧杆菌、乳杆菌(Lactobacillus)等产乳酸的细菌,而白种人婴儿含有更多梭菌目的毛螺旋菌科(Lachnospiraceae)等细菌。Brooks等[13]对4个种族近1700人的数据分析发现,种族与肠道菌群存在关联,其关联性甚至超过身体质量指数(Body Mass Index,BMI)、年龄和性别等因素,并鉴定出至少12个细菌类别的丰度受到种族影响。Zhernakova等[14]队列研究发现普拉梭菌(Faecalibacterium prausnitzii)基因组上的一个结构变异区域与宿主ABO血型高度相关,其基因组上577~579kb处的变异区域在A型或AB型血个体中比在B型或O型个体中更为常见。活泼瘤胃球菌(Ruminococcus gnavus)可通过表达特定的糖苷水解酶,偏好性地利用A型血抗原[15]。
2.2 年龄
肠道菌群在人类整个生命周期内是动态变化的,且其生命演进过程是影响肠道菌群组成的主要内在因素。与成人相比,婴儿具有复杂且高度个性化的肠道菌群[16],3岁以后儿童逐渐形成稳定的肠道结构,然而,在功能和分类上与成人仍有差异[17]。成年人肠道菌群的α多样性与年龄呈正相关,40岁后趋于稳定,拟杆菌属(Bacteroides)和真/优杆菌属(Eubacterium prévot)是成年人肠道中最常见的细菌。老年人肠道菌群的多样性随年龄增加而降低,一些有益菌,如阿克曼菌(Akkermansia)、双歧杆菌和克里斯滕氏菌(Christensenella minuta)等丰度降低[18],普雷沃氏菌(Prevotella)及其相关菌属的多样性和组成受年龄影响较大。此外,长寿老人肠道菌群多样性与双歧杆菌丰度均高于普通老年人[19]。
2.3 地理环境
生活在不同地域的人们,由于独特的环境、气候和生活习俗等,也会影响人体肠道菌群的组成。对我国不同地区3224名个体肠道菌群的分析结果表明,个体间肠道菌群的相似性与地理距离呈负相关[20]。移民引起的地理迁移也会重塑肠道菌群组成,例如从非西方国家移民美国6个月后,发现肠道菌群显著变化,包括多样性降低,原住菌株丧失,优势菌从普雷沃氏菌属向拟杆菌属转变,降解植物纤维相关的细菌酶减少等[21]。此外,一些确切因素的改变,如海拔[22]、温度与湿度[23]、空气质量[24]和土壤微生物[25]等因素的变化均可影响人体肠道菌群的组成。
2.4 膳食结构
膳食中营养物质的类型与摄入量是影响肠道菌群组成的重要因素。摄入全谷物或富含麦麸谷物的人群显示出较高的肠道微生物丰度和多样性,并伴随着拟杆菌门水平降低和厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)水平的提升[26-27]。长期以加工食物及动物性食物为主的膳食会增加肠道中厚壁菌门和瘤胃球菌属(Ruminococcus)物种的丰度。植物性食物为主的膳食与肠道微生物多样性及多糖降解细菌[如普拉梭菌、多形拟杆菌(Bacteroides thetaiotaomicron)等]呈正相关[28],并与短链脂肪酸、多糖等营养代谢通路的富集相关,也与致病共生菌的减少相关[29]。Ghosh等[30]发现地中海膳食与肠道菌群及菌群代谢产物的变化相关。
抗生素和药物使用、压力和心理健康、生活方式因素(如:运动、生活习惯、睡眠质量等)等因素也会影响肠道菌群[31-33]。因此,人体肠道菌群的形成是一个复杂的过程,其多样性、组成及微生态系统是由膳食、种族、地理等多种因素相互作用的结果。
3 肠道菌群的主要组成及特征
3.1 肠道菌群的主要组成
每个人具有独特的肠道菌群组成模式,特别在菌种和菌株多样性方面,不同个体间的肠道菌群差异显著,由宿主基因型,出生时通过垂直传播进行的初始定植以及膳食习惯等所决定。
高丰度的双歧杆菌被认为是婴儿肠道中“更健康”的指示性菌种。目前对肠道菌群的研究主要是基于粪便样品分析的结果,在健康母乳喂养的婴儿粪便菌群中,双歧杆菌占主导地位。Davis等[34]研究发现长双歧杆菌婴儿亚种(Bifidobacterium longum subsp. infantis)(婴儿双歧杆菌)能够代谢母乳低聚糖HMO,其在婴儿肠道中占双歧杆菌总数的76.9%,是婴幼儿最重要的双歧杆菌之一。直到3岁,儿童逐渐形成类似成人的肠道菌群,且肠道菌群组成趋于稳定。幼儿肠道菌群,可以根据普雷沃菌属、双歧杆菌属和拟杆菌属的丰度差异分为3个类型:第1种类型拟杆菌属、粪杆菌属(Faecalibacterium)和罗斯氏菌属(Roseburia)的丰度较高;第2种类型普雷沃菌属的丰度较高;第3种类型则以双歧杆菌属为主,包括定植时间较晚的菌属,如甲烷短杆菌属(Methanobrevibacter)的丰度也较高。
双歧杆菌和乳杆菌的丰度变化被认为是调节成年人肠道“更健康”的指示性菌种。对于健康成年人,拟杆菌门和厚壁菌门这两类细菌在肠道生态系统中占主导地位,超过90%的微生物属于这两个菌门。其中,拟杆菌门包括拟杆菌纲的拟杆菌属、黄杆菌纲的黄杆菌属(Flavobacterium)和鞘脂杆菌纲的鞘氨醇杆菌属(Sphingobacterium);而厚壁菌门包括芽孢杆菌纲的芽孢杆菌属(Bacillus)、李斯特氏菌属(Listeria)、葡萄球菌属(Staphylococcus)、肠球菌属(Enterococcus)、乳杆菌属、乳球菌属(Lactococcus)和链球菌属(Streptococcus)等,以及梭菌纲的醋杆菌属(Acetobacterium)、梭菌属(Clostridium)、真/优杆菌属、香蕉孢菌属(Sporomusa),以及柔膜菌纲的支原体属(Mycoplasma)、螺原体属(Spiroplasma)、脲原体属(Ureaplasma)、丹毒丝菌属(Erysipelothrix)。其余为放线菌门(Actinobacteria)、变形菌门、疣微菌门(Verrucomicrobia)和梭杆菌门(Fusobacteria)。对于老年人,其肠道菌群中拟杆菌门和变形菌门细菌丰度增加,而厚壁菌门和放线菌门丰度减少。同时,双歧杆菌、乳杆菌和嗜黏蛋白阿克曼菌(Akkermansia muciniphila)等数量显著减少,而产气荚膜梭菌(Clostridium perfringen)、大肠杆菌(Escherichia coli)、志贺氏菌(Shigella)、肠球菌等致病性细菌显著增加。健康老年人的肠道微生物显示出更丰富的与健康相关菌群,例如阿克曼菌属、双歧杆菌和克里斯滕氏菌[35]。而长寿老人肠道菌群多样性相对较高,如中国广西巴马县百岁老人的双歧杆菌丰度高于普通老年人,而乳杆菌、副拟杆菌(Parabacteroides)丰度则较低[19]。
目前,文献研究与《保健食品功能检验与评价方法(2023年版本)》中关于调节肠道菌群功能的人体试食试验评价,主要判断依据是:①双歧杆菌和/或乳杆菌(或其它益生菌)明显增加,梭菌减少或无明显变化,肠球菌、肠杆菌(Enterobacteriaceae)、拟杆菌无明显变化;②双歧杆菌和/或乳杆菌(或其它益生菌)明显增加,梭菌减少或无明显变化,肠球菌、肠杆菌、拟杆菌明显增加,然而增加的幅度低于双歧杆菌、乳杆菌(或其它益生菌),符合其中任一项即可判定受试样品具有调节肠道菌群的作用。
因此,双歧杆菌和乳杆菌被认为是调节成人肠道菌群的目标菌种,而肠道菌群多样性和丰度、乙酸与丁酸等短链脂肪酸以及肠道蠕动时间、排便频率、排便形态等可以作为健康肠道菌群的重要衡量指标。
3.2 人体肠道菌群的主要特征
明确人体肠道菌群的主要特征可在评价人群健康和调控肠道菌群中起到重要作用[36-37]。健康人体的肠道菌群是复杂的生态系统,具有较高的稳定性,对外界扰动具有一定的抵抗能力与恢复能力,通常不会造成稳态失调而导致疾病的发生[38-39]。
研究表明,健康人体内存在着大量基石物种,在肠道微生物的物种多样性和功能多样性上均具有重要作用,处于不可或缺的地位[40-41]。在1项针对荷兰人群的队列研究中,研究人员鉴定出9个核心物种,包括罕见小球菌属(Subdoligranulum sp.)、另枝菌属(Alistipes onderdonkii、Alistipes putredinis、Alistipes shahii)、单形拟杆菌(Bacteroides unformis)、普通拟杆菌(Bacteroides vulgatus)、直肠杆菌(Eubacterium rectale)、普拉梭菌(Faecalibacterium prausnitzii)和颤螺菌属(Oscillibacter sp.),且与欧洲人群肠道微生物的基石物种具有高度的相似性[42]。同样,荟萃分析也表明这些基石肠道微生物的种类和丰度可以作为预测人体是否健康的一个重要指标,并基于肠道内50余种基石微生物的丰度引入了一种生物学上可解释的数学公式,用于计算肠道微生物组健康指数(GMHI),GMHI比其它生态学指数(如香农(Shannon)多样性指数、物种丰富度等)能更好地区分健康和疾病,在区分健康组和非健康组方面,准确率为73.7%,可用于评价个体肠道微生物的健康状态[36]。基于92个微生物类群开发统计监测模型,并通过多研究队列和验证队列证明模型的有效性,证实了健康人群中健康指数(hiPCA)与香农多样性和物种丰富度显著相关ohiPCA可以个性化评估健康人群肠道状况,而疾病人群中,hiPCA与年龄、物种丰富度和功能冗余显著相关。hiPCA定义了健康肠道微生物的边界,且在健康人群中识别了不同的健康模式,并分析了各细菌对患病人群健康指数的贡献,从另一个角度给出了健康肠道微生物组的定义[37]。
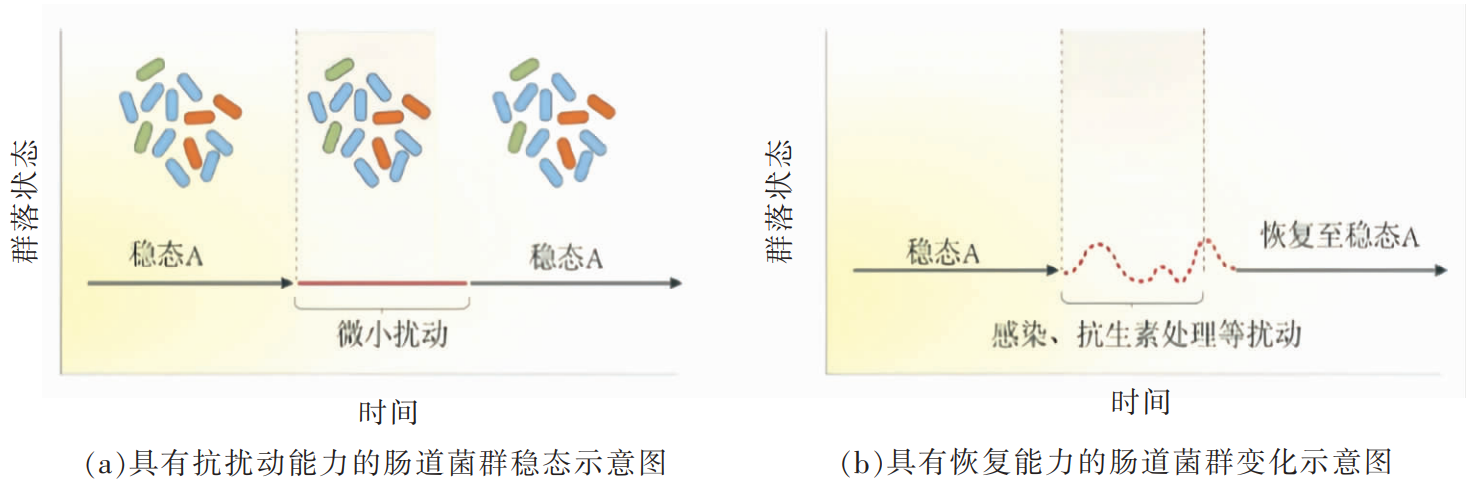
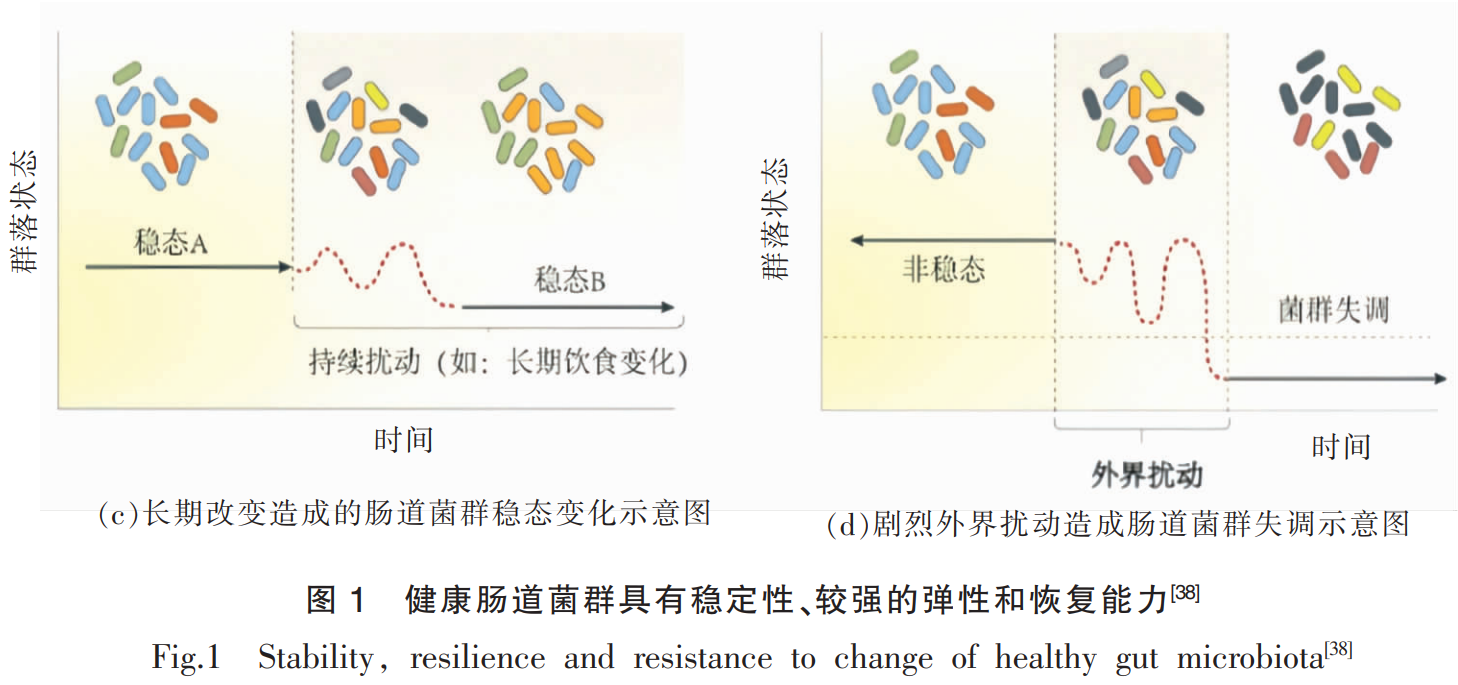
健康状态下,肠道菌群受到外界扰动后具有较强的弹性和恢复能力。人类肠道微生物组是一个复杂的生态平衡系统,一旦失衡就会导致肠道菌群功能的变化和微生物多样性显著下降,并由此影响代谢健康,从而导致疾病的发生[39]。因此,肠道菌群的弹性和恢复能力就显得尤为重要。在膳食丰富的现代社会,高脂膳食已成为常态,在短期内连续摄入高脂膳食后,会造成肠道菌群的短暂变化,而长期摄入高脂膳食则会导致个体肠道菌群的长期变化和个体的肥胖[43]。抗生素对肠道菌群的扰动更为强烈,研究表明,抗生素治疗后肠道菌群具有一定的恢复能力,而当基石物种较多时可以促进肠道菌群加速恢复[44]。因此,健康的肠道菌群在受到外界因素扰动时,应具有一定的弹性。当受到剧烈扰动时也应具有恢复能力,以此保证肠道微生态的稳定性,从而维持宿主健康。

3.3 肠道菌群失调的特征
临床研究发现,人体在不同疾病状态中,肠道菌群会发生变化,然而肠道菌群的失调与疾病之间的因果关系尚未有明确的定论。肠道菌群的失调主要体现在其丰度、组成与功能的显著变化,特别是有益菌群的大幅减少和病原微生物的增多,同时伴随着微生物多样性的明显降低[47-48]。这种非健康状态会逐渐对宿主产生不利影响,减弱医学干预或治疗的效果[39]。此外,微生物多样性的减少与维持菌群生态系统平衡的关键物种丧失密切相关,这进一步影响微生物组的弹性和恢复能力[49-50]。
肠道微生物组成的失衡与多种免疫和代谢性疾病的发生、发展密切相关,包括肥胖症、2型糖尿病、非酒精性脂肪肝和各类自身免疫性疾病[51](见表2)。肠道微生物组通过与宿主代谢过程的复杂互作,影响人体的整体健康状况及疾病的发展和进程[52]。


4 改善和调节肠道菌群的方法
膳食会直接影响肠道菌群的结构和多样性。研究表明,膳食是调节肠道微生物种类和数量的重要手段,例如膳食结构、益生菌、益生元、后生元等。膳食中的膳食纤维可促进肠道双歧杆菌、乳杆菌等有益微生物的代谢和增殖[68]。补充维生素(维生素A、维生素D和维生素E)则可增加肠道中双歧杆菌属和乳杆菌属等有益菌的相对丰度[69]。Xu等[70]发现摄入复合益生菌可显著降低与肠易激综合征发病相关的细菌丰度,如大肠杆菌和柠檬酸杆菌。菊粉[71]和低聚木糖[72]均被发现可以促进肠道中双歧杆菌、乳杆菌和毛螺菌科等有益菌丰度增加,抑制产气荚膜梭菌等有害菌的丰度。后生元则有助于肠道土著有益菌的生长[73]。在发生肠道菌群紊乱时,素食或杂食有利于代谢碳水化合物和氨基酸的厚壁菌生长,可使肠道快速恢复稳态[74],增强肠道菌群抵抗外界干扰的能力。
运动与良好睡眠也有助于建立健康肠道菌群。睡眠是一个复杂的节律性生理过程,睡眠与肠道菌群相互影响,睡眠片段化会引起肠道菌群多样性和结构显著改变,导致肠道菌群失调[75],高质量的睡眠可增加肠道微生物多样性[76]。同时,运动习惯也会直接影响肠道微生物。与非运动员相比,运动员肠道菌群α多样性更高且健康相关菌群富集,然而,不同类型的运动员的肠道菌群组成存在差异[77]。
此外,焦虑、抑郁等消极情绪也会导致肠道微生物多样性和结构的改变,尤其是肠道中普氏菌和毛螺菌属等细菌丰度的变化[78],而积极的情绪状态会增加肠道微生物的多样性[79]。因此,日常生活中可通过调整膳食模式,调节生活方式和情绪以及补充益生菌、益生元等,来维持肠道菌群的平衡。
5 小结与展望
综上所述,本文通过对人体肠道菌群主要特征的系统分析,经专家组多次讨论,形成以下共识:
1)肠道菌群的形成及其对宿主的影响是多种因素相互作用的结果
肠道菌群以其错综复杂的方式与宿主相互作用,不仅影响宿主胃肠道生理和消化功能,而且对人体血糖、血脂、免疫力和心理健康等方面也有作用。人体肠道菌群具有差异性和多样性,不仅受到宿主基因型、年龄、地理等因素的影响,也受到膳食结构、运动、睡眠等生活方式的影响。
2)特定菌种丰度及代谢物等可作为评价与调节肠道菌群的重要指标
高丰度的双歧杆菌被认为是婴儿肠道中“更健康”的指示性菌种。对于健康成年人,双歧杆菌和乳杆菌被认为是调节肠道菌群的目标菌种。肠道菌群的多样性和丰度,乙酸、丁酸等短链脂肪酸,以及肠道转运时间、排便频率、粪便形态等也常被作为人体健康肠道菌群的重要衡量指标。
3)健康肠道菌群对外来扰动具有较强的恢复能力与稳定性
健康人体的肠道菌群是复杂的微生态系统,存在的基石物种对肠道微生物的多样性和功能具有不可或缺的作用。肠道基石微生物的种类和丰度可作为评估人体健康的重要指标。人体在健康状态下,肠道菌群受到外界扰动后具有较强的弹性和恢复能力,以此保障肠道微生态的稳定性,从而维持宿主健康。
4)肠道菌群的失衡与人体免疫和代谢性疾病发生发展密切相关
人体肠道菌群的失衡主要体现在其丰度、组成与功能的显著变化,特别是有益菌群的大幅减少和病原微生物的增多,同时伴随着微生物多样性的明显减少。外界环境的扰动和宿主生理因素的变化等也可显著影响肠道菌群的弹性和恢复能力。肠道菌群的失衡与人体免疫和代谢性疾病发生发展密切相关,合理膳食、健康生活方式及补充益生菌等是调节肠道菌群的主要途径。
5)健康肠道菌群的精准识别与调控亟需多种新技术的集成与突破
目前对肠道菌群的研究主要是基于粪便样品的分析结果。由于这些样本无法完全代表胃肠道内的微生物菌群或黏膜微生物,因此,行业亟待突破肠道菌群样本采集技术,发展培养组学技术及人工智能与大数据集成等新技术,为健康肠道菌群的精准识别和调控提供更坚实的技术支撑。
项目组专家
陈卫 中国工程院院士、江南大学
邵薇 中国食品科学技术学会
何国庆 浙江大学
张和平 内蒙古农业大学
董英 江苏大学
顾青 浙江工商大学
艾连中 上海理工大学
刘兆平 国家食品安全风险评估中心
姚粟 中国食品发酵工业研究院
石汉平 首都医科大学附属北京世纪坛医院
陈伟 中国医学科学院北京协和医院
李在玲 北京大学第三医院
徐进 国家食品安全风险评估中心
钟瑾 中国科学院微生物研究所
李理 华南理工大学
金苏 IFF健康事业部
云战友 内蒙古伊利实业集团股份有限公司
马杰 北京科拓恒通生物技术股份有限公司
毛跃建 内蒙古蒙牛乳业(集团)股份有限公司
方曙光 微康益生菌(苏州)股份有限公司
程锡安 诺维信一康生物科技(上海)有限公司
周世伟 乐斯福管理(上海)有限公司
共同执笔人
张国华 山西大学
翟齐啸 江南大学
孙志宏 内蒙古农业大学
张家超 海南大学
赵飞燕 内蒙古农业大学
刘月 山西大学
陈铮 中国食品科学技术学会
罗江钊 中国食品科学技术学会
















链接:http://www.lewenyixue.com/2024/10/15/%E4%BA%BA%E4%BD%93%E8%82%A0%E9%81%93%E8%8F%8C%E7%BE%A4%E4%B8%BB%E8%A6%81%E7%89%B9%E5%BE%81%E7%9A%84%E4%B8%93%E5%AE%B6%E5%85%B1%E8%AF%86/