Nat Immu | 卵巢癌免疫逃逸的空间组织和细胞调节因子
撰文: M. B.
IF=27.7
推荐度: ⭐⭐⭐⭐⭐
亮点:
1 、对 HGSC 患者样本进行单细胞分辨率的 RNA 原位成像,揭示了肿瘤异质性。
2 、初始 T 细胞的中心调节因子抑制 CD8 +T 细胞对恶性肿瘤细胞的化学吸引。
3 、 M TIL 的表达可基本在各类癌症中预测 ICB 的临床反应,且优于其他 ICB 反应标志物。
近日,美国斯坦福大学医学院的 Livnat Jerby 教授 团队在《 Nature immunology 》杂志上发表了名为“ Mapping spatial organization and genetic cell-stateregulators to target immune evasion in ovarian cancer ”的文章。

多细胞失调在癌症的启动和进展中具有重要功能。细胞和动物模型在鉴定中枢免疫抑制因子方面发挥了重要作用,并在癌症治疗方面取得了重大突破。然而,许多癌症患者对目前的免疫疗法仍没有反应。因此,目前仍然缺乏肿瘤组织的等效图谱来准确研究多细胞动力学和免疫过程。其次,确定细胞状态和细胞间相互作用的调节因子是一个挑战,需要在更大的组合基因 - 环境扰动搜索空间中进行功能询问。
输卵管高级别卵巢浆液性癌( HGSC ,卵巢癌最常见和最具侵袭性的形式)患者确诊时往往已属晚期,且易产生化疗耐药,导致 5 年生存率在 50% 以下。 HGSC 的遗传学已被充分表征,普遍存在 TP53 突变和大量拷贝数改变( CNAs )。此外,丰富的肿瘤浸润淋巴细胞( TILs )是 HGSC 阳性患者的临床预后标志物。然而,促进 / 抑制 HGSC 免疫募集和浸润的分子和细胞模式尚不清楚,且现有免疫治疗的成功率仍然有限。
在本文,作者提供了 HGSC 空间组织的分子图谱,结合数据驱动的实验设计和高内涵的 CRISPR 筛选,作者系统地研究了 HGSC 肿瘤免疫的调节因子,以及影响它的遗传和药理学扰动。
1 、 HGSC 的单细胞空间转录组图谱
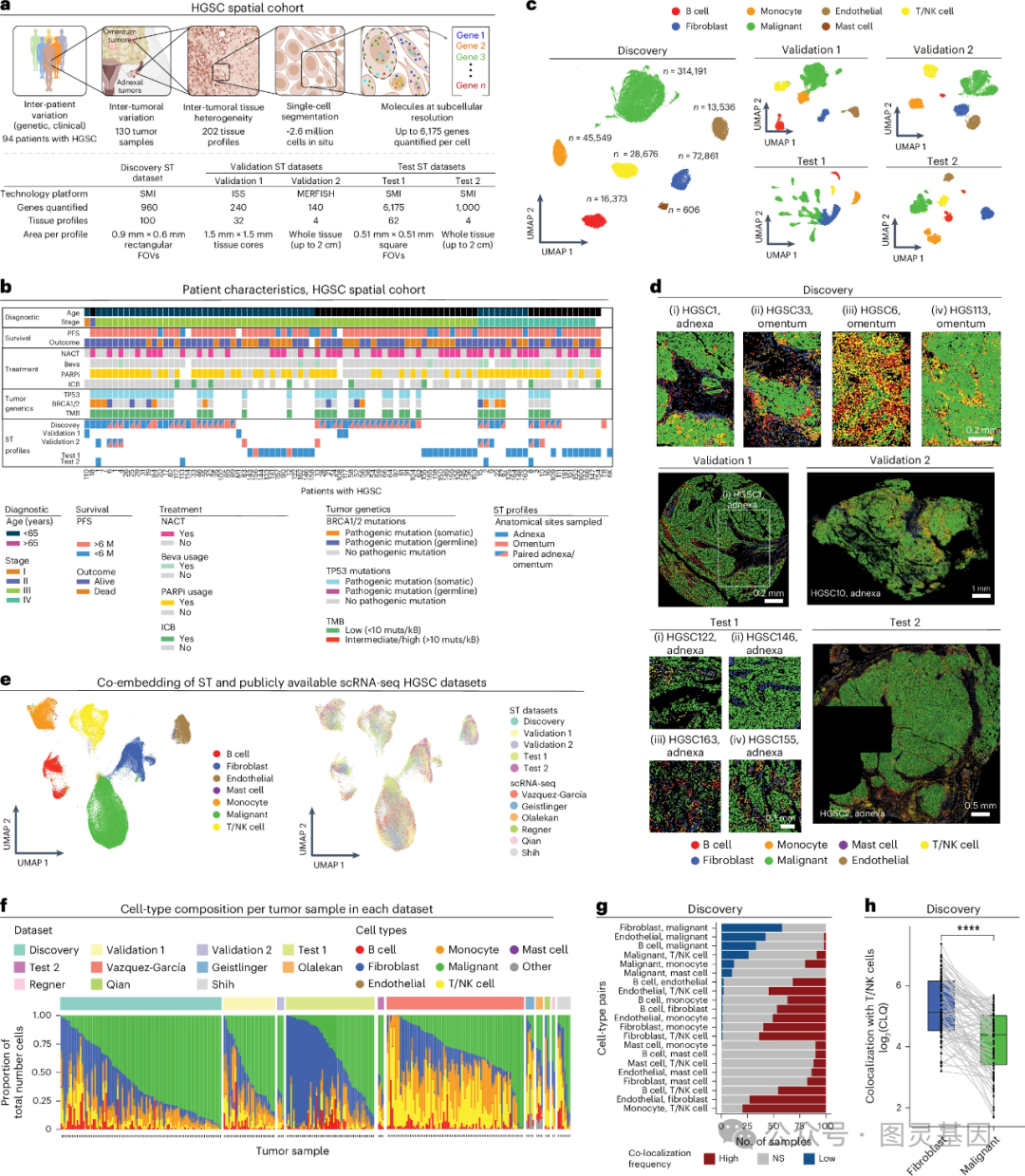
为了对 HGSC 进行空间定位, 作者使用单细胞分辨率的 RNA 原位成像技术对 94 例患者的 130 个 HGSC 肿瘤进行了成像,生成了 202 个组织图谱和 2,598,277 个高质量的单细胞空间转录组数据。 对细胞进行分割后鉴定出恶性细胞、 T 细胞和自然杀伤( NK )细胞、 B 细胞、单核细胞、肥大细胞、成纤维细胞 / 基质细胞和内皮细胞群, T/NK 细胞可进一步分层为 NK 、 CD4 + T 、 CD8 + T 和调节性 T 细胞( T reg )。
作者发现在恶性细胞中,基因表达具有患者特异性 , 42% 的基因表达与其 CNAs 匹配(即“顺式”),而在非恶性细胞中仅为 0-2% ;与显示相关性的基因相比,在恶性细胞中未显示顺式 RNA-to-CNAs 相关性的基因拷贝数明显更稳定;与 CNAs 相反,在恶性和非恶性细胞中,相对较少数量的基因与临床和其他遗传变量相关。
数据的初步分析揭示了患者间的肿瘤异质性。然而在宏观水平上是一个可推广的空间组织,恶性细胞和成纤维细胞在空间上形成不同的隔室(恶性和基质隔室),使 T/NK 细胞优先定位于基质而不是恶性室。 T/NK 细胞丰度较高的患者的临床结局改善,证明即使肿瘤内相对较小的区域也可预测 5 年甚至 8 年后的患者结局。
2 、 T 细胞状态反映了 T 细胞肿瘤浸润状态
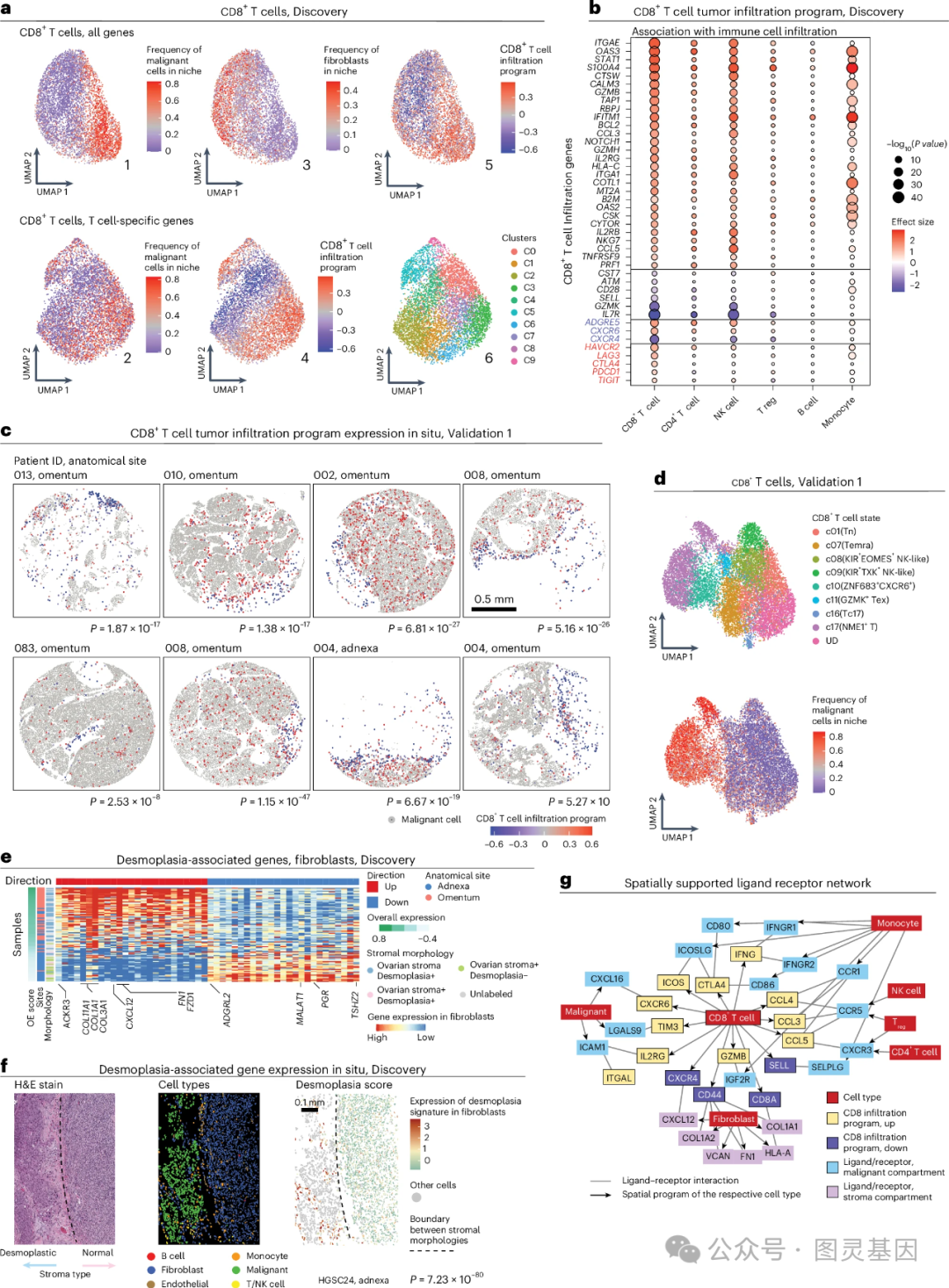
作者使用数据集绘制了标记免疫浸润的细胞内在和外在因素。确定了 5 种免疫细胞亚型中的每一种,在数据中强有力地代表了肿瘤浸润程序( TIP )。 CD8 +T 细胞 TIP ( CD8 TIP )表明效应和耗尽的 CD8 +T 细胞更频繁地与恶性细胞共定位。 CD8 TIP 上调基因包括效应细胞毒性基因,下调基因包括初始和记忆 T 细胞标志物。此外, CD8 TIP 与患者诊断时的年龄和疾病分期无关,但在新辅助治疗后的样本中表现出较低的表达水平。
为了研究基质与效应 T 细胞和耗竭 T 细胞相比,与初始 T 细胞和记忆 T 细胞共定位的作用,作者将测序数据与 H&E 染色整合,揭示了两个成纤维细胞亚群,一个标记正常基质,另一个标记结缔组织增生(即成纤维细胞和细胞外基质的肿瘤相关)。 正如预期的那样,促结缔组织增生性成纤维细胞不仅过表达胶原纤维组织和细胞外基质基因,同时也上调了 CXCL12 (基质细胞衍生因子,促进肿瘤增殖和转移)的表达,并与 T/NK 细胞富集有关。
为了将这些发现与旁分泌信号联系起来,作者使用三个公共资源汇编了 2,678 个配体 - 受体对。对 CD8 + T 细胞鉴定出了 24 个配体 - 受体对,其中 CXCR6 - CXCL16 ( CD8 + T 细胞 - 恶性肿瘤细胞)和 CXCR4 - CXCL12 ( CD8 + T 细胞 - 成纤维细胞)的共定位分别标记恶性和基质隔室中 CD8 + T 细胞的化学吸引。 值得注意的是, TCF1 的表达( CD8 TIP 中下调)直接抑制 CXCR6 的表达( CD8 TIP 中上调),表明初始 T 细胞的中心调节因子抑制 CD8 +T 细胞对恶性肿瘤细胞表达的 CXCL16 的化学吸引。
3 、 M TIL 表达可预测 ICB 的临床反应
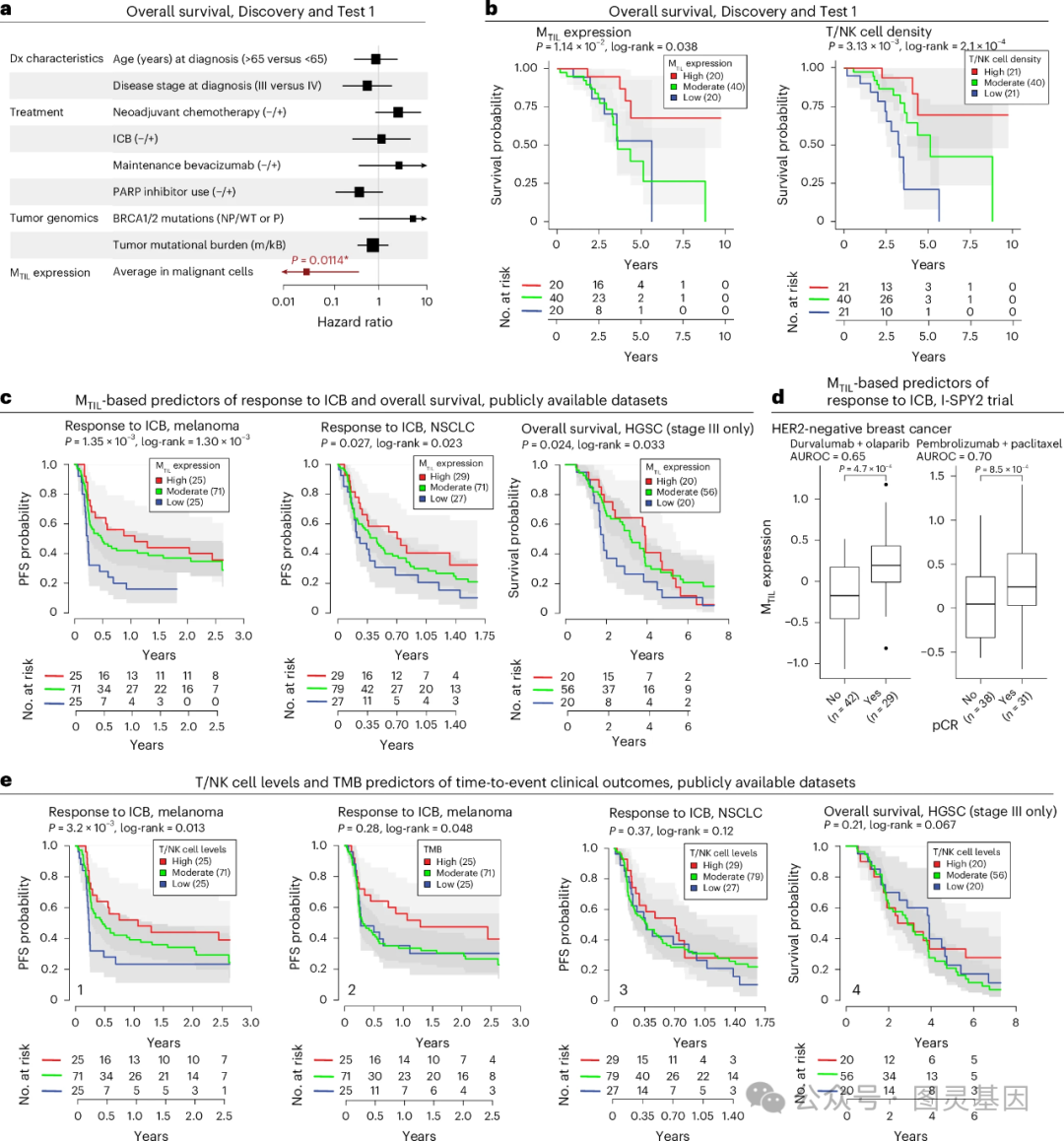
绘制 T/NK 细胞在恶性隔室内的空间分布图发现 TIL 优先与恶性细胞的一个亚群共定位。虽然恶性细胞状态具有高度的患者特异性,但作者发现 TIL 位置和恶性细胞基因表达之间的联系在异质性肿瘤中反复出现。 作者使用数据集确定了一个恶性转录程序,强有力地标记 TIL 的存在( M TIL 程序)。 该程序由 100 个上调和 100 个下调基因组成,其在恶性细胞中的表达与 T/NK 细胞浸润呈显著正 / 负相关。
基因富集分析证明了 M TIL 与免疫逃逸之间的联系。 M TIL 上调基因包括趋化因子、氧化应激基因和多个免疫反应基因。值得注意的是 LGALS9 (编码半乳糖凝集素 9 ,免疫检查点 TIM3 的配体)在浸润的 T/NK 细胞中上调。 作者假设较高的 M TIL 表达可能代表更多的免疫原性恶性细胞状态,因此可以预测 HGSC 和其他类型癌症对免疫检查点阻断( ICB )的临床反应。 作者在 ICB 治疗前的其他类型癌症的肿瘤样本中集中证实了这一假设。
M TIL 程序总体表达评分可预测作者检测的 5 个队列中 4 个队列的 ICB 反应,包括黑色素瘤队列、非小细胞肺癌队列和两个独立的 HER2 阴性乳腺癌队列。在尿路上皮癌队列中, M TIL 评分和程序性死亡配体 1 ( PD-L1 )水平均不能预测临床缓解。 总的来说, M TIL 的预测性能在各种类型癌症中相当,甚至优于其他 ICB 反应标志物。
4 、 M TIL 使癌细胞对 T/NK 细胞毒性敏感
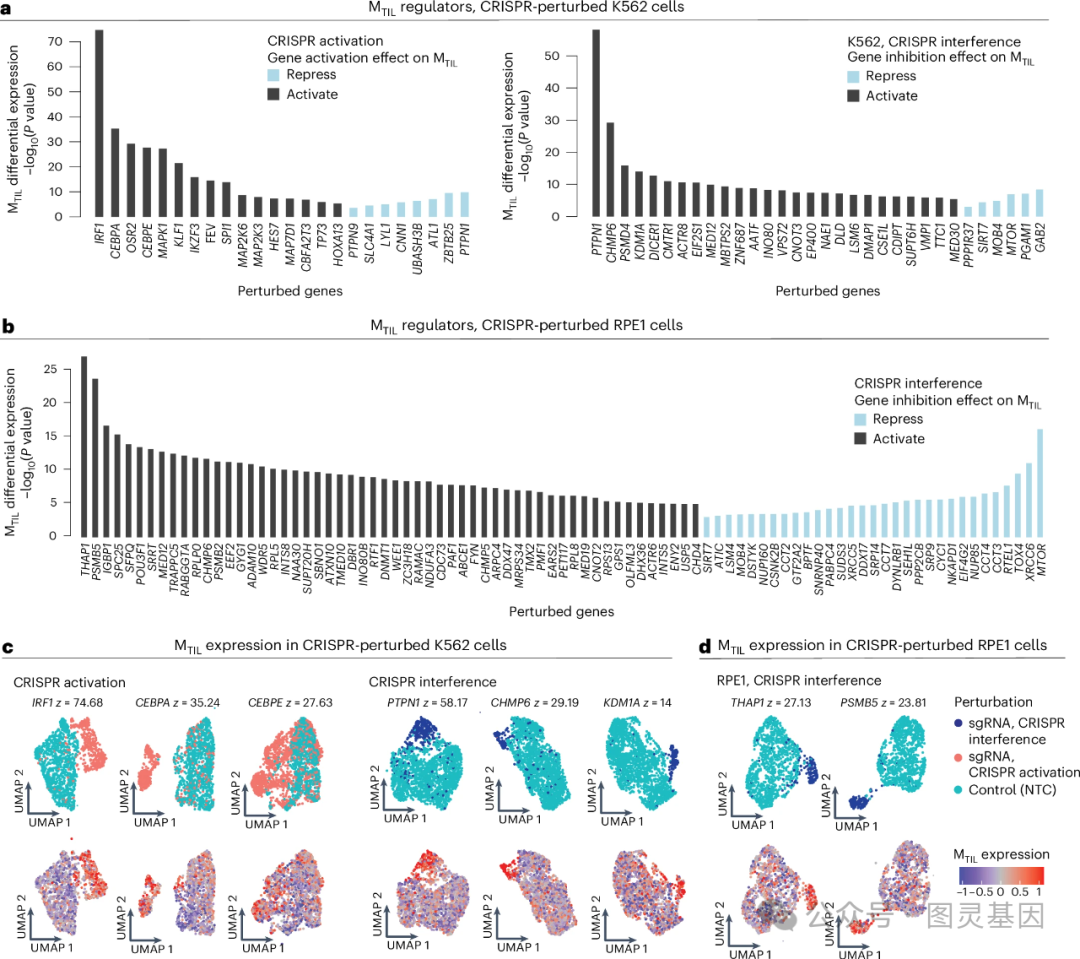
鉴于作者的发现和以前的研究, M TIL 所代表的基因和通路已被证明在抗肿瘤免疫反应中具有重要功能, 作者假设 M TIL 不仅反映恶性肿瘤细胞对 TIL 的反应,也是一种内在调节的恶性肿瘤细胞状态,影响 TIL 介导的肿瘤控制。 为了检测 M TIL 程序基因对卵巢癌细胞和对淋巴细胞毒性反应的影响,作者在卵巢癌细胞中进行了 CRISPR 敲除筛选,这些细胞或单一培养或与细胞毒性 T 淋巴细胞( CTL )共培养。
使用已发表的 Perturb-seq 数据(结合了 CRISPR-Cas9 基因编辑技术和单细胞 RNA 测序技术),作者确定了 43 和 104 个扰动,分别导致 M TIL 程序的显著更高或更低的表达。 这里鉴定出的顶级负调控因子是 PTPN1 。 基于这些发现,作者设计了 74 个 M TIL 基因和调控因子的合并敲除筛选,以测试它们在卵巢癌细胞中的功能。 在适应性和先天性免疫选择压力下,作者结合 Perturb-seq 读数绘制了遗传扰动适应图,确定了激活 / 抑制 M TIL 程序的扰动。
为了检测 M TIL 抑制因子的抑制是否显著影响基于免疫的癌细胞消除,作者生成了 PTPN1 基因敲除卵巢癌细胞系。 PTPN1 基因敲除使癌细胞对 T/NK 细胞介导的细胞死亡敏感。 针对 NK 细胞介导的杀伤作用, 作者还在卵巢癌细胞系中检测了 PTPN1/PTPN2 抑制剂( ABBV-CLS-484 )的作用。该药物对单培养的细胞活力影响极小,但导致 NK 细胞对卵巢癌细胞的杀伤大幅增加。
总之,在本文,作者提供了 HGSC 肿瘤的全面空间映射,揭示了这些侵袭性和遗传不稳定性肿瘤中组织和淋巴细胞浸润的原理。 作者的研究从细胞和组织水平上证明了体细胞遗传畸变、恶性转录失调和免疫逃逸之间的联系,为除去 HGSC 患者抗肿瘤免疫反应的障碍以及去抑制 HGSC 癌症免疫原性的新线索提供了新的视角。
教授介绍

Livnat Jerby 教授 ,斯坦福大学遗传学系助理教授。 Livnat Jerby 的研究重点是驱动疾病发生和治疗的多细胞过程,特别是在免疫学背景下。结合基因工程、机器学习和单细胞 / 空间基因组学, Livnat Jerby 团队研究了癌细胞与细胞毒性淋巴细胞之间的相互作用,开发了新的多学科方法来鉴定细胞和组织免疫原性的调节因子,并揭示了控制淋巴细胞活化 / 抑制、募集和浸润的机制。
参考文献
Yeh CY et al. “Mapping spatial organization and genetic cell-stateregulators to target immune evasion in ovarian cancer” Nat Immunol. Aug 23 2024. doi: 10.1038/s41590-024-01943-5.
链接:http://www.lewenyixue.com/2024/10/15/Nat%20Immu%20%7C%20%E5%8D%B5%E5%B7%A2%E7%99%8C%E5%85%8D%E7%96%AB%E9%80%83%E9%80%B8%E7%9A%84%E7%A9%BA/