髓母细胞瘤是婴幼儿、儿童和年轻人中最常见的恶性脑肿瘤,来源被认为是小脑发育中关键的干细胞群体。过去20年,髓母细胞瘤的基因组学和分子特征分析领域取得了积极进展,把它分成了四个主要的分子亚型:WNT亚型、Sonic Hedgehog(SHH)亚型、第3型和第4型,每个亚群都有不同的驱动突变、基因表达谱和患者生存预后。
目前髓母细胞瘤的标准治疗选择并不多,手术、化疗和放疗联合使用大大提高了髓母细胞瘤患者的生存率,但也带来了显著的远期副作用,同时,有20~30%的高危复发患者依然无法治愈。对于这些无法治愈的高危患者,我们迫切需要开发更新更安全、并且针对不同亚型患者的个性化新疗法。免疫疗法,包括细胞疗法是一种有前景的肿瘤治疗方法,成功改善了很多癌症患者的生存率,减少了复发比例。但免疫细胞疗法在儿童实体瘤中成功案例很少,在髓母细胞瘤中更是空白。为了推动髓母的免疫细胞疗法,首先就必须找到合适的肿瘤抗原。虽然髓母细胞瘤的基因突变报道已经不少,但这些基因突变是否能引起免疫反应并激活免疫细胞,是否是合适的细胞治疗靶点目前仍然未知。
近期,美国佛罗里达大学的 Duane A. Mitchel l 教授团队在 Genome Medicine 上发表题为 Identification of tumor rejection antigens and the immunologic landscape of medulloblastoma 文章。 作者通过对不同亚型髓母细胞瘤的分析,发现虽然髓母整体在免疫学上属于“冷”肿瘤,但也能表达多种性质的免疫抗原,而且不同的髓母亚型也显示出独特的免疫细胞特征。

该研究首先开发了一套叫“开放阅读框抗原分析,Open Reading frame Antigen aNalysis (O.R.A.N)”的生物计算平台,然后把170例髓母细胞瘤的基因突变和转录组数据等放入其中分析。
和以前研究发现的一致,四种亚型的髓母细胞瘤肿瘤突变负荷都偏低,每个患者平均只有15个突变,而且几乎没有融合类突变。
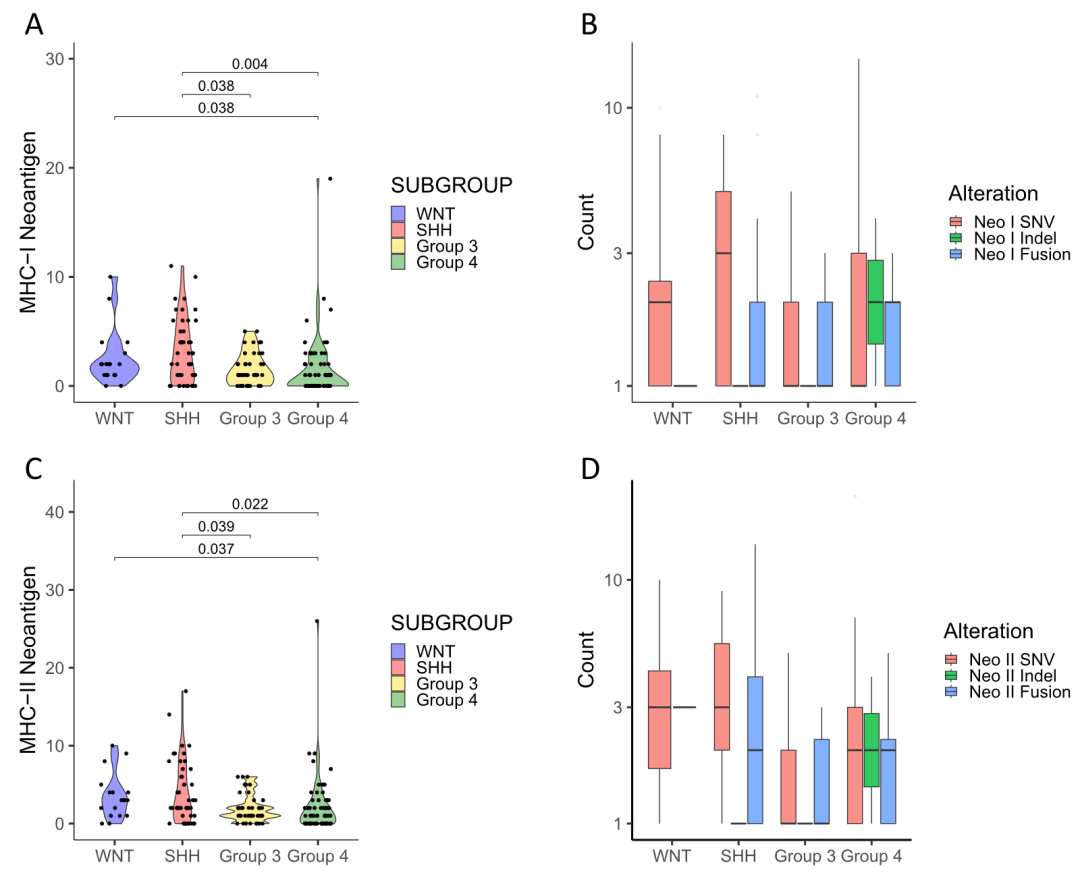
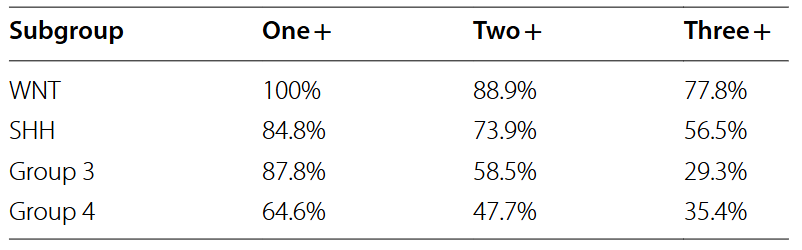
作者随后预测分析了肿瘤的新抗原数量。整体来看,所有的WNT亚型肿瘤(100%)和大多数第3型(87.8%)以及SHH亚型(84.8%)的肿瘤都至少表达了一种新抗原,但只有64.6%的第4型肿瘤表达了新抗原。但同时表达3个以上新抗原的肿瘤比例并不算高,大约77.8%的WNT亚型和56.5%的SHH亚型表达了3个以上的新抗原,而第3型和第4型的这个比例则分别只有29.3%和35.4%。总体而言,在所有患者肿瘤中,总共鉴定出3018个突变(包括SNV和插入缺失突变),其中390个具有免疫原性(占12.9%),所占比例并不高。
除了新抗原以外,作者也关注了肿瘤相关抗原(TAA)。肿瘤相关抗原是一类在肿瘤中高度表达,但在正常组织中表达低或几乎不表达的抗原,它们在肿瘤的启动和发展过程中起着重要作用。
作者利用O.R.A.N流程预测了已知有免疫原性的肿瘤相关抗原,发现所有WNT亚型肿瘤(100%)和大多数第3型(97.6%)及第4型(98.5%)的肿瘤都至少表达了一种TAA,但只有60.9%的SHH亚型表达了免疫原性TAA。同时,大约88.9%的WNT亚型、80.5%的第3型和67.7%的第4型表达了三种或更多TAA,而SHH亚型这个比例仅有34.8%。总体而言,在所有肿瘤中,共鉴定出143个免疫原性TAA,给后续免疫治疗开发提供了大量潜在靶点。
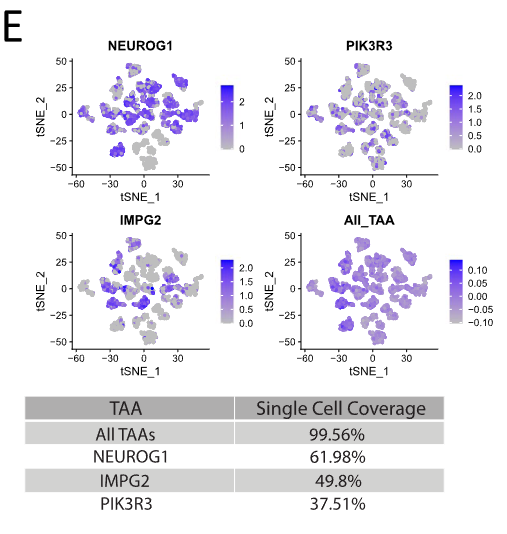
通过和正常脑组织基因表达分析的比较,排名前三的免疫原性TAA是NEUROG1,IMPG2 , 和PIK3R3。NEUROG1在所有亚型髓母细胞的肿瘤中都有表达,但是并非每个患者肿瘤中的所有细胞都表达这个基因。整体来看, 61.98%的髓母细胞表达 NEUROG1,而IMPG2和PIK3R3的表达率稍低一点,分别为49.8%和37.51%。
为了评估这些抗原是否能被髓母细胞瘤有效呈递到表面,作者分析了这些肿瘤中参与抗原加工和呈递通路的基因表达情况。与其他三个亚型相比,第3型髓母细胞瘤的抗原加工和呈递通路被显著下调。进一步分析发现,第3型髓母细胞瘤主要通过下调MHC-II的表达而关闭了抗原呈递通路信号。其他亚群的MHC-II通路没有显著变化,但第4类肿瘤与MHC-I表达相关基因有下调,说明MHC-I下调也是髓母细胞瘤潜在的免疫逃逸机制。
最后,作者对髓母细胞瘤的转录组数据进行分析,揭示了髓母细胞瘤的免疫全景图。分析显示,免疫浸润细胞特点和髓母细胞瘤的分子亚型密切相关。与第3型和第4型相比,WNT和SHH亚型肿瘤中的髓源性免疫细胞(比如树突状细胞和单核细胞)以及B细胞的上调更为明显。这与此前的研究一致。调节性T细胞(Treg)在所有髓母细胞瘤中都高度富集,但在WNT和SHH亚型中的富集程度要高于另外两种亚型。
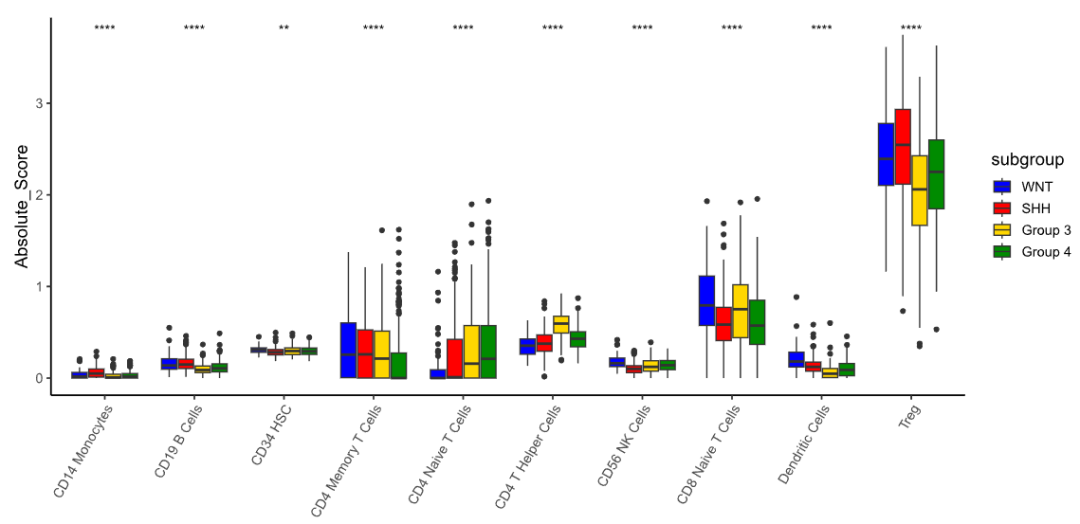
总之,在这项对髓母细胞瘤的抗原和免疫图景研究中, 作者通过使用抗原预测工具O.R.A.N,发现了髓母细胞瘤患者表达多种免疫原性抗原,其中一部分是多个肿瘤共有的。这些抗原可以作为潜在的治疗靶点,用于免疫治疗开发。 无论靶向髓母细胞瘤单一的特异抗原,还是靶向多个肿瘤的共享抗原,都具备进一步研究价值,这项研究对于开发针对髓母细胞瘤抗原免的疫疗法具有重要意义。
撰文

责编

制作
排版 | Sheila 校对 | uu
▼滑动查看更多▼
Background: The current standard of care treatments for medulloblastoma are insufficient as these do not take tumor heterogeneity into account. Newer, safer, patient-specific treatment approaches are required to treat high-risk medulloblastoma patients who are not cured by the standard therapies. Immunotherapy is a promising treatment modality that could be key to improving survival and avoiding morbidity. For an effective immune response, appropriate tumor antigens must be targeted. While medulloblastoma patients with subgroup-specific genetic substitutions have been previously reported, the immunogenicity of these genetic alterations remains unknown. The aim of this study is to identify potential tumor rejection antigens for the development of antigen-directed cellular therapies for medulloblastoma.
Methods: We developed a cancer immunogenomics pipeline and performed a comprehensive analysis of medulloblastoma subgroup-specific transcription profiles (n = 170, 18 WNT, 46 SHH, 41 Group 3, and 65 Group 4 patient tumors) available through International Cancer Genome Consortium (ICGC) and European Genome-Phenome Archive (EGA). We performed in silico antigen prediction across a broad array of antigen classes including neoantigens, tumor-associated antigens (TAAs), and fusion proteins. Furthermore, we evaluated the antigen processing and presentation pathway in tumor cells and the immune infiltrating cell landscape using the latest computational deconvolution methods.
Results: Medulloblastoma patients were found to express multiple private and shared immunogenic antigens. The proportion of predicted TAAs was higher than neoantigens and gene fusions for all molecular subgroups, except for sonic hedgehog (SHH), which had a higher neoantigen burden. Importantly, cancer-testis antigens, as well as previously unappreciated neurodevelopmental antigens, were found to be expressed by most patients across all medulloblastoma subgroups. Despite being immunologically cold, medulloblastoma subgroups were found to have distinct immune cell gene signatures.
Conclusions: Using a custom antigen prediction pipeline, we identified potential tumor rejection antigens with important implications for the development of immunotherapy for medulloblastoma.
DOI: 10.1186/s13073-024-01363-y
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/09/12/Genome%20Medicine%EF%BD%9C%E9%AB%93%E6%AF%8D%E7%BB%86%E8%83%9E/













赶快来坐沙发