【BCJ】CAR-T相关噬血细胞性淋巴组织细胞增生症的临床表现、结局和治疗
噬血细胞性淋巴组织细胞增生症(HLH)是CAR-T治疗的罕见并发症。随着CAR-T疗法在血液系统恶性肿瘤治疗中的应用越来越多,CAR-T相关HLH (carHLH)也越来越被人们所认识。尽管罕见,但根据基础疾病、患者群体和CAR-T产品的不同,报道的发生率从1-3%到35%不等。最近ASTCT发布了指南,将CAR-T治疗中的HLH定义为免疫效应细胞相关HLH样综合征(IEC-HS)。
《Blood Cancer Journal》近日发表文章,详细描述了梅奥诊所发生carHLH的成年患者的临床表现、治疗策略和结局,通讯作者为Yi Lin教授。

诊断carHLH需基于实验室和临床标准,本文的标准改编自HLH诊断标准,以及先前报道的CAR-T细胞治疗后的HLH系列。该标准由梅奥诊所的细胞治疗组审查并批准,包括铁蛋白峰值水平>10000 ng/L和以下标准中至少2个:[1]肝功能受损,包括胆红素>3x正常值上限(ULN)或基线,或转氨酶>5xULN或基线;[2]肾功能受损,包括少尿或肌酐>3xULN或基线;[3]≥3级肺水肿或缺氧;[4]存在器官形态和/或CD68免疫组化的噬血细胞症,[5]新的或不明原因的≥3级血细胞减少症;[6]新发≥3级酸血症,需要干预且无法归因于其他诱因。
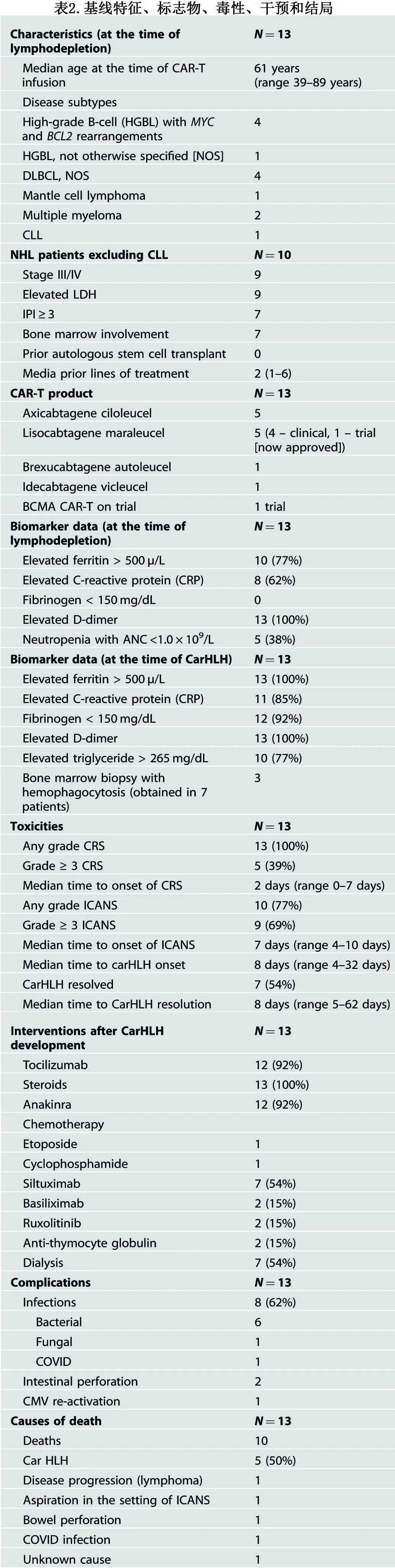
436例CAR-T细胞治疗受者中,有 13例(3%)符合carHLH标准。CAR-T输注时患者的中位年龄为61岁(39-89岁)。基础疾病包括MYC和BCL2重排高级别B细胞淋巴瘤(HGBL)(n=4)、HGBL-非特指型[NOS]( n=1)、弥漫性大B细胞淋巴瘤(n=4)、套细胞淋巴瘤(n=1)、慢性淋巴细胞白血病(CLL)(n=1)和多发性骨髓瘤(MM)(n=2)。
NHL患者(不包括CLL)中,90%(9/10)为晚期,LD时LDH升高,70%(7/10)为高危IPI(表2)。10例NHL患者中有8例需要桥接治疗,其中75%(6/8)需要化疗。在NHL队列中,CAR-T产品包括axicabtagene ciloleucel (n=5)、lisocabtagene maraleucel(n=4)和brexucabtagene autotolucel(n=1)。两例MM患者在LD时均为IgG κ型、细胞遗传学高危、骨髓受累>90%。一例MM患者接受ideecabtagene vicoleucel(既往治疗6线),另一例患者在临床试验中接受抗BCMA CAR-T治疗。
所有患者均出现CRS,其中39%(5/13)的CRS为≥3级。 CAR-T治疗至CRS发作的中位时间为2天(0-7天),晚于既往报道。10例(77%)患者出现ICANS,其中9例≥3级。 CAR-T后产生ICANS的中位时间为7天(4-10天),晚于既往报道。从CAR-T到carHLH发作的中位时间为8天(4-32天)。 7例(54%)患者carHLH痊愈,至痊愈的中位时间为8天(5-62天)。 13例患者中有8例(53%)的carHLH与CRS呈连续发生,而另外5例患者在CRS消退还有发生。
92%(12/13)的carHLH患者使用托珠单抗,中位给药3次(1-4)。所有患者接受类固醇治疗,中位持续时间为14天(5-56天)。 92%(12/13)的患者使用Anakinra,中位持续时间为7天(3-74天)。2例接受化疗,依托泊苷和环磷酰胺各1例;carHLH均未痊愈。 7例患者使用司妥昔单抗,其中3例carHLH痊愈。2例患者使用抗胸腺细胞球蛋白和JAK2抑制剂芦可替尼。2例患者使用IL-2受体阻断抗体Basiliximab,其中1例HLH消退。 54%(7/13) 的患者因新发酸血症和/或细胞因子清除而开始连续性静脉-静脉血液透析 (CVVH),中位持续时间为4天(1-6)。一例患者开始使用体外细胞因子吸附剂。 7例需要CVVH的患者中有3例carHLH消退。5例患者(38%)需要血管加压素支持,中位使用时间为4天(2-5天)。8例(62%)患者在发生carHLH后出现感染性并发症,但在carHLH发病前无一例发生。7例患者中只有2例感染恢复,并在最后一次随访时存活(表2)。10例carHLH患者(77%)在数据截止时死亡,死亡原因包括carHLH(n=5)、进行性淋巴瘤(n=1)、神经毒性相关吸入性事件(n=1)、肠穿孔导致脓毒性休克(n=1)、COVID感染(n=1)和未知原因(n=1)。对于因carHLH死亡的患者,从CAR-T到死亡的中位时间为27天(11-49)。9/13例患者在第30天时缓解,包括完全缓解(CR) 7例(54%)和部分缓解2例(15%);其余患者均于第30天评估前死亡。

carHLH的诊断仍极具挑战性,原因在于症状和实验室异常与CRS重叠,或由于疾病本身和先前治疗而存在实验室异常。由于缺乏数据,最近制定的IEC-HS指南是基于专家意见的,而该研究中的诊断标准确实与其重叠。除托珠单抗和类固醇外,CRS和carHLH的管理尚未得到很好的概述。Anakinra是最常见的干预措施。化疗是原发性HLH的主要治疗方法,但在carHLH报告中并不常用;两例接受依托泊苷和环磷酰胺治疗的患者无carHLH痊愈,且随后都出现感染。患者还使用了司妥昔单抗和芦可替尼,前者用于托珠单抗治疗后IL-6仍持续升高的患者,7例中3例carHLH痊愈。体外血液净化疗法最近在严重CRS和carHLH中引起兴趣。此外,持续的肾脏替代治疗可以帮助纠正严重CRS和carHLH期间遇到的电解质、酸碱和液体紊乱,促进肾脏恢复并预防危及生命的并发症。早期使用CVVH有助于减轻carHLH相关的表现和并发症,并缩短免疫抑制的持续时间。本文中感染并发症的显著增加可能与医源性免疫抑制有关;虽然感染本身可能是继发性HLH的驱动因素,特别是病毒感染(如EBV或CMV),但患者在carHLH发病前都未诊断出感染。
总之,carHLH是一种罕见(3%)但危及生命的CAR-T并发症。该研究是接受抗CD19或BCMA CAR-T治疗的NHL、MM和CLL患者中最广泛的真实世界carHLH系列(之前两篇报道都是针对B-ALL中CD22和CD19 CAR-T的儿科人群)。早期识别和及时干预对于解决carHLH和预防致命后果至关重要。需要更大规模的研究来制定循证指南。为实现最佳管理,需要具有管理此类危重病人专业知识的多学科团队合作。
参考文献
Khurana, A., Rosenthal, A.C., Mohty, R. et al. Chimeric antigen receptor T-cell therapy associated hemophagocytic lymphohistiocytosis syndrome: clinical presentation, outcomes, and management. Blood Cancer J. 14, 136 (2024). https://doi.org/10.1038/s41408-024-01119-2
链接:http://www.lewenyixue.com/2024/08/30/%E3%80%90BCJ%E3%80%91CAR-T%E7%9B%B8%E5%85%B3%E5%99%AC%E8%A1%80%E7%BB%86%E8%83%9E%E6%80%A7%E6%B7%8B%E5%B7%B4%E7%BB%84/







赶快来坐沙发