Cancer Res | 复旦大学李大强/邵志敏发现促进三阴性乳腺癌进展的调控新机制
根据《全球癌症统计2020》,乳腺癌是女性癌症相关死亡的常见原因。 三阴性乳腺癌(TNBC)是乳腺癌的一个特定亚型,其特点是缺乏雌激素受体、孕激素受体和人表皮生长因子受体2(HER2)的表达。在所有乳腺癌类型中,TNBC的临床预后最差,因为它表现出侵袭性表型、高早期复发率和远处转移率,并且对内分泌治疗或HER2靶向治疗无效。然而,TNBC进展的机制尚不清楚。 因此,鉴定TNBC中的失调基因,并阐明其功能和分子机制,对于治疗TNBC至关重要。
转录是基因组的直接解读,是解码DNA序列的第一步。 转录失调是癌症的典型特征,许多转录调控因子参与肿瘤进展。下调转录1(DR1)相关蛋白1(DRAP1)是核转录因子Y亚基β转录因子家族的成员,包含一个TATA结合蛋白(TBP)结合域、一个组蛋白折叠基序和一个富含谷氨酸/丙氨酸的结构域。DRAP1通过其组蛋白折叠基序与DR1结合形成负调控因子2(NC2)复合体。 异源二聚体形成后,NC2通过TBP结合域结合于靶基因启动子序列的TATA盒上的TBP,从而形成NC2–TBP–DNA复合体,这可以阻止一般转录因子的结合和前起始复合体的形成,从而抑制靶基因的转录。
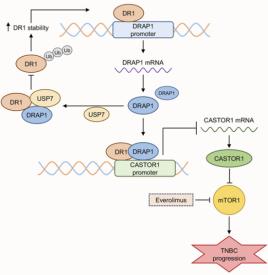
模式机理图(图片源自 Cancer Research )
最近,DRAP1在多种人类癌症中,包括乳腺癌,被报道为上调,并且通过机器学习算法和微阵列分析与结直肠癌和血管肉瘤的化疗反应相关,这表明DRAP1可能在癌症进展和治疗中发挥重要作用。已有研究初步证明了DRAP1在癌症增殖中的作用。 然而,DRAP1在乳腺癌,特别是在TNBC中的具体作用和机制尚不清楚。
mTOR1信号通路在癌症中常常被激活或突变,并影响癌细胞的关键活动。 细胞质中的精氨酸传感器mTORC1亚基1(CASTOR1)是一个新发现的精氨酸传感器,能够根据精氨酸状态调节mTOR1活性。然而,由于mTOR信号在癌细胞中持续激活,它可能具有独立于精氨酸的替代机制来调节CASTOR1的表达和功能。
在这项研究中,作者评估了DRAP1在TNBC组织及配对的正常组织中的表达及其预后价值。 作者使用了几种细胞和动物模型来检测DRAP1在TNBC进展中的作用,并通过分子和生物实验探讨了其作用机制。 此外,作者还进行了体外和体内实验,以阐明DRAP1在TNBC治疗中的价值。
参考消息:
https://doi.org/10.1158/0008-5472.CAN-23-2781
— END—
链接:http://www.lewenyixue.com/2024/08/30/Cancer%20Res%20%7C%20%E5%A4%8D%E6%97%A6%E5%A4%A7%E5%AD%A6%E6%9D%8E%E5%A4%A7%E5%BC%BA/






赶快来坐沙发