Sci Adv丨暨南大学陈良/丁克/周倩发现CD137激动剂JNU-0921有效缩小肿瘤的作用机理
研究表明,针对CD137的激动剂抗体可通过激活T细胞免疫完全消退已形成的肿瘤。不幸的是,目前的CD137抗体未能使癌症患者受益。 此外,它们在体内的抗肿瘤机制仍有待确定。
2024年8月23日,暨南大学陈良、丁克及周倩共同通讯在 Science Advances 在线发表题为 “ Human/mouse CD137 agonist, JNU-0921, effectively shrinks tumors through enhancing the cytotoxicity of CD8 + T cells in cis and in trans ”的研究论文。 该研究报告了一种小分子CD137激动剂JNU-0921的开发。
JNU-0921通过直接结合其胞外结构域来诱导寡聚化和信号传导,从而有效激活人类和小鼠CD137,并有效缩小体内肿瘤。从机制上讲,JNU-0921增强了细胞毒性CD8 +T细胞(CTL)的效应和记忆功能,并减轻了它们的衰竭。JNU-0921还使辅助T细胞向T辅助1型极化,并增强了它们的活性以增强CTL功能。同时,JNU-0921减弱了调节性T细胞对CTL的抑制作用。 作者目前的研究表明,JNU-0921通过增强顺式和反式CTL的细胞毒性来缩小肿瘤,并为开发CD137小分子激动剂的策略提供了启示。
CD137(也称为4-1BB/TNFRSF9)是一种20世纪80年代末发现的膜糖蛋白,属于参与细胞活化和存活的28种其他受体家族。 它广泛表达于多种免疫细胞,包括B细胞、树突状细胞、嗜酸性粒细胞和肥大细胞、活化但不静止的T细胞、自然杀伤(NK)细胞和NKT细胞。另一方面,调节性T细胞(Treg)组成性表达CD137。 因此,CD137已被接受为活化标记,并已被有效用于从幼稚池和记忆池中识别抗原特异性CD4 + 和CD8 + T细胞。
CD137的连接通过募集各种分子(包括肿瘤坏死因子(TNF)受体相关因子(TRAF))导致不断增长的信号体组装。 TRAF2和可能的细胞凋亡蛋白抑制剂(cIAP)产生K63多泛素链,以募集转化生长因子β活化激酶1-TAB1/2进入该复合物。该激酶复合物反过来磷酸化其他下游底物,导致通过NF-κB(IκB)激酶抑制剂和NEMO(NF-κB必需调节剂)激活核因子κB(NF-κB)的典型途径,以及通过MEKK1激活丝裂原活化蛋白激酶(MAPK)。临床前研究表明,CD137的激动作用可诱导增殖和效应功能的激活,包括干扰素-γ(IFN-γ)和白细胞介素2(IL-2)的产生,以及通过上调CD4 + 和CD8 + T细胞中的抗凋亡途径实现记忆分化。CD137激动作用使CD4 + T细胞向T辅助细胞1(TH1)倾斜,从而增强CD8 + T细胞的抗肿瘤活性。 此外,据报道,CD137刺激可通过上调转录因子脱中胚层蛋白将Treg重新编程为具有抗肿瘤活性的细胞毒性CD4 + T细胞。
Melero等在二十多年前首次报道了使用激动剂抗CD137单克隆抗体通过增强CD8 + T细胞抗肿瘤免疫力消灭肿瘤移植物,大量临床前模型研究证明其可以保护小鼠免受肝肿瘤、淋巴瘤、结肠癌、肺癌、乳腺癌、黑色素瘤等的侵袭。
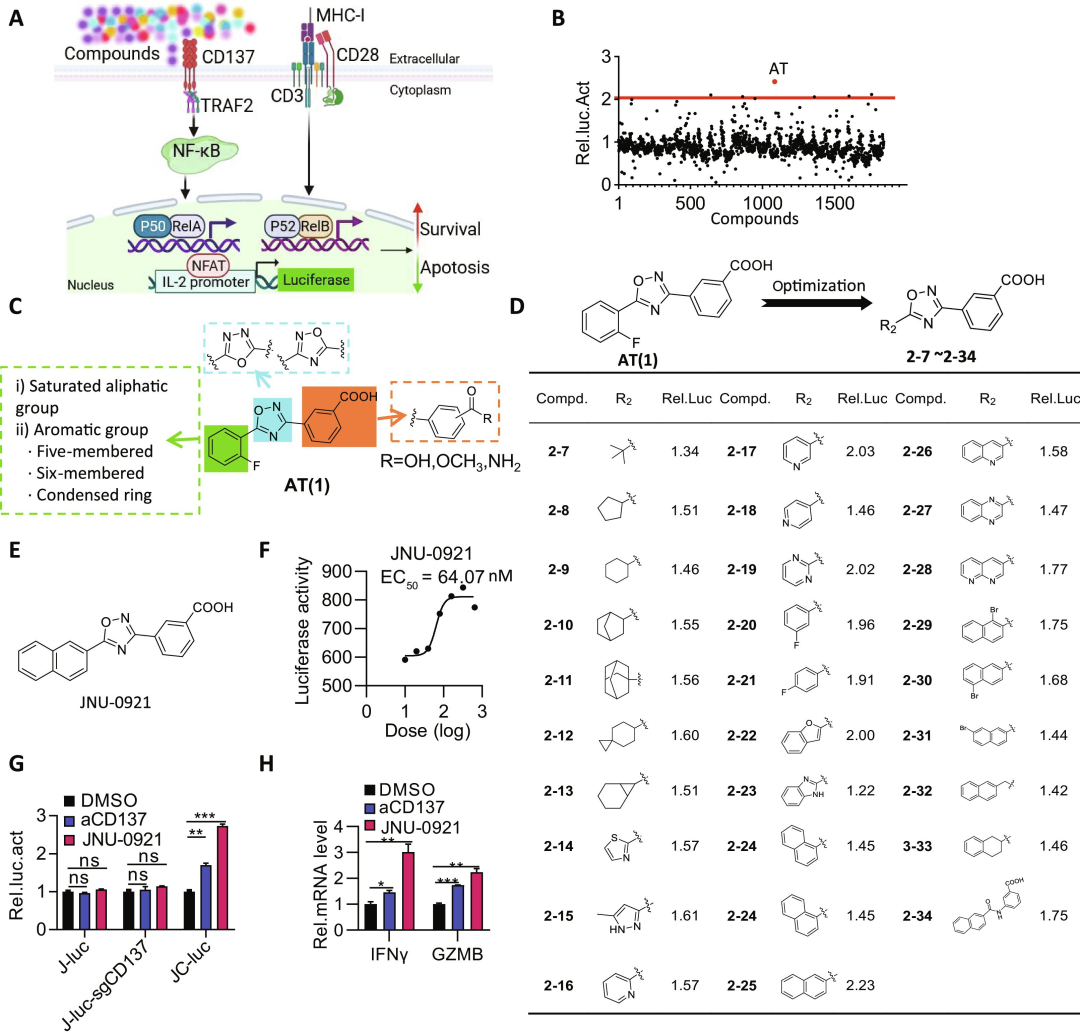
JNU-0921是一种有效的跨物种反应性CD137激动剂(图源自 Science Advances )
制药行业一直在大力开发激动剂CD137抗体或肽,它们正处于癌症治疗的不同开发阶段。 不幸的是,这些努力并未取得成功,即使是两种处于最晚期阶段的抗体:Urelumab(BMS-663513)在B细胞恶性肿瘤和黑色素瘤患者中表现出一些临床反应,但在这些剂量下毒性很大;utomilumab(PF-05082566)显示出较低的疗效。
目前,将临床前小鼠模型中观察到的CD137激动剂的强效肿瘤缩小能力转化为临床应用的困难部分源于目前正在临床评估的激动剂抗体仅识别人类CD137(hCD137)。 很难在临床前动物模型中评估这些仅针对人类的CD137抗体的肿瘤缩小能力并研究其潜在的抗肿瘤机制。
能够以大致相同的功效抑制小鼠和人类靶标,这使得候选药物能够有效地从临床前模型转化为临床。例如,EVT801可有效抑制小鼠[半数抑制浓度(IC 50 ),151nM]和人类VEGFR3(IC 50 ,39nM)。曲美替尼抑制小鼠和人类MAPK激酶1/2的功效大致相同。跨物种反应性(CSR)极大地促进了候选药物在进入临床之前的转化研究,因为这些药物在具有免疫活性背景的小鼠肿瘤模型上体内揭示的机制在患者身上被发现的可能性更高。 CSR对于CD137激动剂将小鼠模型数据转化为临床尤为重要:野生型(WT)免疫功能小鼠的免疫微环境和发育过程对各种T细胞亚型的功能和行为起着关键作用,这些亚型很难在用人类免疫系统重建的小鼠模型中理想地复制。
在这里,作者报告了一种小分子CD137激动剂JNU-0921的开发。 作者证明JNU-0921通过直接结合CD137的细胞外部分激活人和小鼠CD137并诱导其寡聚化和信号传导。作者还证明JNU-0921通过重新连接肿瘤微环境有效地缩小体内肿瘤。 作者揭示了JNU-0921在体内抗肿瘤作用背后的有趣机制:JNU-0921通过激活CD137有效增强顺式细胞毒性CD8 + T细胞(CTL)的效应和记忆功能;JNU-0921还通过增强TH1功能增强CTL的抗肿瘤活性,并通过激活各自的CD137分子抑制T reg 的功能。
https://www.science.org/doi/10.1126/sciadv.adp8647

— END—
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/30/Sci%20Adv%E4%B8%A8%E6%9A%A8%E5%8D%97%E5%A4%A7%E5%AD%A6%E9%99%88%E8%89%AF-%E4%B8%81%E5%85%8B-%E5%91%A8%E5%80%A9/
THE END