三张图带你读懂微生物如何远程操纵肿瘤免疫
哈喽各位小伙伴们好呀,国自然立项结果出炉,几家欢喜几家愁,如果你想布局明年的国自然微生物热点,那可不能错过小编今天带来的 8月15日 发表在 Immunity 的最新高分综述!

我们知道,局部微生物群会影响粘膜区域的癌症。各种微生物表现出直接的致癌作用,例如胃癌中的幽门螺杆菌、口咽癌中的HPV和结直肠癌中的有核梭杆菌。然而, 肠道微生物群也可以远程的对位于胃肠道以外的癌症免疫微环境产生影响。同时微生物群的耗竭或严重扰动会破坏癌症免疫疗法的疗效,从而损害癌症患者的临床结果。 今天小编用三张图带大家读懂这篇高分综述!
肠道微生物影响肿瘤微环境的机制
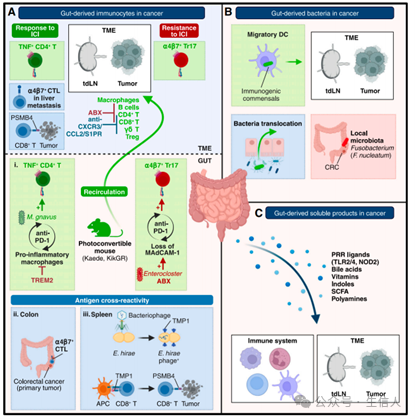
图1. 肠道微生物影响肿瘤微环境的机制
(A) 肠道来源的免疫细胞从肠道迁移到肿瘤微环境 (TME)。
(i) 肠道微生物群决定免疫细胞向肿瘤微环境 (TME) 的迁移。为了追踪在肠道中标记的免疫细胞,使用表达光可转换荧光蛋白 (Kaede或KikGR) 的小鼠。巨噬细胞 (CD11c-CD11b+ F4/80+),以及各种 B 细胞和 T 细胞亚群,可以从结肠迁移到肿瘤微环境。这种迁移受肠道微生物群的控制(可被抗生素 [ABX] 抑制)或由 CXCR3、CCL2 或 S1PR 控制。在小鼠中,敲除 TREM2 会导致促炎性巨噬细胞的增加,这与 M. gnavus 的丰度增加以及肠道中 TNF+ CD4+ T 细胞数量的增加有关。TNF+ CD4+ T 淋巴细胞向 TME 的循环与对抗 PD-1 的反应有关。ABX 引起的菌群失调导致肠杆菌属 (Enterocloster spp.) 丰度增加和小肠中 MAdCAM-1 表达的丧失,从而导致免疫抑制性 a4b7+ Tr17 细胞的循环以及对免疫检查点抑制剂 (ICIs) 的耐药性。
(ii) 肠道中引发的局部免疫可以通过抗原交叉反应控制肠外的抗肿瘤免疫。在结直肠癌 (CRC) 小鼠模型中,肠道标记的 a4b7+ 细胞毒性 T 细胞 (CTL) 在肝转移中的积累与良好预后相关。
(iii) 在小鼠和人类中,已发现来自受噬菌体感染的肠道细菌的抗原与肿瘤抗原之间存在“分子模拟”现象。
(B)肠道来源的细菌可以到达肿瘤微环境。
树突状细胞 (DCs) 可以充当“特洛伊木马”,将免疫原性共生菌(如大肠杆菌、粪肠球菌、约翰逊乳杆菌、假长双歧杆菌、粪肠球菌、鼠李糖乳杆菌和粘液阿克曼菌)从肠道运输到肿瘤微环境,从而引发抗肿瘤的 T 细胞反应。细菌可以通过肠道屏障的渗透以及血液循环从肠道转移到肿瘤微环境。在结直肠癌 (CRC) 的情况下,当地的微生物群 (F. nucleatum) 可直接到达肿瘤微环境。
(C)肠道来源的可溶性产物可以到达肿瘤微环境并影响癌症-免疫对话。
肠道微生物群产生多种可溶性产物,这些产物到达肠外靶点并发挥系统性免疫调节作用。这些可溶性产物包括模式识别受体(PRR)配体(如 Toll 样受体 [TLR] TLR2 和 TLR4 的配体以及核苷酸结合寡聚化结构域 2 [NOD2] 的配体或干扰素基因刺激物 [STING] 激动剂)和免疫刺激代谢物(肌苷、L-精氨酸、亚精胺、维生素 B3、吲哚、短链脂肪酸 [SCFAs] 和胆汁酸 [BAs])。
肿瘤微生物群对癌症发生或肿瘤进展各个阶段的影响
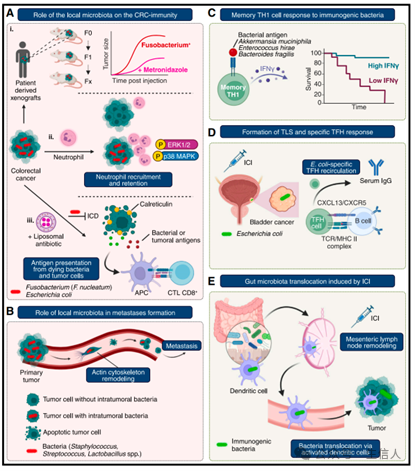
(A) 局部微生物群在结直肠癌免疫中的作用。
(i) 人类结直肠癌 (CRC) 的小鼠异种移植瘤在免疫缺陷小鼠中通过连续传代维持了可存活的梭形菌 (Fusobacterium),并且对这些动物进行甲硝唑治疗可以消除梭形菌并降低癌症的侵袭性。(ii) 感染梭形菌的 CRC 类器官同时通过激活应激激酶(ERK1/2 和 p38 MAPK 的磷酸化)来招募并留住中性粒细胞。(iii) 梭形菌感染 CRC 细胞会抑制钙网蛋白 (calreticulin) 暴露,从而阻止癌细胞发生免疫原性细胞死亡 (ICD),但这种效应可以通过锡硝唑的脂质体制剂来逆转。
(B)局部微生物群在转移形成中的作用。
存在于小鼠乳腺癌中的细胞质内细菌会导致肌动蛋白细胞骨架重塑并抵抗机械应力,从而促进肺部转移。
(C)记忆性 IFNγ+ Th1 对免疫原性细菌的反应与良好预后相关。
(D)三级淋巴结构 (TLSs) 的形成及特定的滤泡辅助 T 细胞 (Tfh) 反应。
在接受新辅助抗 PD-1 治疗的膀胱癌患者中,特异性于大肠杆菌 (E. coli) 的 CXCL13+ Tfh 和相关的血清 IgG 滴度是临床获益的生物标志物。
(E)免疫检查点抑制剂 (ICI) 诱导的肠道微生物群易位。
免疫检查点抑制剂 (ICIs) 通过重塑肠系膜淋巴结,促进肠道树突状细胞从肠道到肿瘤微环境 (TME) 的免疫原性共生菌的转运,诱发抗肿瘤 T 细胞反应。
肠菌失衡相关靶点——MAdCAM-1,作为肠道免疫检查点
MAdCAM-1,全称为黏膜血管地址素细胞黏附分子1(Mucosal Vascular Addressin Cell Adhesion Molecule 1),是一种细胞黏附分子,主要表达在肠道黏膜的血管内皮细胞上,参与白细胞在黏膜区域的选择性归巢和炎症反应。
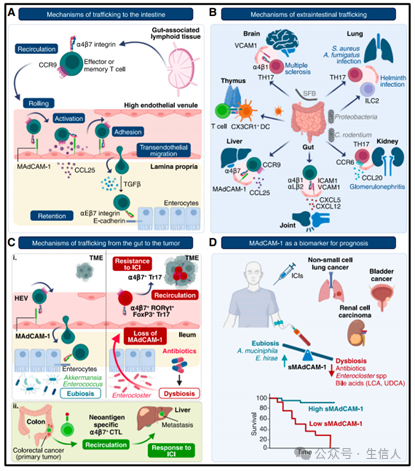
(A) 免疫细胞向肠道迁移的机制。
在肠相关淋巴组织 (GALT) 中,T 细胞由树突状细胞激活时,a4b7 整合素和 CCR9 的表达上调。循环中的 a4b7+ 细胞通过在黏附分子 MAdCAM-1 上滚动,归巢到肠道,并在 CCL25 的激活下与 MAdCAM-1 紧密黏附,随后进行跨内皮迁移进入组织。在固有层中,转化生长因子 β (TGF-β) 通过与 E-钙黏蛋白的相互作用,诱导 aEb7 整合素的上调并促进细胞的滞留。
(B) 免疫细胞肠外迁移的机制。
免疫细胞从肠道迁移到其他部位可能会导致肠道微生物群触发的免疫介导炎症性疾病的发生。微生物群的变化可以诱导肠道中致病性免疫细胞的扩增,这些细胞随后通过各种机制归巢到肠外部位。
(C) 免疫细胞从肠道到肿瘤的迁移机制。
(i) 在肠道微生物群平衡(健康的肠道微生物群)期间,a4b7+ 细胞通过与黏附分子 MAdCAM-1 的相互作用归巢到肠道。在抗生素 (ABX) 诱导的菌群失调的情况下,其特征是肠杆菌属 (Enterocloster spp.) 的过度繁殖,MAdCAM-1 表达下调,免疫抑制性 a4b7+ Tr17 细胞循环到肿瘤微环境 (TME),导致对免疫检查点抑制剂 (ICI) 的耐药性。
(ii) 在结直肠癌 (CRC) 小鼠模型中,肠道标记的 a4b7+ 细胞毒性 T 细胞 (CTL) 在肝转移中的积累与良好预后相关。
(D)MAdCAM-1 作为预后生物标志物。
在患者中,回肠 MAdCAM-1 表达的丧失发生在肠道菌群失调(通常在使用抗生素后),其特征是肠杆菌属 (Enterocloster spp.) 的过度繁殖和胆汁酸组成的变化(见表1)。血清中可溶性 MAdCAM-1 (sMAdCAM-1) 的浓度反映了其在肠道中的表达水平。低水平的 sMAdCAM-1 与菌群失调相关,并预测了接受 ICI 治疗的癌症患者的不良临床结局。
小编总结:
在这篇综述中,作者围绕这三张图总结了当前对肿瘤微生物群的认识,评估了其潜在的临床意义,并讨论了肠道微生物群对抗癌免疫反应产生远距离影响的机制。而对于肿瘤免疫学领域,理解上述癌症-免疫-微生物三联体之间的机制性联系将是极其重要的。只有在充分理解这一生态系统的微妙之处后,我们才能设计出将生态系统转变为改善肿瘤免疫监视的治疗策略,同时不会损害对自身抗原、过敏原、食物抗原和有益微生物的理想免疫耐受性。
参考文献:
Laurence Zitvogel, Marine Fidelle, Guido Kroemer. Immunity. 2024 Aug 8:S1074-7613(24)00369-8. doi: 10.1016/j.immuni.2024.07.020.
链接:http://www.lewenyixue.com/2024/08/30/%E4%B8%89%E5%BC%A0%E5%9B%BE%E5%B8%A6%E4%BD%A0%E8%AF%BB%E6%87%82%E5%BE%AE%E7%94%9F%E7%89%A9%E5%A6%82%E4%BD%95%E8%BF%9C%E7%A8%8B%E6%93%8D%E7%BA%B5%E8%82%BF%E7%98%A4%E5%85%8D%E7%96%AB/