Mol Cancer | 非霍奇金淋巴瘤治疗突破——新型CART19疗法
【CMT&CHTV 文献精粹】
导语: 本文介绍了一种针对非霍奇金淋巴瘤患者的新型抗CD19嵌合抗原受体T细胞疗法。研究中对此疗法进行了安全性和有效性的评估,有望突破现有治疗局限,为患者带来更有效的治疗选择。
在血液肿瘤领域,非霍奇金淋巴瘤(Non-Hodgkin lymphoma, NHL)的治疗一直是医学研究的重点。尽管已有的抗CD19嵌合抗原受体T细胞(anti-CD19 chimeric antigen receptor T-cell therapies,CAR-T19)疗法在治疗B细胞恶性肿瘤中取得了显著成效,但仍有许多患者最终会因CD19阴性逃逸、CAR-T细胞功能障碍等因素导致复发。目前所有被批准CART19产品均采用FMC63单链可变片段(scFv),这一片段特异性地识别CD19蛋白的膜远端区域。然而,由于其结合与解离的速率相对较慢,导致在临床应用中的长期疗效受到限制。
2023年12月, Molecular Cancer 发表了一篇题为“Safety and efficacy of a novel anti-CD19 chimeric antigen receptor T cell product targeting a membrane-proximal domain of CD19 with fast on- and off-rates against non-Hodgkin lymphoma: a first-in-human study”的文章,旨在探索一种新型CART19的治疗方法。
01
研究方法
本研究是一项多中心、首次人体Ⅰ期临床试验,旨在评估一种新型抗CD19嵌合抗原受体T细胞(CART19)产品AT101的安全性和有效性。研究对象为复发或难治性(r/r)NHL患者。研究采用3+3剂量递增设计,分为三个剂量组:DL-1(0.2×10 6 cells/kg),DL-2(1.0×10 6 cells/kg),DL-3(5.0×10 6 cells/kg)。纳入标准包括病理确诊的B细胞NHL、至少一线标准治疗失败、ECOG表现状态0-1,且血液学、肾脏、肝脏、肺、心脏和骨髓功能良好。排除标准为既往接受过CAR-T细胞治疗或CD3/CD20双特异性抗体治疗的患者。CAR-T细胞输注前,患者分别在治疗前第4天、第3天和第2天,接受了淋巴细胞耗竭治疗(Lymphodepletion, LD),即静脉注射氟达拉滨(25 mg/m 2 )和环磷酰胺(250 mg/m 2 )。
研究主要评价指标为CAR-T细胞制造的安全性和可行性,次要终点包括总体缓解率(Overall Response Rate, ORR)、完全缓解率(Complete Response, CR)的疗效指标及CAR-T细胞持久性、B细胞再生障碍和低丙种球蛋白血症的发生率及持续时间、无进展生存期(PFS)和总生存期(OS)。安全性评估包括细胞因子释放综合征(Cytokine Release Syndrome, CRS)和免疫细胞相关神经毒性综合征(Immune Effector Cell-Associated Neurologic Syndrome, ICANS)的发生率和严重程度。
02
研究结果
临床前研究结果
在临床前研究中,新型h1218-CART19展现出了显著的抗肿瘤活性。研究发现,h1218-CART19能够有效识别并清除表达CD19点突变(L174V和R163L)或共表达FMC63-CAR19的淋巴瘤细胞。这些细胞在FMC63-CART19治疗后复发的患者中发现,表明h1218-CART19可能克服了现有CART19疗法的局限性。此外,h1218-CART19在体外和体内实验中均显示出比FMC63-CART19更强的B细胞恶性肿瘤杀伤能力。研究机制发现,h1218-CART19凭借其更快的结合与解离速率,降低了其活化诱导的细胞死亡(Activation-Induced Cell Death, AICD),增强了细胞的扩增潜力。
Ⅰ期临床试验结果
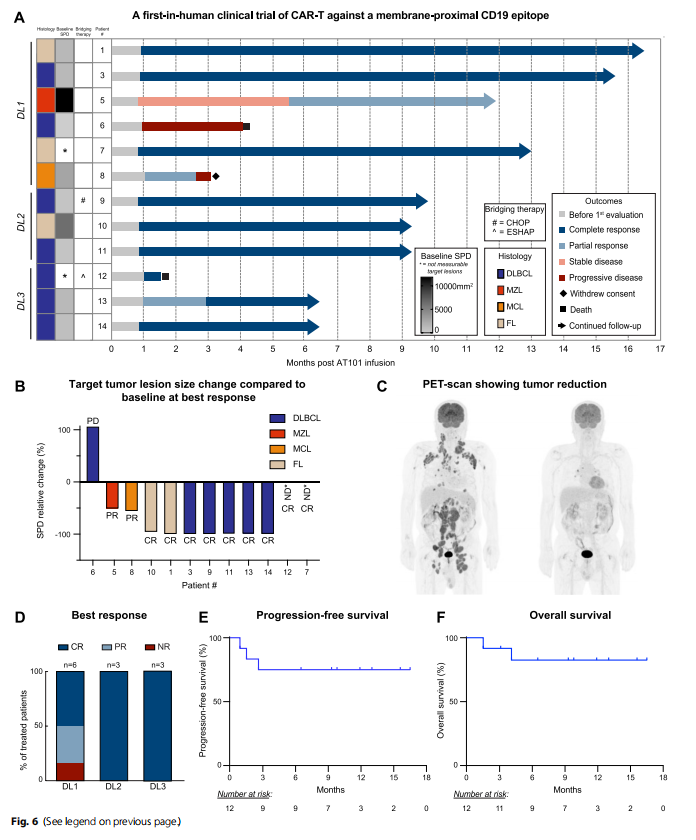
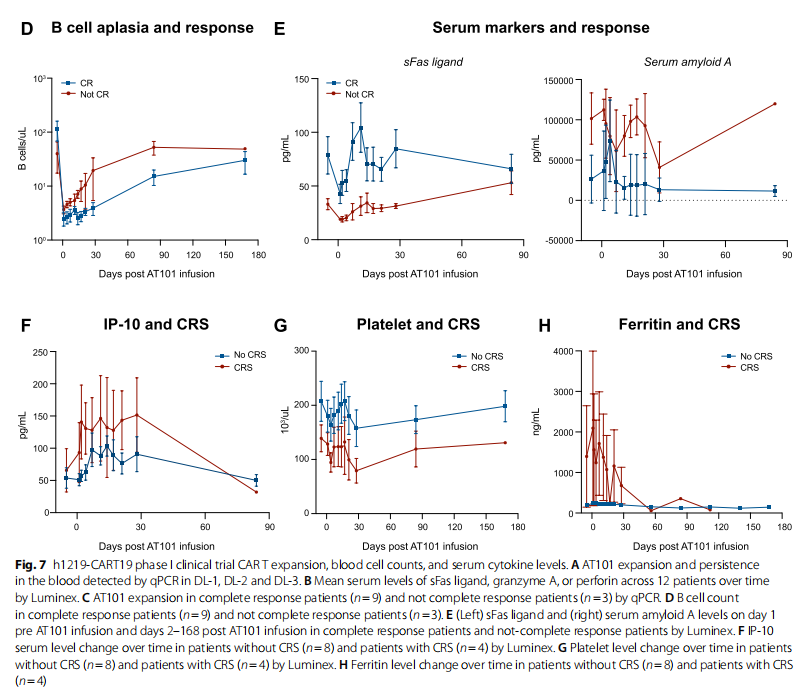
在Ⅰ期临床试验中,12名接受治疗的患者,包括7名DLBCL、3名FL、1名MCL和1名MZL,这些患者接受AT101(即临床级别的h1218-CART19)治疗展现出了积极的安全性,即仅8.3%的患者出现3级CRS,8.3%的患者出现4级ICANS。在整体队列中,ORR达到了91.7%,CR为75.0%。特别是在DL-2和DL-3剂量组中(见图1),完全缓解率提高到了100%。此外,AT101的扩增与临床反应和B细胞再生障碍相关。
图1 h1218-CART19 Ⅰ期临床试验患者的特征和对AT101的反应
疗效评估
研究显示,第1个月时,ORR为83.3%,CR为66.7%。第3个月时,11名存活的患者中,8名患者达到目标CR。特别是在接受较高剂量AT101(DL-2和DL-3)的患者中,CR达到了100%,表明剂量水平与疗效之间存在正相关关系。
安全性和耐受性
研究中未观察到输注相关的急性不良事件。中性粒细胞减少症是最常见的严重不良事件,可能与淋巴细胞减少化疗有关。所有患者在淋巴细胞减少和AT101输注后均经历了B细胞再生障碍。此外,33.3%的患者出现了细胞因子释放综合征(CRS),其中1例为3级。25%的患者出现了ICANS,其中1例为4级,这也是研究中唯一的剂量限制性毒性(Dose-Limiting Toxicity, DLT)。
图2 h1219-CART19 Ⅰ期临床试验中的CAR-T细胞扩增、血细胞计数和血清细胞因子水平。
长期随访结果
在长期随访中,中位随访时间为9.3个月,PFS为75.0%,OS为82.5%。未达到中位PFS和OS。特别是在CR患者中,中位PFS和OS均未达到,显示出良好的长期疗效和生存率。
03
总结讨论
研究结果显示,h1218-CART19不仅在临床前模型中显示出良好的抗肿瘤活性,而且在首次人体临床试验中也表现出了良好的安全性和有效性。特别是在DL-2和DL-3剂量组中,完全缓解率达到了100%,这为复发或难治性B细胞NHL患者提供了新的治疗选择。此外,AT101的扩增和持久性在患者体内表现出色,这可能有助于提高长期疗效和减少复发风险。这项研究为CART19疗法的发展提供了新的视角,并为未来的临床应用奠定了基础。研究结果还提示,通过优化CAR-T细胞与靶抗原的相互作用,可以提高CAR-T细胞在体内的生存和杀伤能力,从而增强其抗肿瘤功能。这一发现对于未来CART细胞疗法的设计和优化具有重要的指导意义。
参考文献
ZHANG Y, PATEL RP, KIM KH, et al. Safety and efficacy of a novel anti-CD19 chimeric antigen receptor T cell product targeting a membrane-proximal domain of CD19 with fast on- and off-rates against non-Hodgkin lymphoma: a first-in-human study[J]. Mol Cancer. 2023, 22(1):200. doi: 10.1186/s12943-023-01886-9.
链接:http://www.lewenyixue.com/2024/08/28/Mol%20Cancer%20%7C%20%E9%9D%9E%E9%9C%8D%E5%A5%87%E9%87%91%E6%B7%8B%E5%B7%B4%E7%98%A4/






赶快来坐沙发