Nat Biotech | CAR-T与预防癌症复发的增强平台CAR-E相遇
摘要:
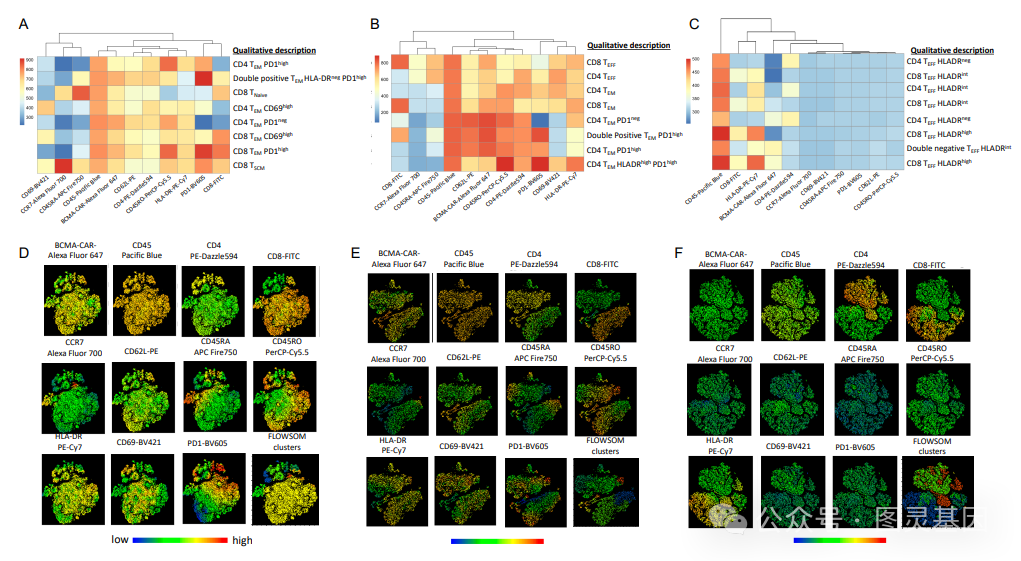
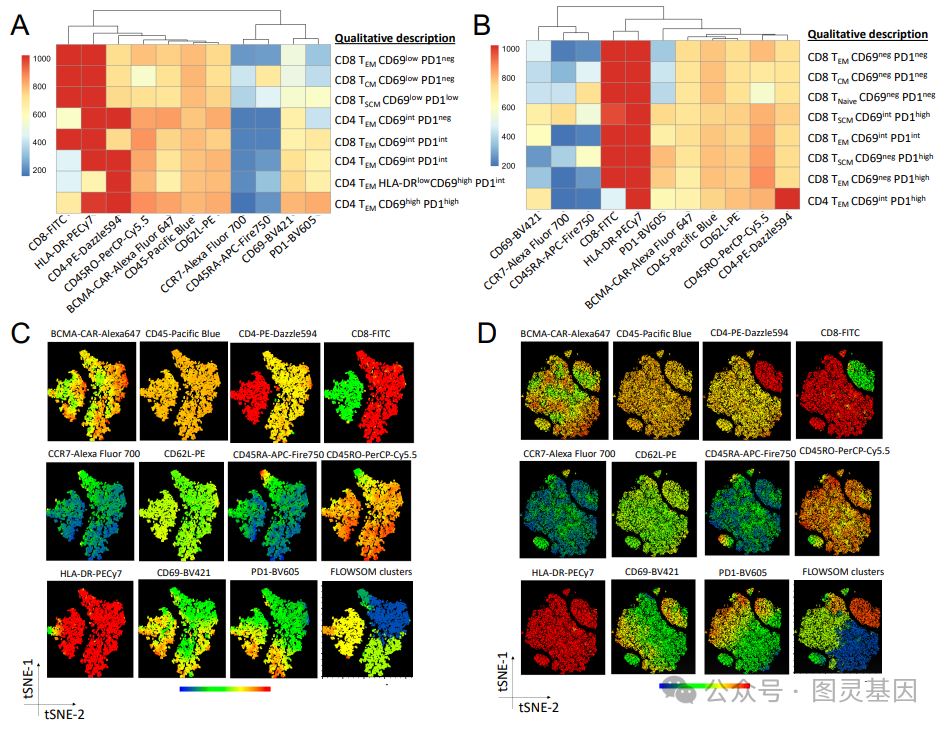
尽管嵌合抗原受体( CAR ) T 细胞疗法已显示出有希望的临床结果,但持久缓解仍然有限。为了延长 CAR- T 细胞的功效,研究人员开发了一种 CAR 增强子( CAR-E ),包含与免疫调节分子融合的 CAR T 细胞抗原。在这里,研究人员使用 B 细胞成熟抗原( BCMA ) CAR T 细胞来治疗多发性骨髓瘤,其中 CAR-E 由 BCMA 与低亲和力白细胞介素 2 ( IL-2 )融合而成。这在抗原 -CAR 结合后选择性地诱导 CAR T 细胞中的 IL-2 信号,增强 T 细胞活化和抗肿瘤活性,同时降低 IL-2 相关的毒性。研究人员发现, BCMA CAR-E 选择性地结合 CAR T 细胞,增加 CAR- T 细胞的扩增、肿瘤细胞的清除和记忆性 CAR- T 细胞的发育。记忆细胞在再刺激时保留了再扩增的能力,在再次攻击时有效地控制肿瘤生长。机制研究揭示了 CAR 和 IL-2 受体内结构域参与了 CAR- E 的作用机制。 CAR-E 方法避免了对特定工程的需要,并能够以较低的细胞剂量进行 CAR-T 细胞治疗。
通常情况下, CAR-T 细胞击退了癌症,但却从血液中消失,导致癌症复发。因此, CAR-T 细胞需要更热情、更持久、更警惕。为了帮助 CAR-T 细胞治愈癌症,而不仅仅是暂时的缓解, Dana-Farber 研究所的科学家们开发了他们所谓的 CAR-E 治疗平台。 CAR-E 中的“ E ”代表“增强器”。
有了这个平台,靶抗原与低亲和力增强子分子融合,从而能够精确靶向 CAR-T 分子。该平台还有助于在输注后优先输送免疫调节剂。
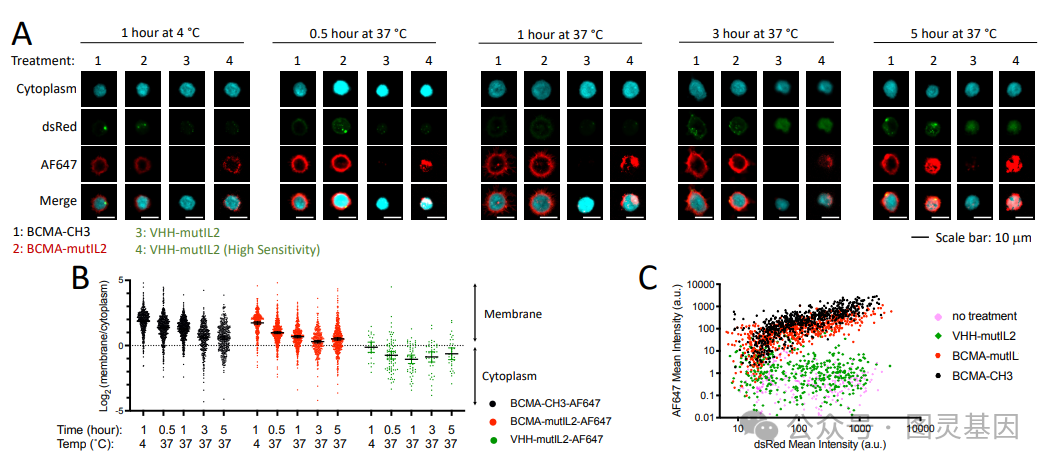
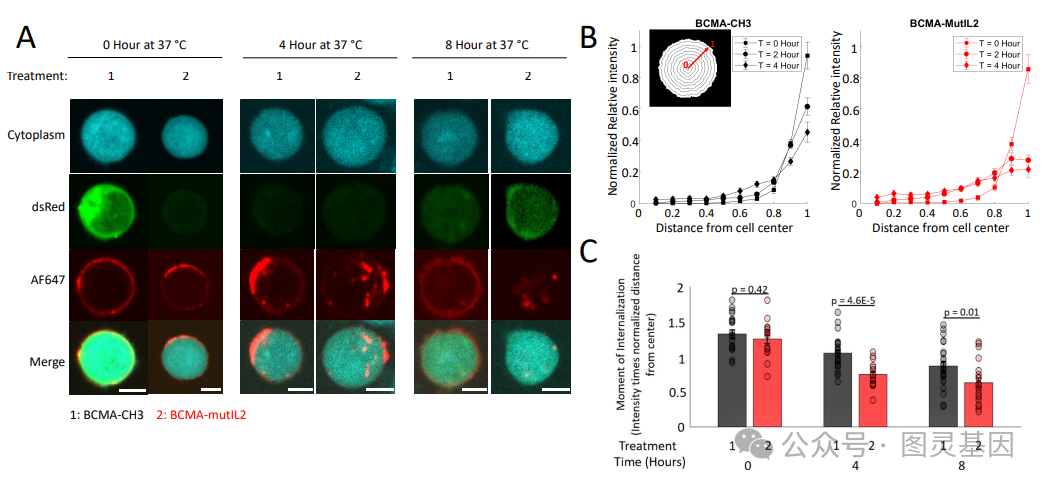
关于这个新平台的详细信息发表在《 Nature Biotechnology 》杂志上的一篇题为“ ACAR enhancer increases the activity and persistence of CAR T cells ”的文章中。例如,该文章描述了如何使用 CAR-E 平台创建 B 细胞成熟抗原( BCMA ) CAR-E ,即与低亲和力白细胞介素 -2 ( IL-2 )融合的 BCMA 抗原。考虑到 BCMA CAR- T 细胞治疗多发性骨髓瘤难以实现持久缓解, BCMA CAR- E 被认为是一个合适的研究对象。
文章作者写道:“ BCMA CAR-E…… 选择性地与 CAR-T 细胞结合,导致其扩增,有效清除肿瘤细胞,并促进具有不同表型的记忆 CAR-T 细胞的发展。这些记忆细胞在再次刺激下保持了重新扩增的能力,有效地控制了再次攻击时的肿瘤生长。”
因此, CAR-E 不仅有助于 CAR-T 细胞变得更活跃,在体内存活的时间更长,而且还能使 CAR-T 细胞形成对癌细胞的记忆,这样当癌症复发时,它们就能重新开始发挥作用。
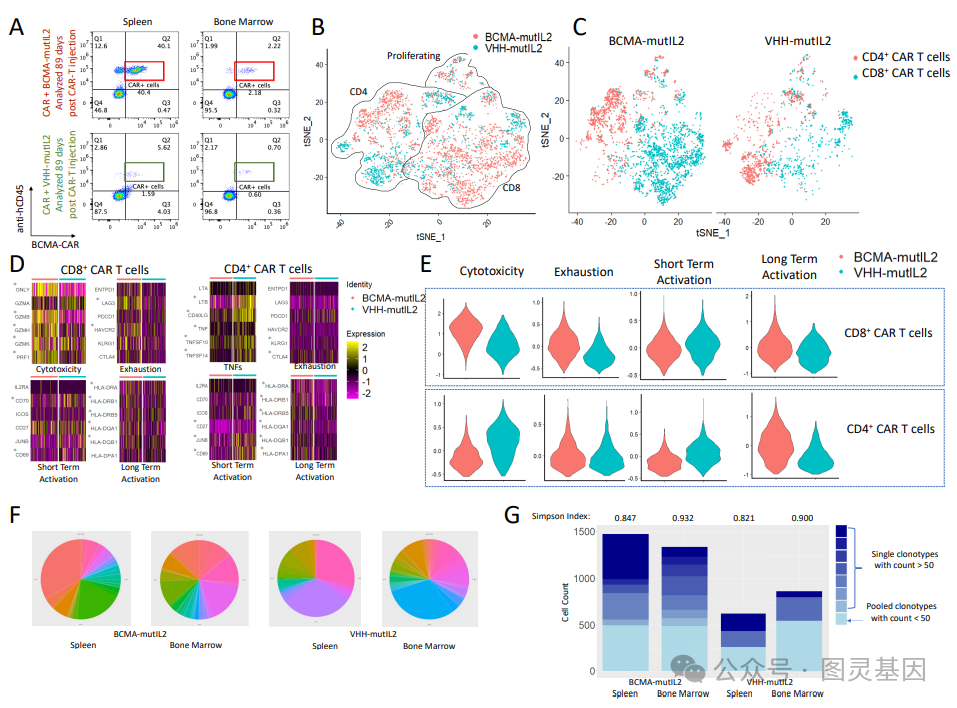
研究人员发现, CAR-E 疗法不仅会使 CAR-T 细胞扩增,还会使其多样化。“它不仅产生了大多数患者已经拥有的效应 T 细胞,还产生了干细胞样的记忆 T 细胞、中枢记忆 T 细胞、效应记忆 T 细胞——这是对癌症进行有效免疫反应所需的一整套 T 细胞。”该研究的资深作者、 Dana-Farber 研究所的 MohammadRashidian 博士说。
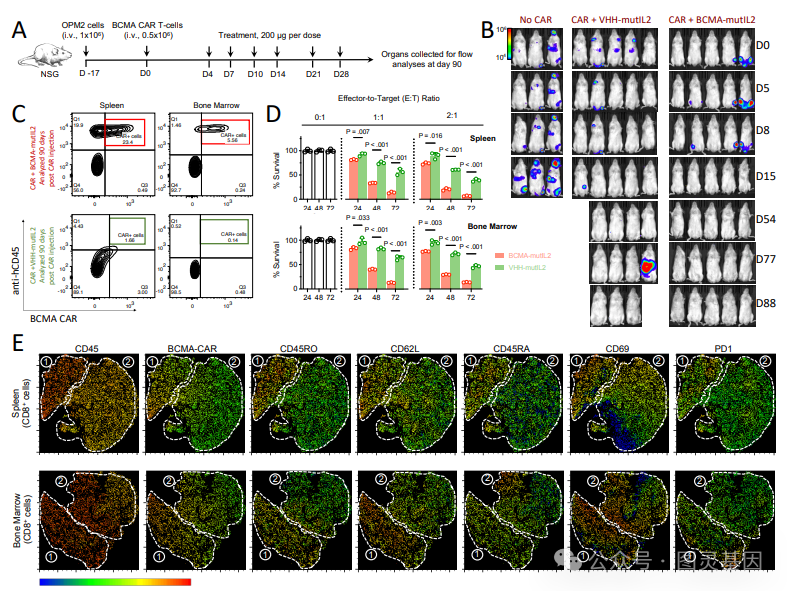
在实验室培养的骨髓瘤细胞和该疾病的动物模型中, CAR-E 疗法实现了肿瘤细胞的完全清除。除此之外还有其他好处。研究人员发现,通过重新施用 CAR-E ,可以重新刺激治疗产生的长效 CAR-T 细胞。这表明,在 CAR-T 细胞治疗后复发的患者可以通过额外剂量的 CAR-E 治疗得到有效治疗。
Rashidian 指出:“大多数解决复发挑战的研究都集中在重新设计 CAR-T 细胞本身,例如,通过引入或消除基因来延长细胞的活性。虽然这些方法有很大的希望,但它们在临床上尚未显示出多大的有效性。我们决定从一个完全不同的角度来看待这个问题。”
Rashidian 和他的同事们没有试图改变 CAR-T 细胞的内部工作方式,而是开发了一种从外部起作用的方法——通过将一种分子传递到细胞的门口,延长它们的寿命,并促使它们形成记忆。实现这一目标的工具是一个融合在一起的“平台”,与医疗中使用的任何其他平台都不同。
“ IL-2 对 T 细胞有很强的作用——激活它们并使它们增殖,但它对患者也有很高的毒性。” Rashidian 说,“因此,我们使用了一种非常弱的形式。就其本身而言,它对正常的 T 细胞没有影响,但当专门针对 CAR-T 细胞时,它对 CAR-T 细胞有刺激作用。”
“就像弱 IL-2 一样, BCMA 抗原本身不会影响 CAR-T 细胞,但它们共同产生的协同作用,其影响远远超出了我们的预期。”该研究的第一作者、 Dana-Farber 的 TahaRakhshandehroo 博士补充道。
该研究的作者观察到:“机制研究表明, CAR 和 IL-2R 内结构域都参与了 CAR-E 的作用机制;抑制任一途径都会减弱其影响。值得注意的是,这种方法可以使用较低剂量的 CAR-T 细胞进行治疗。 CAR-E 可以与 FDA 批准的 CAR-T 细胞或新一代 CAR 细胞无缝集成,提供一种现成的、通用的、有前景的治疗策略。”
从本质上讲, CAR-E 增加了用比目前更少的 CAR-T 细胞治疗患者的可能性。目前的做法是让 CAR-T 细胞扩增成数亿个细胞,这是一个耗时、昂贵、资源繁重的过程,患者需要等待数周才能接受细胞注入。 CAR-T 细胞疗法最常见的副作用之一是细胞因子释放综合征,即过度的免疫反应导致发烧、恶心、心跳加快、神经系统问题或其他问题。有了 CAR-E ,有可能完全跳过扩增过程:只需制造 CAR-T 细胞并注入患者体内,然后进行 CAR-E 治疗。
Rashidian 说:“在动物研究中,我们给小鼠注入了非常少量的 CAR-T 细胞,发现它们无法清除癌症。当我们对其进行 CAR-E 治疗时, CAR-T 细胞扩增,能够清除癌症。”
CAR-E 疗法临床试验的首要目标之一是确保安全性,并确定最佳剂量和给药方案。最初, Rashidian 和他的同事们希望在患者被注入 CAR-T 细胞一个月后开始治疗。治疗将包括每周一次的 CAR-E 治疗,持续三到四周。
“这种疗法最令人兴奋的部分是,它可以很容易地融入接受 CAR-T 细胞疗法的患者的护理中。” Rakhshandehroo 说,“这是一个解决 CAR-T 细胞耗竭问题的有效方案。我们渴望开始在临床试验中对其进行测试。”
链接:http://www.lewenyixue.com/2024/08/13/Nat%20Biotech%20%7C%20CAR-T%E4%B8%8E/






赶快来坐沙发