肿瘤浸润淋巴细胞疗法在胰腺癌中的进展与前景

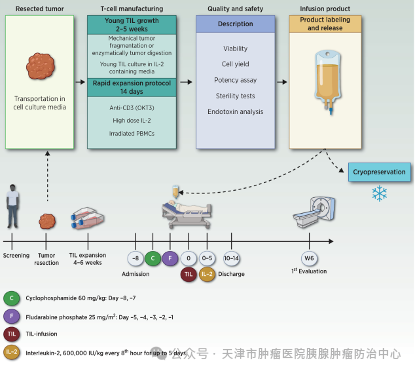
TIL 的扩增流程开始于快速扩增前期 (pre-REP),在此阶段,将TIL 从肿瘤碎片中分离,并经历初步扩增。然后是快速扩增期 (REP),TIL在刺激物(如 IL-2 和/或饲养细胞)的作用下进一步扩增。传统的 TIL 产生过程需要进行特异性肿瘤识别检测,通常需要 6-8 周。然而,TIL 在体外长时间培养后容易衰竭,无法在患者体内长期存活[4]。此外,体外培养自体肿瘤的成功率低,这在很大程度上限制了其临床应用。目前 TIL 疗法的成功应用仍然局限于几种类型的肿瘤,如黑色素瘤。
TIL疗法对胰腺癌的疗效有限,原因包括以下几个方面。首先,与具有谱系标记的血液系统恶性肿瘤不同,胰腺癌的高度异质性使得很难找到针对所有肿瘤细胞的理想靶点,而针对单一肿瘤抗原通常会导致抗原丢失或更具侵袭性的复发[5]。而且,即使过继转移大量 T 细胞,很大一部分肿瘤也很难浸润[6]。此外,由于多种免疫抑制机制,包括免疫抑制分子、细胞因子和代谢物的上调,共刺激分子的下调,以及免疫调节亚群的存在,如Tregs、髓系抑制细胞(MDSCs)和肿瘤相关巨噬细胞(TAMs),T细胞很难在肿瘤微环境(TME)中充分发挥作用。但TIL也具有独特的优势。首先,TIL 由具有多个 T 细胞受体 (TCR) 克隆的 T 细胞组成,这些克隆能够识别一系列肿瘤抗原,因此与其他过继细胞疗法(例如嵌合抗原受体 T (CAR-T) 和 TCR-T 细胞疗法)相比,TIL 在解决肿瘤异质性方面可能更胜一筹。其次,TIL 在体内受到肿瘤抗原的刺激,主要由效应记忆 T (Tem) 细胞组成,这些细胞在表面表达趋化因子受体,例如 CCR5 和 CXCR3[7]。当TIL 连同其肿瘤特异性 TCR一起被回输到患者体内后,很容易归巢到抗原不同的组织,包括肿瘤[8]。
为了降低高剂量 IL-2 相关的毒性以及改善传统 TIL 疗法的疗效,目前正在积极研究下一代 TIL 治疗技术。下一代 TIL 是经过基因改造的 TIL,可通过病毒转导过度表达目标基因或使用 CRISPR等技术敲除目标基因。然而,下一代 TIL 的开发可能面临一些重大挑战。基因编辑在 TIL 中实现可能在技术上很困难,这可能是因为 TIL 的细胞组成和生长速度与 PBMC 不同。此外,选择合适的基因作为 TIL 的靶向基因至关重要。因此到目前为止,临床上对下一代 TIL 的探索主要集中在改造 TIL 以过度表达细胞因子,例如 IL-2 和 IL-12。另一方面也在积极探索基因敲除 TIL 中的 T 细胞负调节剂(如 PD-1)的可行性和功能性。如何合理地选择或识别对 TIL 治疗最有益的靶基因仍有待探索。在这方面,使用 CRISPR 技术进行筛选[9, 10],包括 CRISPR敲除、干扰或激活,可能是识别 TIL 新靶点的有前途的策略。此外,在进入临床之前,需要对基因改造的 TIL 进行全面的安全性和功能评估。除了体外表征外,还需要建立动物模型,以更好地了解修饰 TIL 在体内的持久性、功能以及毒性。
以免疫检查点抑制剂(尤其是抗PD-1/PD-L1抗体)和CAR-T、TCR-T等过继性细胞疗法为代表的肿瘤免疫疗法,彻底改变了肿瘤治疗领域,显著延长了晚期癌症患者的生存期然而,该疗法在大多数癌症类型中的反应率仍然有限,尤其是实体瘤,亟待开发替代性治疗策略。TIL在治疗实体瘤方面具有独特优势,基因修饰的 TIL 的开发有望在更多适应症中提高 TIL 治疗的临床效果,并通过减少对高剂量 IL-2 输注和淋巴细胞清除的依赖来提高安全性。然而,靶标选择和全面的功能评估可能是下一代技术成功的关键步骤。

参考文献:
1. Rosenberg SA, Packard BS, Aebersold PM, Solomon D, Topalian SL, Toy ST,et al. Use of tumor-infiltrating lymphocytes and interleukin-2 in the immunotherapy of patients with metastatic melanoma. A preliminary report. N Engl J Med. 1988;319(25):1676–80
2. Eberlein TJ, Rosenstein M, Rosenberg SA. Regression of a disseminated syngeneic solid tumor by systemic transfer of lymphoid cells expanded in interleukin 2. J Exp Med. 1982;156(2):385–97.
3. Rosenberg SA, Spiess P, Lafreniere R. A new approach to the adoptive immunotherapy of cancer with tumor-infiltrating lymphocytes. Science. 1986;233(4770):1318–21.
4. Huang J, Khong HT, Dudley ME, El-Gamil M, Li YF, Rosenberg SA, et al. Survival, persistence, and progressive differentiation of adoptively transferred tumor-reactive T cells associated with tumor regression. J Immunother. 2005;28(3):258–67
5. Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA Jr, Kinzler KW. Cancer genome landscapes. Science. 2013;339(6127):1546–58.
6. Galluzzi L, Chan TA, Kroemer G, Wolchok JD, Lopez-Soto A. The hallmarks of successful anticancer immunotherapy. Sci Transl Med. 2018;10:459
7. Bedognetti D, Spivey TL, Zhao Y, Uccellini L, Tomei S, Dudley ME, et al. CXCR3/CCR5 pathways in metastatic melanoma patients treated with adoptive therapy and interleukin-2. Br J Cancer. 2013;109(9):2412–23.
8. Burbach BJ, Medeiros RB, Mueller KL, Shimizu Y. T-cell receptor signaling to integrins. Immunol Rev. 2007;218:65–81.
9. Shifrut E, Carnevale J, Tobin V, Roth TL, Woo JM, Bui CT, et al. Genome-wide CRISPR Screens in Primary Human T Cells Reveal Key Regulators of Immune Function. Cell. 2018;175(7):1958–71 e15.
编辑:王轶菲
审核:余俊
链接:http://www.lewenyixue.com/2024/08/05/%e8%82%bf%e7%98%a4%e6%b5%b8%e6%b6%a6%e6%b7%8b%e5%b7%b4%e7%bb%86%e8%83%9e%e7%96%97%e6%b3%95%e5%9c%a8%e8%83%b0%e8%85%ba%e7%99%8c%e4%b8%ad%e7%9a%84%e8%bf%9b%e5%b1%95%e4%b8%8e%e5%89%8d/





赶快来坐沙发