Science Adv | 揭秘Pgbd5:一种在儿童脑瘤中引发基因突变的神秘因子
撰文 | 唐东豪 责编 | 周叶斌
在儿童癌症的世界里,髓母细胞瘤是一种常见的脑瘤。尽管科学家们已经对这种癌症有了一定了解,但它的起源和复杂性仍然充满谜团。PDGB5是一种由PiggyBac转座元件衍生的基因。转座元件是一类可以在基因组中“跳跃”的DNA序列,它们在进化过程中发挥了重要作用。
然而PDGB5并不是一个普通的转座元件。研究发现,PDGB5在多种发育精确的小鼠模型中促进了肿瘤的发展,尤其是那些由Sonic Hedgehog(SHH)信号通路异常激活引起的髓母细胞瘤。目前髓母细胞瘤中体细胞 DNA 重排的原因尚不清楚。因此,对SHH信号通路的深入研究不仅有助于理解正常的生理过程,也为肿瘤等疾病的治疗提供了新的靶点和策略。
2024年3月,由 Makiko Yamada 和 Alex Kentsis 团队发表于 Science Advance 题为 Childhood cancer mutagenesis caused by transposase-derived PDGB5 的文章, 这项研究不仅为我们理解这种髓母细胞瘤的起源提供了新的视角,还可能为其未来的治疗提供新的靶点。

首先,通过调查 PDGB5 在人类癌症中的表达时,研究团队发现大多数人类髓母细胞瘤表达高水平的 PDGB5 。因此,研究者假设 PDGB5 的异常可能有助于体细胞突变致癌。在髓母细胞瘤中,PDGB5 基因与SHH 信号转导关联度很高。因此该团队激活诱导小鼠小脑颗粒细胞前体细胞(GCP)中 SHH 信号构建髓母细胞瘤模型,以研究 PDGB5在母髓细胞瘤中的作用。
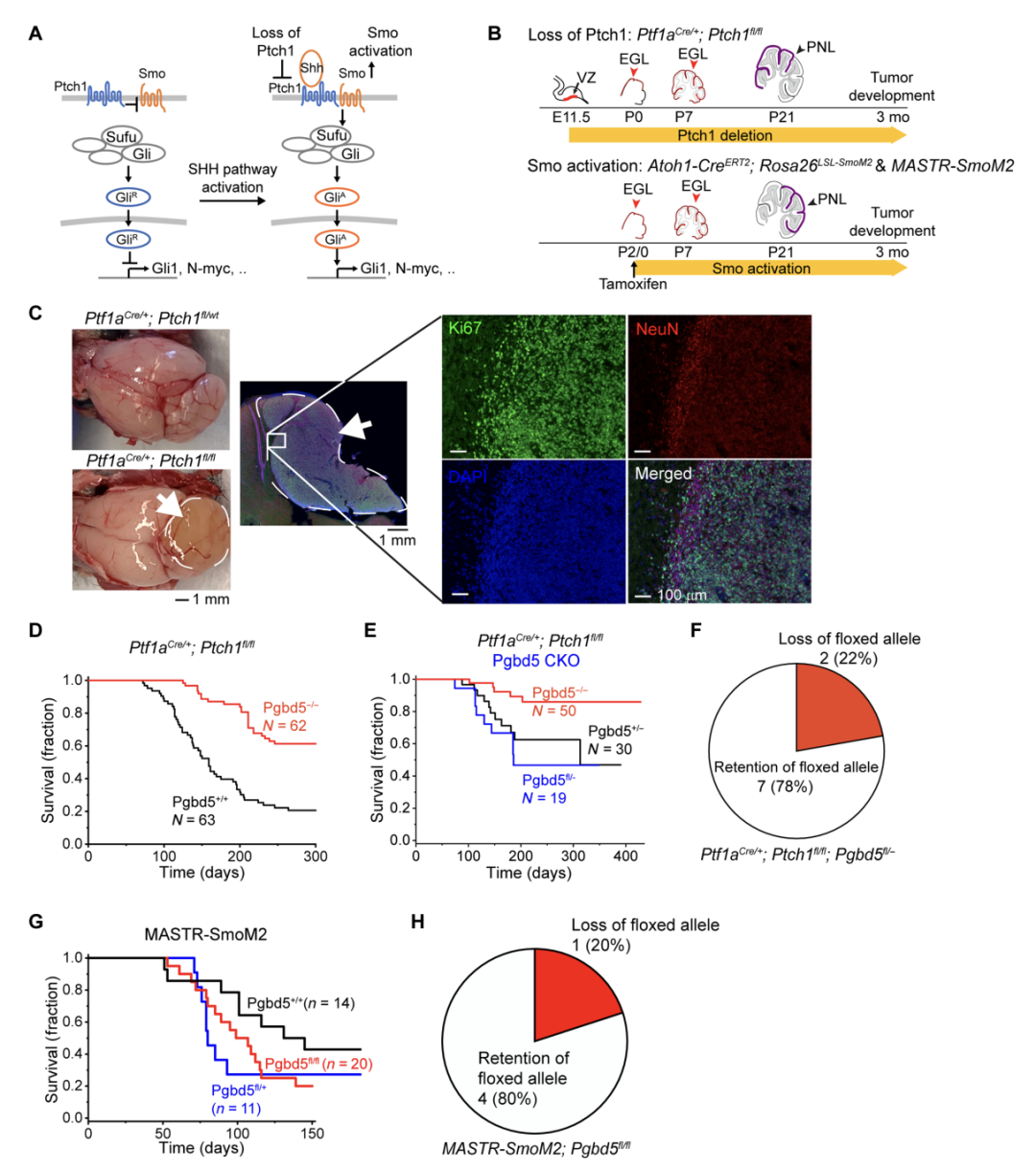
其次,为了研究 PDGB5在母髓细胞瘤中的作用。在小鼠模型中,研究团队发现敲除PDGB5后,发现小鼠肿瘤的发生率也降低了。这些小鼠在没有PDGB5的情况下,能够正常发育,小脑的结构和功能也保持正常。这表明PDGB5在肿瘤发展中的作用是独立于正常发育过程的。更令人惊讶的是,当科学家们在小鼠的小脑颗粒细胞前体中特异性激活SHH信号时,这些细胞表现出PDGB5依赖的DNA修复和神经发育因子的表达。
 PDGB5表达的肿瘤与PDGB5缺失的肿瘤在体细胞结构变异(SVs)数量上的对比
为了探索PDGB5如何促进肿瘤的发展,研究团队将小鼠肿瘤进行DNA测序,结果显示PDGB5通过引发特定的DNA重排来促进肿瘤的发展。这些重排包括删除、插入、易位和扩增,它们在PDGB5表达的肿瘤中出现的频率几乎是PDGB5缺失肿瘤的两倍。这些突变不仅数量多,而且发生在肿瘤发展的过程中,PDGB5可能在肿瘤的早期阶段就已经开始发挥作用。 此外,还发现了一些特定的基因,如Fbxw7、Tbr1、Gfi1、Pik3ca等,这些基因在PDGB5诱导的突变中被频繁影响。
PDGB5表达的肿瘤与PDGB5缺失的肿瘤在体细胞结构变异(SVs)数量上的对比
为了探索PDGB5如何促进肿瘤的发展,研究团队将小鼠肿瘤进行DNA测序,结果显示PDGB5通过引发特定的DNA重排来促进肿瘤的发展。这些重排包括删除、插入、易位和扩增,它们在PDGB5表达的肿瘤中出现的频率几乎是PDGB5缺失肿瘤的两倍。这些突变不仅数量多,而且发生在肿瘤发展的过程中,PDGB5可能在肿瘤的早期阶段就已经开始发挥作用。 此外,还发现了一些特定的基因,如Fbxw7、Tbr1、Gfi1、Pik3ca等,这些基因在PDGB5诱导的突变中被频繁影响。
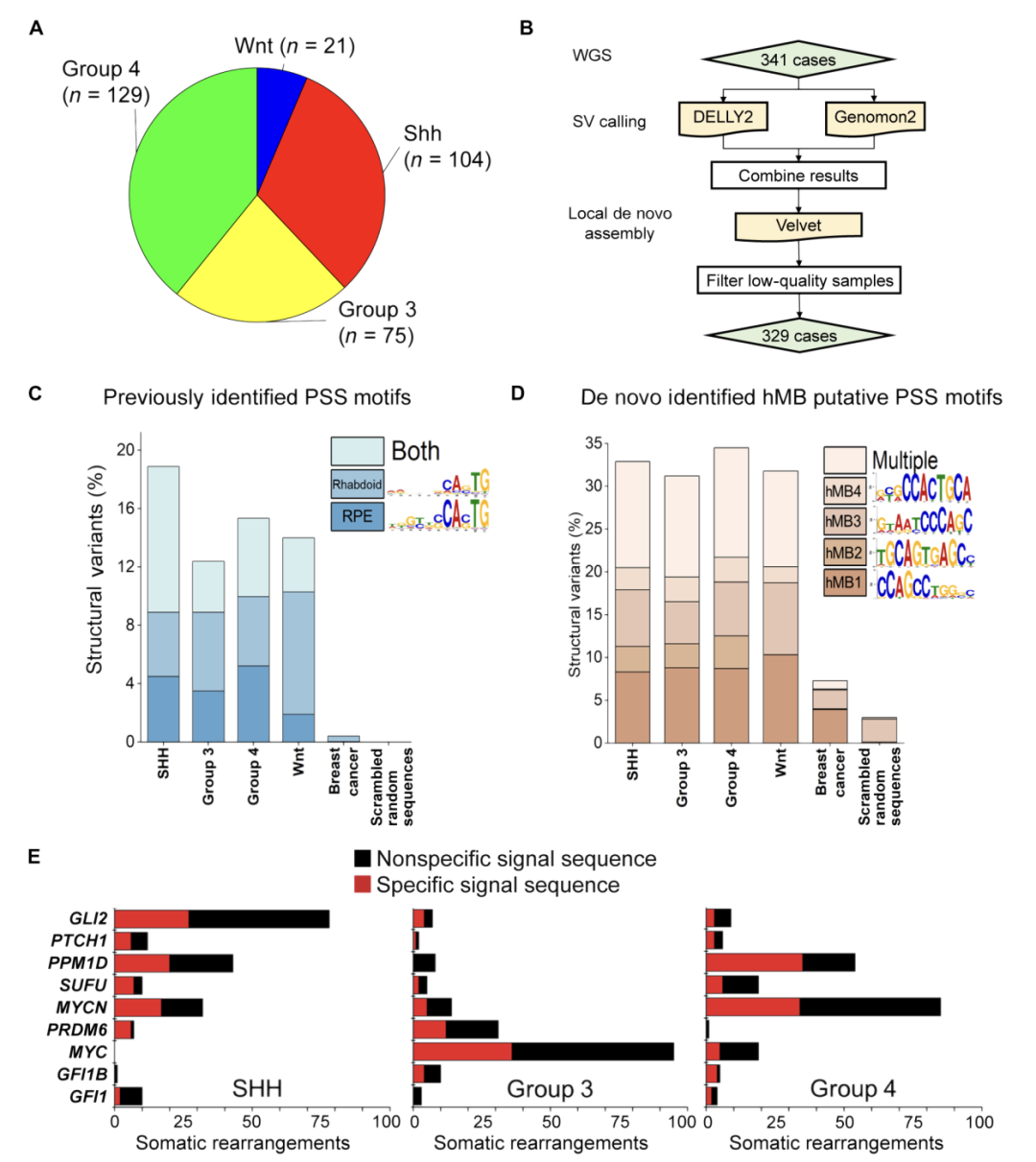
PDGB5相关的序列断点在人类髓母细胞瘤中的分布情况
为了研究PDGB5在人类髓母细胞瘤中的作用,研究者通过分析329名患者的肿瘤基因组,发现几乎五分之一的体细胞MB DNA重排断点含有PSS基序,这些基序之前在基因组转座和前向遗传实验中被观察到被PDGB5重排。这表明PDGB5在人类髓母细胞瘤的发展中可能也扮演了重要角色。

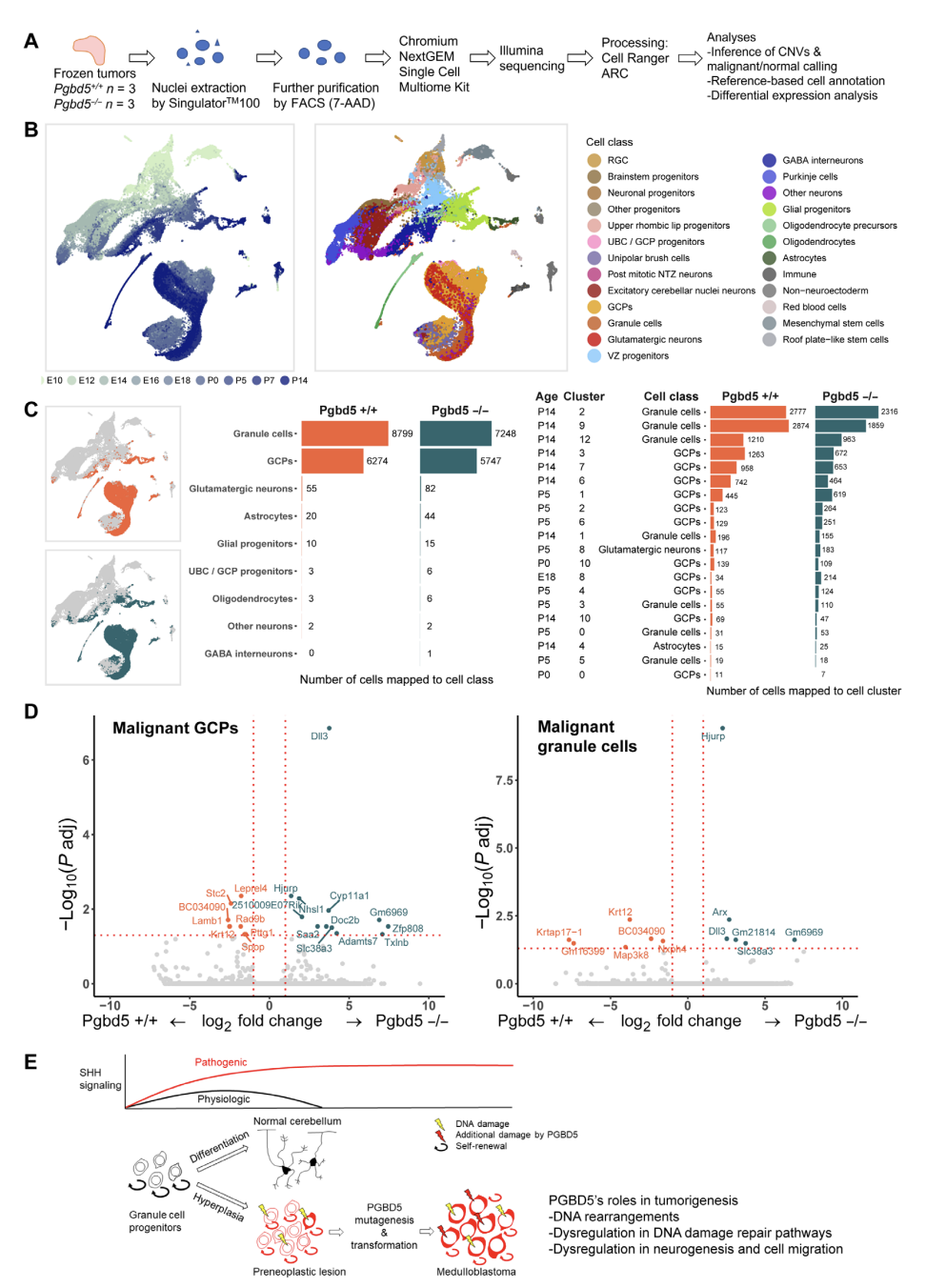
最后,为了探究PDGB5的潜在致病机制,研究团队对小鼠肿瘤进行了RNA测序。研究发现PDGB5还可能通过影响神经前体细胞的发育和DNA损伤修复机制来促进肿瘤的发展。通过测序分析,研究团队发现PDGB5在肿瘤细胞中的表达显著影响了与DNA损伤修复、神经发生和细胞迁移相关的基因的表达。这表明PDGB5不仅在引发突变方面发挥作用,还可能在肿瘤细胞的转化和进展中起到关键作用。
总之,这项研究为我们理解儿童髓母细胞瘤的复杂性提供了新的视角。 PDGB5作为一种在肿瘤发展中起到关键作用的基因,不仅通过引发特定的DNA重排来促进肿瘤的发展,还可能通过影响神经前体细胞的发育和DNA损伤修复机制来发挥作用。 这些发现不仅有助于我们更好地理解这种癌症的生物学机制,还可能为开发新的治疗策略提供重要的线索。
撰文

责编

制作
排版 | Sheila 校对 | uu
▼滑动查看更多▼
Genomic rearrangements are a hallmark of most childhood tumors, including medulloblastoma, one of the most common brain tumors in children, but their causes remain largely unknown. Here, we show that PiggyBac transposable element derived 5 (Pgbd5) promotes tumor development in multiple developmentally accurate mouse models of Sonic Hedgehog (SHH) medulloblastoma. Most Pgbd5-deficient mice do not develop tumors, while maintaining normal cerebellar development. Ectopic activation of SHH signaling is sufficient to enforce cerebellar granule cell progenitor-like cell states, which exhibit Pgbd5-dependent expression of distinct DNA repair and neurodevelopmental factors. Mouse medulloblastomas expressing Pgbd5 have increased numbers of somatic structural DNA rearrangements, some of which carry PGBD5-specific sequences at their breakpoints. Similar sequence breakpoints recurrently affect somatic DNA rearrangements of known tumor suppressors and oncogenes in medulloblastomas in 329 children. This identifies PGBD5 as a medulloblastoma mutator and provides a genetic mechanism for the generation of oncogenic DNA rearrangements in childhood cancer.
DOI: 10.1126/sciadv.adn4649
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/01/Science%20Adv%20%7C%20%E6%8F%AD%E7%A7%98Pgbd/
THE END


 PDGB5表达的肿瘤与PDGB5缺失的肿瘤在体细胞结构变异(SVs)数量上的对比
PDGB5表达的肿瘤与PDGB5缺失的肿瘤在体细胞结构变异(SVs)数量上的对比 



