【DCR专区 | 每月精选文章】局部切除与根治性切除治疗G2级直肠神经内分泌肿瘤的多中心倾向评分匹配分析
翻译: 张木梓 吉林市肿瘤医院,梁逸超 中国医科大学附属盛京医院
审校: 池诏丞 吉林省肿瘤医院
摘要
背景: 针对 G2级直肠神经内分泌肿瘤的研究有限,该类肿瘤的最佳治疗方法尚未确定。
目的: 比较局部切除与根治性切除治疗 G2级直肠神经内分泌肿瘤的肿瘤学结局
设计: 回顾性多中心倾向评分匹配研究,使组间异质性最小化,并关注手术策略之间的差异。
设置: 17家中国大型医疗中心参与本研究。
患者: 回顾性分析 144例经病理证实的G2级直肠神经内分泌肿瘤患者。
主要观察指标: 通过评估癌症特异性生存和无复发生存对手术策略进行比较。
结果: 本研究共纳入 144例G2级直肠神经内分泌肿瘤患者。27例患者接受了内镜下切除,55例接受了经肛门切除,50例接受了根治性切除,12例接受了姑息性手术或远处转移活组织检查。在接受根治性切除的50例患者中,根据组织病理学结果,30例(60.0%)患者淋巴结呈阳性。预测癌症特异性生存的肿瘤大小的最佳截断值为1.5cm。G2级直肠神经内分泌肿瘤≤1.5cm的患者,局部切除组和根治性切除组的癌症特异性生存率和无复发生存率无显著差异( P >0.05)。在G2级直肠神经内分泌肿瘤>1.5cm的患者中,局部切除组的无复发生存率显著低于根治性切除组( P =0.04)。
局限性: 回顾性分析的性质和相对较短的随访期。
结论: G2级直肠神经内分泌肿瘤有不容忽视的淋巴结转移率。对于肿瘤≤1.5cm且无转移的患者,局部切除是可行的选择,而对于肿瘤>1.5cm的患者,根治性切除更加有利。
关键词: 局部切除;淋巴结转移;根治性切除;直肠神经内分泌肿瘤
神经内分泌肿瘤( neuroendocrine tumors,NET)是起源于肽能神经元和神经内分泌细胞,具有神经内分泌分化,表达神经内分泌标志物的罕见肿瘤 1 。可发生于全身各处,以胃肠道、胰腺和肺部最常见 2 。直肠是第三大最常见的发生 NET的部位,2012年的发病率为1.20/10万 2 。根据 Ki-67指数和有丝分裂计数,直肠神经内分泌肿瘤( RNET )可分为三个亚型,存在显著异质性:高分化的 G1型RNET:表现为惰性行为,预后良好;中分化的G2级RNET具有中等转移风险,以及低分化的G3级RNET(也称为神经内分泌癌,NEC)转移风险高且预后差 3,4 。肿瘤分级是 RNET转移和预后的主要预测因素 5,6 。
目前,欧洲神经内分泌肿瘤学会( European Neuroendocrine Tumor Society,ENETS)和中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)都推荐G1级RNET和G2级RNET采用类似的治疗方法。然而,由于G2级RNET较罕见,导致大多数研究将G1级RNET和G2级RNET一起分析,这可能低估了G2级RNET的转移风险和不良预后。因此,对这一亚群进行更精确的描述是指导适当治疗的必要条件。在本研究中,我们利用中国17个大型医疗中心的大型多中心数据库数据,阐明G2级RNET的临床病理特征和预后因素,并为该类患者提出合理的手术方式。
患者与数据收集
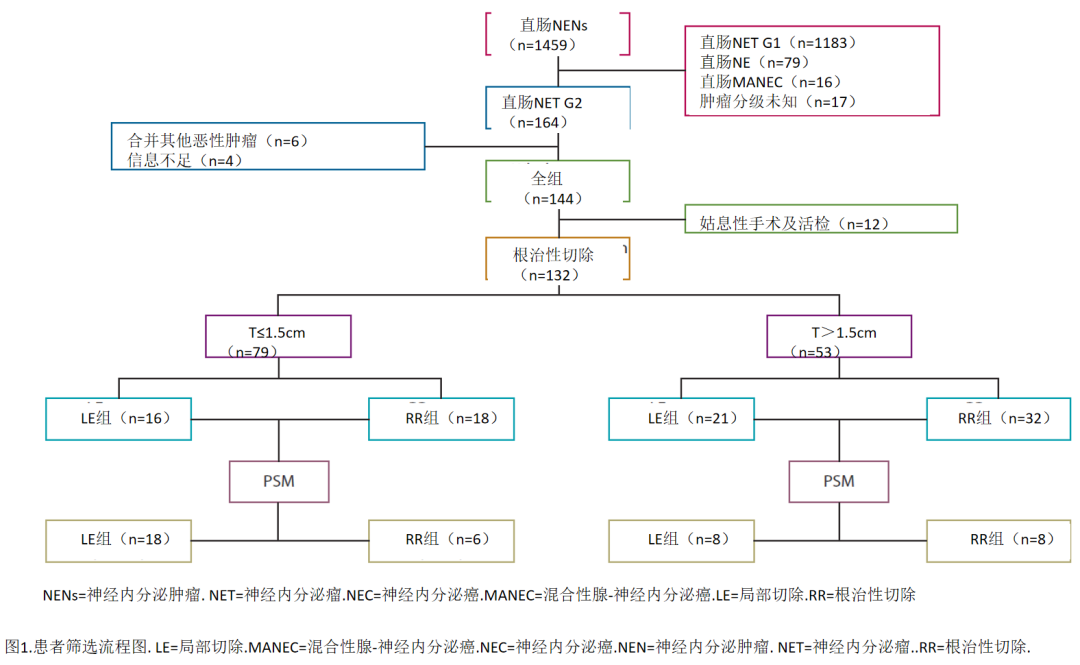
本研究回顾性分析 2010年1月1日至2022年4月30日在中国17个大型医疗中心诊断为G2级RNET的患者的数据。人口统计、临床病理、治疗和结果数据由具有网络专业知识的调查者使用标准化数据收集模板从每家医院的电子病历中提取。纳入标准为:(1)病理证实为神经内分泌肿瘤;(2)肿瘤分级为G2;(3)原发性直肠神经内分泌肿瘤。排除标准如下:(1)合并其他恶性肿瘤;(2)临床资料或随访资料不完整。1459例符合纳入标准的患者中,共有144例纳入本研究。确定符合条件的研究对象的程序如图1所示。我们的工作得到了所有17个参与中心的伦理委员会的批准。最后一次随访时,我们向在世的患者详细告知研究情况,并取得在他们签署的知情同意书。对于在研究时已去世的患者,我们联系了他们的直系亲属,详细解释了这项研究,并获得了他们签署的知情同意书。
标准
根据病理报告中记录的肿瘤最大直径来确定肿瘤大小。在只进行活检的病例中,肿瘤大小是根据治疗前的内镜检查结果确定的。对于接受姑息性手术的患者,根据影像学报告确定肿瘤大小。肿瘤分期依据美国癌症联合委员会( the American Joint Committee on Cancer,AJCC)癌症分期手册,肿瘤分级依据WHO 2010分级。有丝分裂计数以显微镜下苏木精和伊红染色(HE)载玻片的十个高倍视野中有丝分裂细胞的数量表示。Ki-67指数以免疫组织化学标记的细胞百分比计算。T分期≥T2、淋巴结转移、神经血管侵犯或肿瘤大小>2cm的患者被视为高复发风险患者,多学科团队参与制定这类患者的辅助治疗方案。对于生长抑素受体阳性的患者,推荐使用生长抑素类似物治疗。
随访
癌症特异性生存( cancer-specific survival,CSS)定义为从诊断到因神经内分泌肿瘤死亡之间的时间间隔。无复发生存期(relapse-free survival,RFS)定义为接受肿瘤切除的患者,计算从干预日期到复发日期之间的时间间隔。所有患者均通过电话、门诊和住院方式进行随访。完全切除后患者每6个月随访一次,5年后每年随访一次;接受姑息性切除或活检的患者每3个月随访一次。最后一次随访时间为2022年7月。随访检查包括血常规检查、嗜铬粒蛋白A检查、胸部CT扫描、全腹和盆腔CT或MRI增强扫描,怀疑复发或转移时行PET-CT检查。失访的定义是未能与患者或其家属取得联系。
统计分析
连续变量以四分位数范围的中位数表示,并使用 t检验或 Mann-Whitney U检验 进行评估。分类数据以数字和百分比表示,并使用卡方检验或 Fisher精确检验进行分析。采用Kaplan-Meier法分析CSS和RFS,单变量分析采用log-rank检验,多变量分析采用Cox比例风险回归进行变量比较。对局部切除(local excision,LE)组和根治切除(radical resection,RR)组结果的其他混杂因素影响通过倾向评分匹配(propensity score matching,PSM)最小化 8 。为了完成患者的匹配,我们根据倾向评分的逻辑,采用了 最近邻匹配算法 。在评估匹配协变量平衡时,标准偏差小于 10%被认为是可接受的。
采用 R软件(版本3.1.0)进行统计分析。使用X-tile软件确定连续变量的最佳截断值。单因素分析中 P < 0.10的变量纳入多因素分析。 P < 0.05被认为统计学显著差异。
人口统计学和临床病理学特征
本研究总共纳入 144例G2级RNET患者,其中男性88例(61.1%)和女性56例(38.9%)。中位年龄为51.0(40.0-64.0)岁,中位肿瘤大小为1.5(0.7-2.2)cm,距肛缘中位距离为5.0(3.5-8.0)cm。根据TNM分期,89例(61.8%)患者为T1期,24例(16.7%)为T2期,22例(15.3%)为T3期,9例(6.3%)为T4期。27例(18.8%)患者行内镜下切除,55例(38.2%)行经肛切除(transanal excision,TAE),50例(34.7%)行根治性切除。12例(8.4%)患者由于远处转移而进行姑息 性手术和活检,其中 9例(75.0%)仅肝转移,2例(16.7%)仅骨转移,1例(8.3%)同时存在肝转移和骨转移。在接受根治切除术的50例患者中,30例(60.0%)根据组织病理学结果存在阳性淋巴结。G2级RNET患者的人口统计学和临床病理学特征见表1总结。
肿瘤特异性生存的预后因素
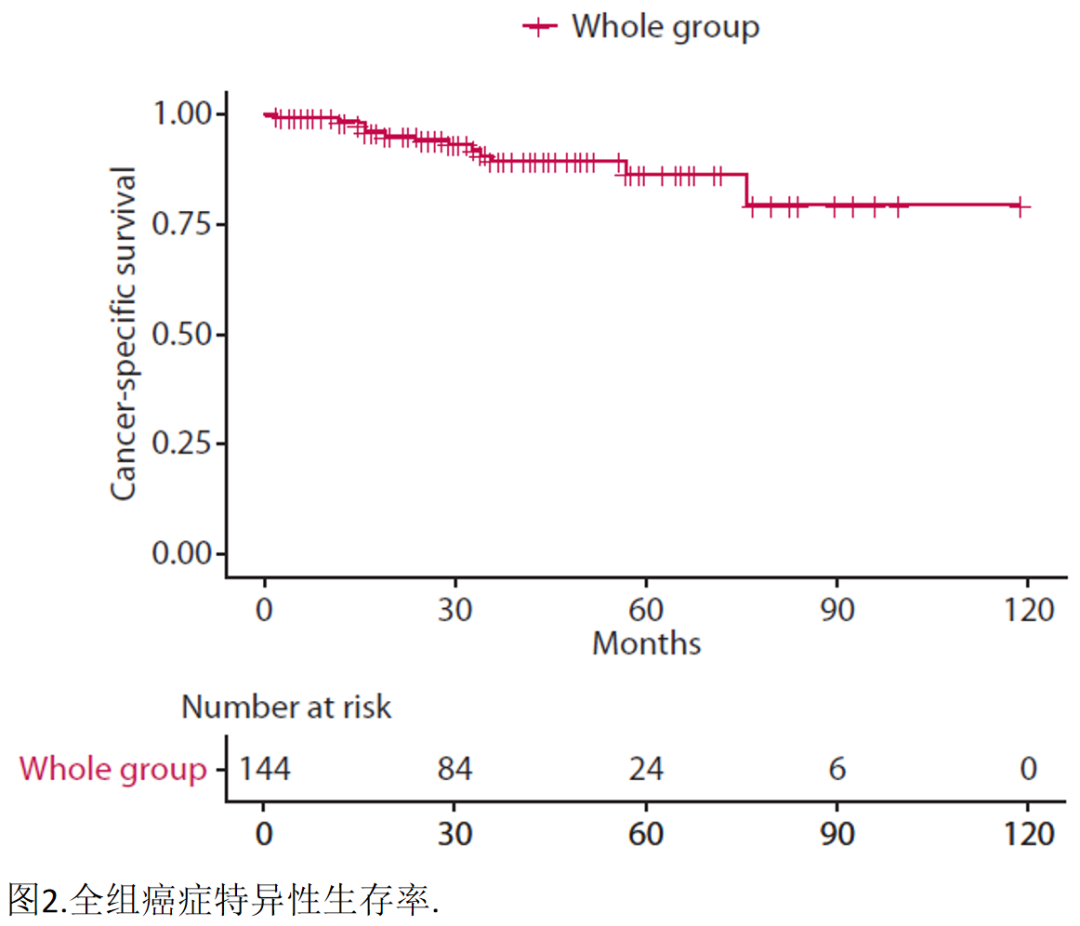
患者最短的随访时间为 2个月,最长为119个月,中位随访时间为34.0个月。在随访期间,共有13例患者(9.0%)死于肿瘤相关原因。全组的1年、3年和5年CSS率分别为98.5%、89.6%和86.5%(图2)。
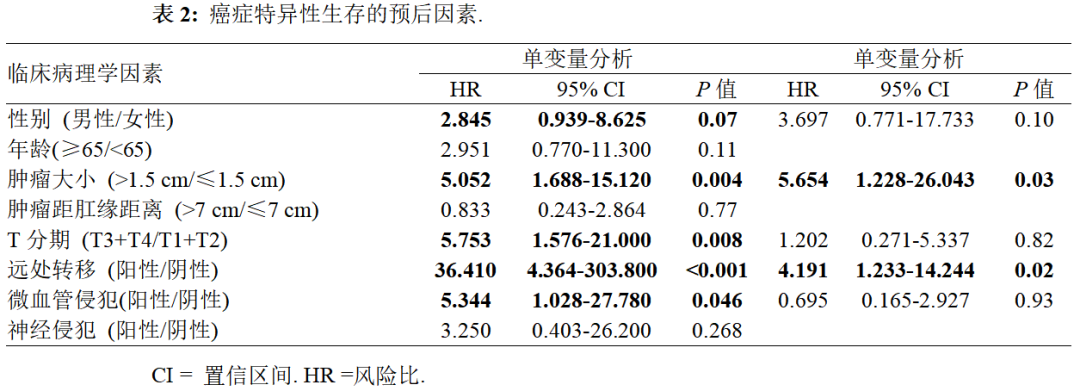
预测 CSS的最佳肿瘤直径截断值为1.5cm。在单变量分析中,肿瘤大小( P =0.004)、T分期( P =0.008)、远处转移( P <0.001)和微血管浸润( P =0.046)均与CSS相关。肿瘤大小>1.5cm(HR=5.654,95%CI:1.228-26.043, P =0.03)和远处转移(HR=4.191,95%CI:1.233-14.244, P =0.02)是多变量分析中的显著预后因素。CSS的log-rank检验和Cox比例风险回归分析见表2。
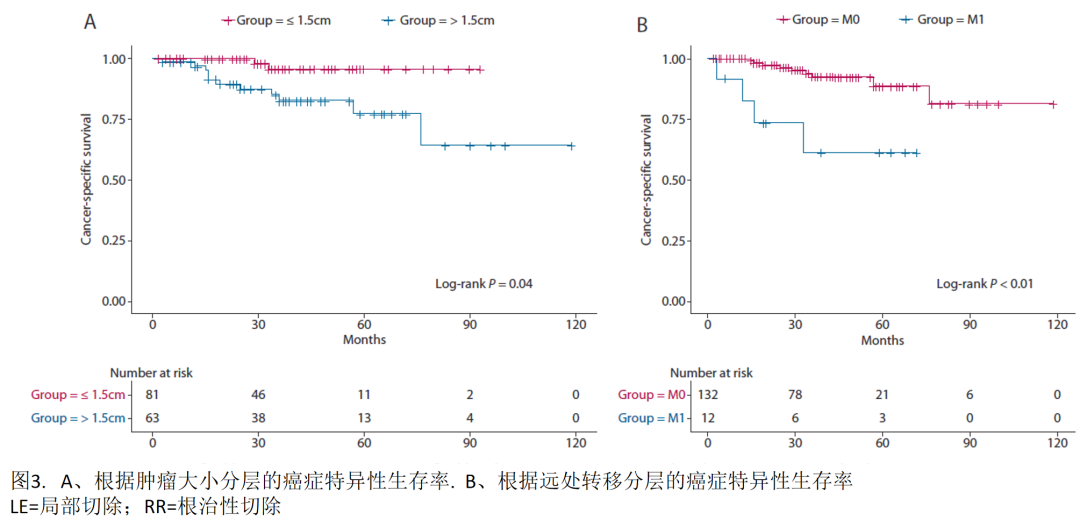
肿瘤大小 ≤1.5cm的患者3年CSS率为95.7%,肿瘤大小>1.5cm的患者3年CSS率为82.3%。无远处转移的患者3年CSS率为93.8%,而有远处转移的患者3年CSS率为61.1%。根据肿瘤大小和远处转移的生存曲线见图3A和3B。
切除类型比较
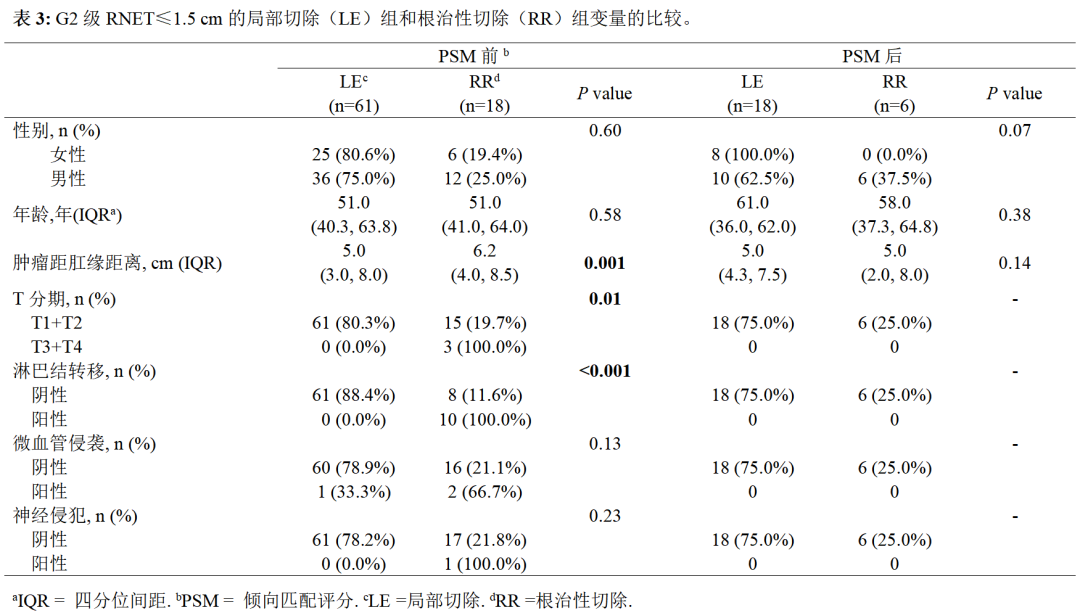
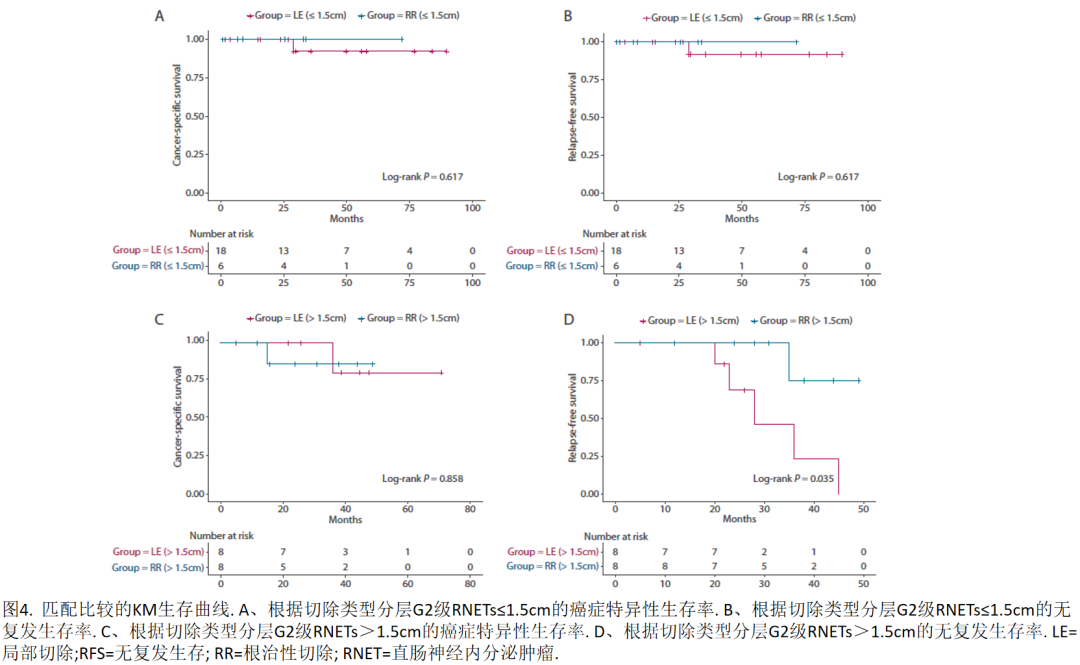
在 144例患者中,132例(91.7%)行肿瘤完全切除,其中内镜下切除27例(20.4%),经肛切除55例(41.7%),以及根治性切除50例(37.9%)。其中132例患者中,有30例(22.7%)接受了辅助治疗。132例患者中,有79例肿瘤直径≤1.5cm。在这79例患者中,有61例行LR(包括内镜下切除和经肛切除),18例行根治行RR。在倾向性评分匹配之前,LE组患者肿瘤距肛缘距离显著低于RR组( P =0.001),T分期显著低于RR组( P =0.01)。匹配后无显著差异性。两组在匹配前后的临床病理特征见表3。3年CSS率LE组为91.7%,RR组为100.0%,差异无统计学意义( P =0.62)。3年 RFS 率 LE组为91.7%,RR组为100.0%,差异无统计学意义( P =0.62)。不同类型的生存曲线见图4A和4B。
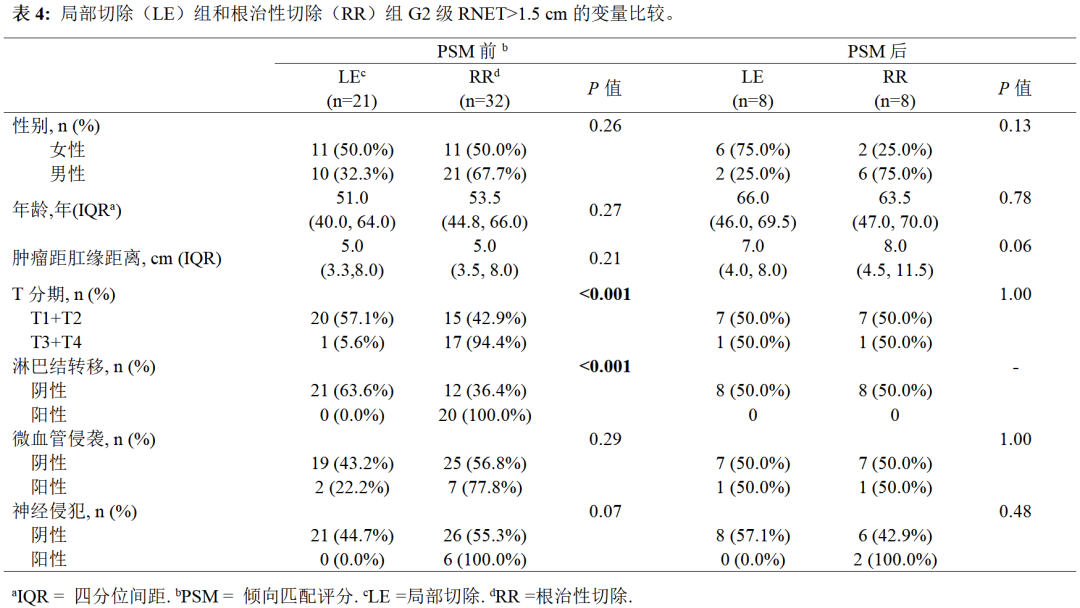
132例患者中,有53例肿瘤直径> 1.5cm。在这53例患者中,21行LE,32名行RR。在倾向性评分匹配之前,LE组患者的T分期显著低于RR组( P =0.0003)。匹配后没有显著差异。两组在匹配前后的临床病理特征见表4。3年CSS率为LE组80.0%,RR组为85.7%,差异无统计学意义( P =0.86)。LE组3年 RFS 率为 22.9%,RR组为75.0%,差异具有统计学意义( P =0.04)。在倾向性评分匹配后,在大于1.5cm肿瘤并接受局部切除的8例患者中,有5例患者发生了复发。其中,3例患者仅发生肝转移,而2例患者同时发生了腹腔和肝转移。不同切除类型的生存曲线见图4C和4D。
在本研究中,我们旨在探讨 G2级RNET患者的淋巴结转移情况。由于LE、活检和姑息性手术的患者可能无法通过影像学检测到淋巴结转移,因此仅将行RR+淋巴结清扫的患者纳入淋巴结转移分析。病理学检查被用作判断淋巴结转移情况的标准。50例行RR+淋巴清扫的患者中,根据病理组织学结果,30例(60.0%)患者存在阳性淋巴结。既往的研究表明,G2级RNET的淋巴结转移率为20%至44% 1,7,10 ,表明 G2级RNET具有显著的淋巴结转移率。CT和MRI均能准确判断RNET的淋巴结转移情况,转移性淋巴结表现为异常的大小或形态学表现 11 。 Ushigome等人证明了CT在诊断RNET淋巴结转移中的敏感性高达0.820 12 。基于此,建议对大于 1cm的RNET进行常规CT或MRI检查 13 。此外,内镜超声( endoscopic ultrasonography,EUS)被发现有助于评估RNET的区域性淋巴结,并识别可能的转移迹象 11 。 PET-CT也对确定全身淋巴结转移的情况有所帮助。Zhou等报告68Ga-DOTANOC PET-CT是预测淋巴结转移的有效工具,其敏感性为0.778,特异性为0.917 14 。因此,临床医生在考虑局部切除时应谨慎。传统的增强 CT、EUS、PET-CT、病理活检和其他检查可能有助于评估肿瘤,以选择最合适的治疗方案,尽管本研究未评估这些方法的预测性。
RNET是胃肠道神经内分泌肿瘤中预后最好的亚型,5年总生存率( overall survival, OS)为96% 15 。然而,最近的研究表明,并非所有 RNET都表现为惰性,其预后很大程度上取决于肿瘤大小。Sohn等人对64例RNET患者进行了回顾性分析,结果显示RNET≥2cm的患者的5年OS率显著低于< 2cm组,仅为31.3% 6 。此外,远处转移是影响 RNET患者预后的独立危险因素。AJCC分期系统将所有远处转移的RNET归类为IV期 16 。 Modlin等人发现,伴有远处转移的患者预后较差,5年OS率仅为30.0% 17 。根据本研究的结果,发现 G2级RNET的患者总体预后良好,其5年CSS率为86.5%。然而,肿瘤较大且存在远处转移的患者,预后明显较差。这突显了对G2级RNET进行早期监测的重要性,尤其是当肿瘤仍处于早期阶段,其特点是肿瘤直径小且无远处转移。早期发现和适当治疗相比于晚期诊断可以大大地改善患者的预后。
RR,包括低位前切除术和腹会阴联合切除术,是RNET的常用治疗方式。然而,与LE相比,RR可能术后并发症发生率较高,尽管它可以实现更完整的肿瘤切除并改善患者的生存率 18,19 。此外, RR可导致较差的功能预后,有高达90%的患者在保肛手术后出现排便习惯改变 20 ,许多患者出现排便急迫、排便频繁和失禁 21,22 ,排便功能异常会严重影响患者的生活质量。因此,选择 LE和RR对于治疗RNET患者来说至关重要。欧洲神经内分泌肿瘤学会( The European Neuroendocrine Tumor Society, ENETS)建议对于直径小于2cm且T分期较早的G2级RNET,可以进行内镜下切除或经肛切除,以实现完全切除和长期令人满意的预后。同样,国家综合癌症网络( the National Comprehensive Cancer Network, NCCN)也建议对于肿瘤小于2cm的患者进行内镜下切除或经肛切除。然而,日本神经内分泌肿瘤学会( The Japanese Neuroendocrine Tumor Society, JNETS)认为,直径大于1cm的RNET与同一部位的腺癌具有相同的淋巴结转移风险,因此建议进行RR 24,25 。在本研究中,术前影像结果是 G2级RNET患者选择手术方式的重要参考。通过与患者及其家人的有效沟通,我们在仔细评估肿瘤大小、T分期和淋巴结转移情况后确定了最佳的手术方案。对于直径小于1cm的肿瘤,建议进行LE。对于直径大于2cm的肿瘤,建议进行RR。对于直径介于1至2cm之间的肿瘤,我们建议对于T分期≥T2或淋巴结转移的患者进行RR,而对于T分期为T1且淋巴结为阴性的患者建议LE。然而,在LE组和RR组的比较中,这显然会使队列偏向于一个特定的结果。因此,为了尽量减少潜在的选择偏差,我们根据患者的临床病理特征进行了匹配分析。我们的研究结果表明,1.5cm是G2级RNET预后分析的最佳截断值。此外,我们发现在G2级RNET直径小于1.5cm的患者中,LE组和RR组的CSS和RFS之间没有统计学上显著差异。然而,在G2级RNET直径大于1.5cm的患者中,RR组的RFS明显优于LE组。根据我们的分析,我们建议对于通过活检确认的直径小于1.5cm的G2级RNET进行LE,而对于直径大于1.5cm的G2级RNET,建议行RR以降低术后复发率。
本研究存在一些局限性。首先,尽管我们使用了倾向性评分匹配来减少潜在的偏倚,并使用亚组分析来研究手术方式对患者预后的影响,但回顾性研究的性质仍然影响了本研究的统计能力,降低了临床价值。此外, RNET是生长缓慢的肿瘤 26 ,因此需要更长的随访期来进行患者病情的临床评估。然而,据我们所知,这是目前针对 G2级RNET的最大研究,可为G2级RNET的治疗提供一些指导。
总之, G2级RNET有着不可忽略的淋巴结转移率,临床医生在考虑局部切除时应谨慎。对于直径小于等于1.5cm且无转移的G2级RNET建议LE,能够达到与RR相似的CSS和RFS;而对于直径大于1.5cm的G2级RNET,RR更为合适,因为可以获得更好的RFS。然而,本研究的结果需要通过更大样本量的回顾性研究或随机对照试验进行进一步验证。
滑动阅读参考文献
链接:http://www.lewenyixue.com/2024/07/12/%E3%80%90DCR%E4%B8%93%E5%8C%BA%20%7C%20%E6%AF%8F%E6%9C%88%E7%B2%BE%E9%80%89%E6%96%87%E7%AB%A0%E3%80%91%E5%B1%80%E9%83%A8%E5%88%87%E9%99%A4/
如果本内容对您有帮助,欢迎给我打赏,支持创作