李印教授牵头全球首个食管癌围术期免疫III期ESCORT-NEO研究荣登Nature Medicine,中国方案再获国际
前言
7月2日,由赫捷院士指导、中国医学科学院肿瘤医院李印教授团队牵头开展、全国24家中心共同参与的一项“卡瑞利珠单抗联合化疗对比化疗新辅助治疗可切除局晚期食管鳞癌(ESCC)”的全国多中心、随机、平行对照III期试验ESCORT-NEO/NCCES01研究重磅发表在世界顶尖医学期刊《Nature Medicine》上(IF:82.9分)1。
研究结果表明,新辅助卡瑞利珠单抗联合白蛋白紫杉醇和顺铂(Cam+nab-TP)或新辅助卡瑞利珠单抗联合紫杉醇和顺铂(Cam+TP)对比单纯新辅助TP显著提高患者病理完全缓解(pCR)率,引发国际医学界的广泛关注和热烈讨论,继入选2024年ASCO GI口头报告后,5月13日又被《Nature Medicine》接收,该研究再度掀起医学界波澜!
ESCORT-NEO研究正式在线发表于Nature Medicine
研究背景
食管癌是一个重要的全球健康问题,在所有癌症中发病率排名第七位,死亡率排名第六位,中国占全球ESCC病例的一半以上2,3。CROSS、NEOCLTEC5010和JCOG9907等研究证明了局晚期食管癌新辅助放化疗/新辅助化疗相对于单独手术延长患者总生存4-6。而CMISG1701、JCOG1109显示局晚期食管癌的新辅助放化疗相比新辅助化疗并未进一步提高患者总生存7-9。因此,最佳新辅助治疗策略仍悬而未决。因此,启动了ESCORT-NEO研究,旨在评估新辅助卡瑞利珠单抗联合nab-TP或TP方案对比新辅助TP治疗局晚期ESCC患者的疗效和安全性。
研究方法
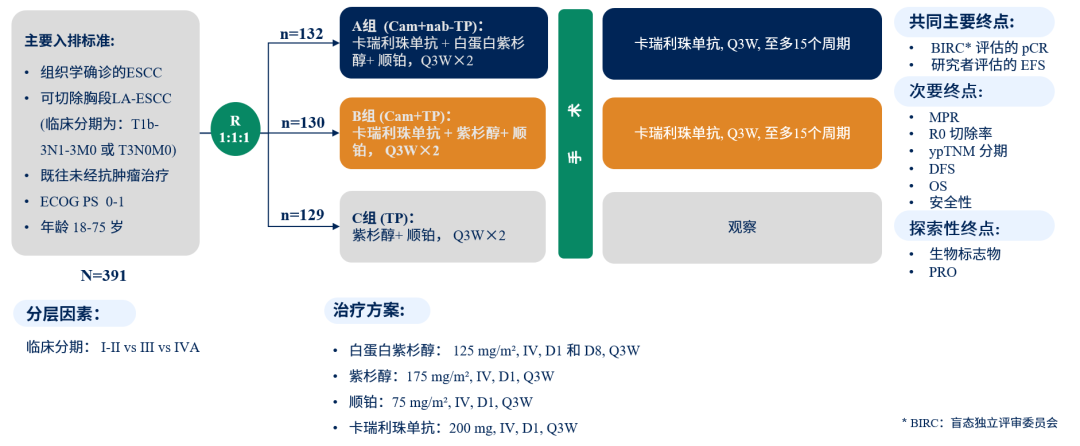
ESCORT-NEO研究是一项多中心、随机、开放的Ⅲ期临床研究(ChiCTR2000040034),招募18-75岁,临床分期为T1b-3N1-3M0或T3N0M0的初治可手术局晚期胸段食管鳞癌患者,ECOG PS 评分0-1分,按照1:1:1随机分配到A(Cam+nab-TP)组,B(Cam+TP)组或C(TP)组,并根据临床分期(Ⅰ/Ⅱ vs Ⅲ vs ⅣA)进行分层。分别接受2个周期新辅助治疗,新辅助末次治疗结束4-6周行食管癌根治术。A(Cam+nab-TP)组和B(Cam+TP)组术后进行15个周期的卡瑞利珠单抗辅助治疗,C组术后观察随访。
主要终点包括盲态独立评审委员会(BIRC)评估的病理完全缓解率(pCR)和研究者评估的无事件生存期(EFS)。次要终点包括主要病理缓解率(MPR)、R0切除率、ypTNM分期、无进展生存期(DFS)、总生存期(OS)和安全性。
图1. ESCORT-NEO研究设计
研究结果
1
基线与受试者分布
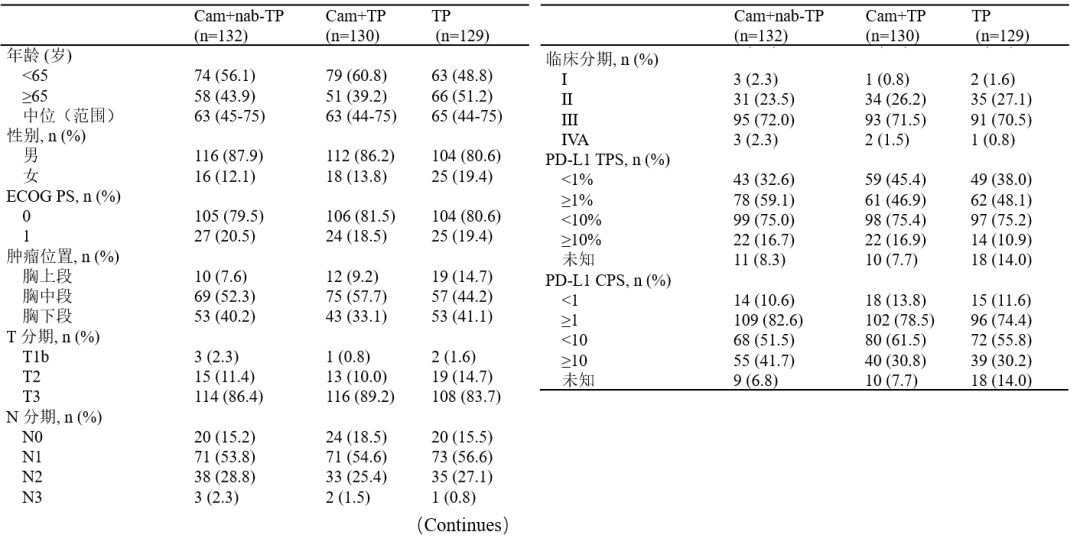
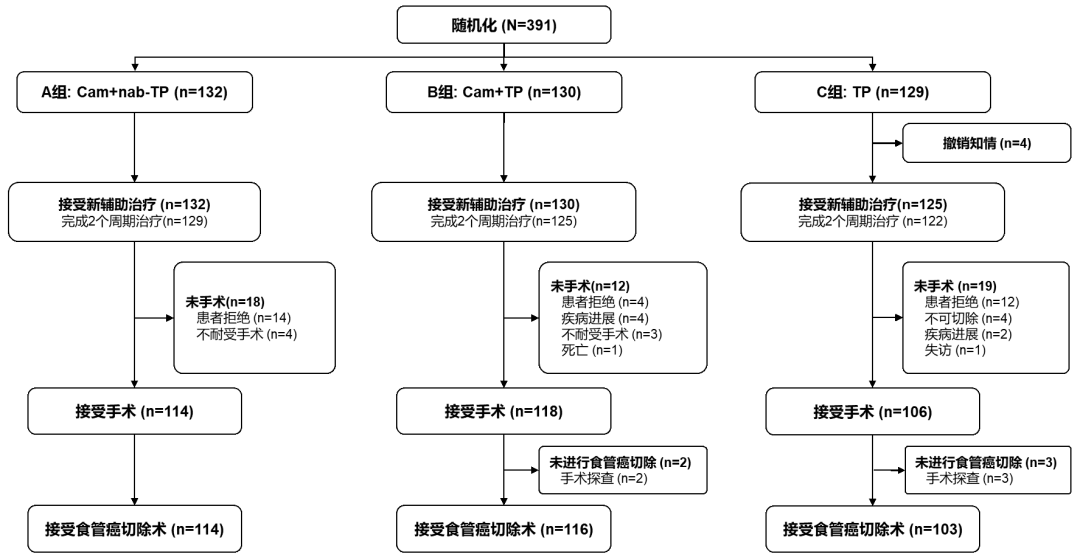
2021年4月28日至2023年8月7日,共有391例患者入组。随机分配到A(Cam+nab-TP)组132例,B(Cam+TP)组130例和C(TP)组129例。数据截止日期为2023年10月8日,中位随访时间8.2个月。中位年龄63岁,84.9%为男性,临床分期I、II、III、IVA期分别为1.5%、25.6%、71.4%和1.5%。
表1. ITT人群基线特征
图2. 受试者分布
2
手术情况
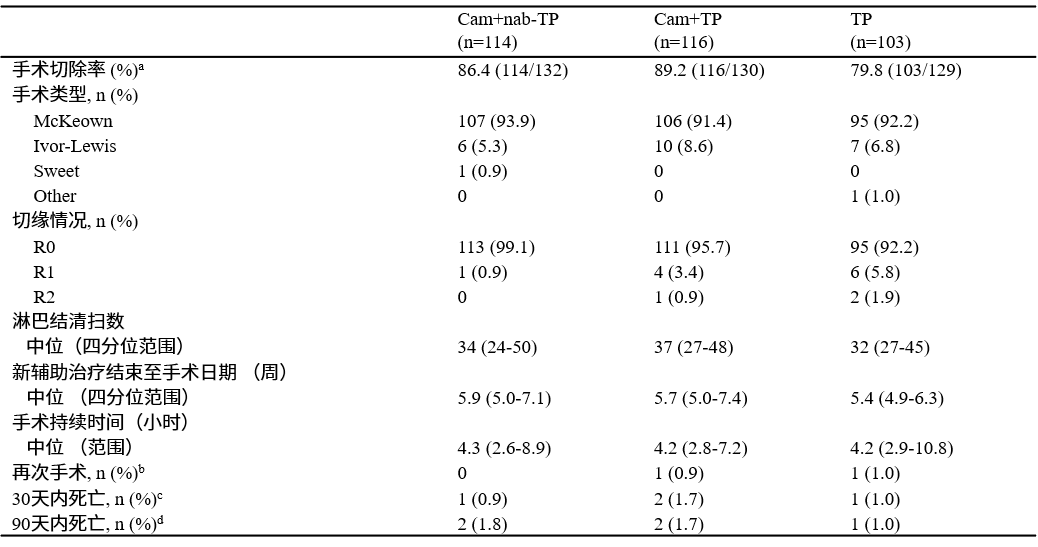
A组、B组和C组手术率分别为86.4%,89.2%和79.8%,新辅助治疗结束至手术的中位时间分别为5.9(IQR:5.0-7.1),5.7(IQR:5.0-7.4)和5.4(IQR:4.9-6.3)周,93.9%、91.4%和92.2%采用McKeown术式,中位淋巴结清扫数分别为34(IQR:24-50),37(IQR:27-48)和32(IQR:27-45)。R0切除率分别为99.1%、95.7%和92.2%。
表2. 手术总结
3
疗效结果
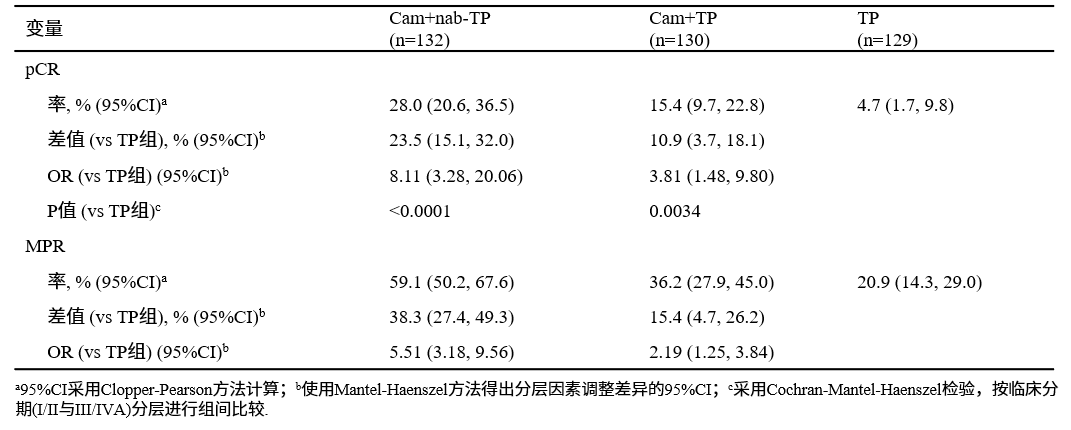
意向治疗(ITT)人群中BIRC评估的pCR率A组28.0%(95% CI:20.6-36.5)和B组15.4%(95% CI:9.7-22.8)相比对照组C组的4.7%(95% CI:1.7-9.8)显著提高,A组 vs C组OR=8.11(95% CI:3.28-20.06,P<0.0001),B组 vs C组OR=3.81(95% CI:1.48-9.80,P=0.0034),均达到主要终点。
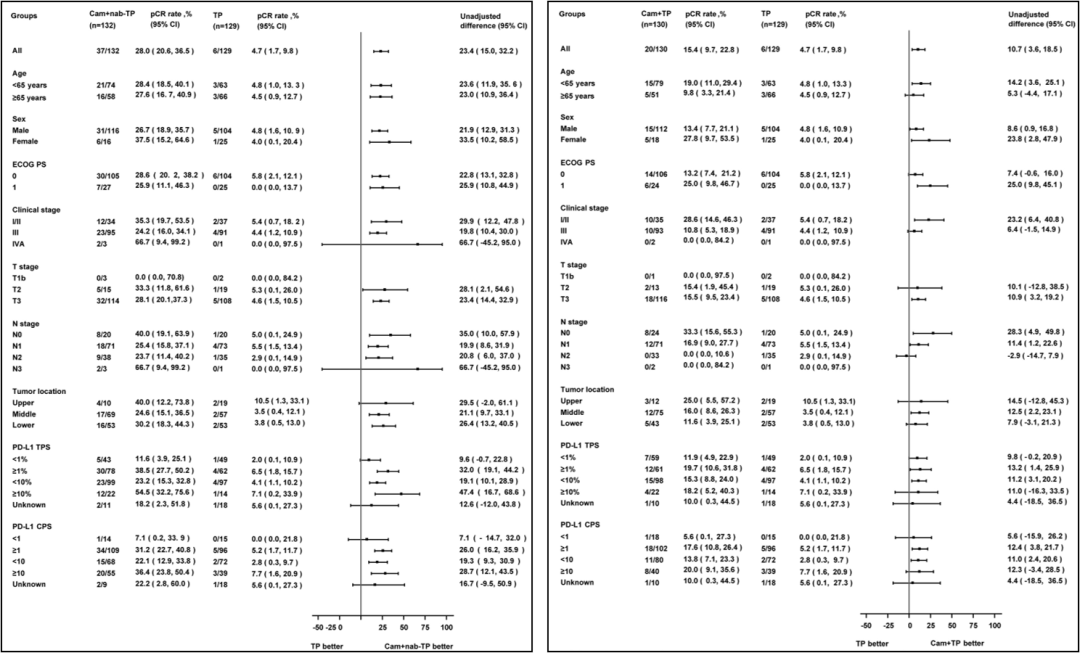
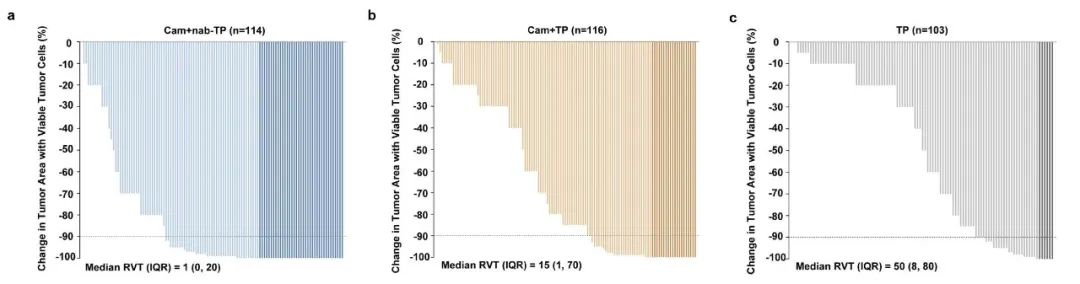
亚组分析显示,各亚组pCR差值趋势与主分析结果一致。A、B、C组MPR率分别为59.1%、36.2%和20.9%,原发灶中位残留活肿瘤细胞分别为1%(IQR:0-20)、15%(IQR:1-70)和50%(IQR:8-80)。EFS和OS数据还未成熟。
表3. ITT人群中盲法独立病理评估结果
图3. pCR亚组分析(A组 vs C组和B组 vs C组)
图4. 原发灶残留活肿瘤细胞百分比
4
安全性
A、B和C组手术并发症发生率分别为34.2%、38.8%和32.0%,≥3级手术并发症发生率分别为6.1%、12.1%和6.8%。B组和C组各有一例患者因粘连性肠梗阻和吻合口瘘需要再次手术。A组术后30天死亡1例(猝死,原因不明),B组2例(感染性休克),C组1例(心肌梗死)。A组术后90天内增加1例死亡(严重肺炎)。
新辅助治疗期间A、B和C组治疗相关不良事件发生率分别为93.9%、83.1%和83.2%,≥3级治疗相关不良事件发生率分别为34.1%、29.2%和28.8%。A、B和C组SAE发生率分别为7.6%、9.2%和5.6%。A、B和C组TRAE导致新辅助治疗中止的发生率分别为3.0%、3.8%和0.8%。A和B组因TRAE而停用卡瑞利珠单抗的比率均为0.8%。免疫相关不良事件(irAE),A组和B组的发生率分别为27.3%和24.6%,≥3级irAE发生率为4.5%(6/132)和3.8%(5/130)。
总 结
ESCORT-NEO研究是第一项评估局晚期ESCC新辅助免疫联合化疗对比新辅助化疗疗效和安全性的III期试验。主要终点pCR取得阳性结果,卡瑞利珠单抗联合化疗可显著提高ITT人群的pCR率。联合治疗方案安全可耐受,没有增加毒性。EFS和OS还在随访。这项研究为局晚期ESCC新辅助治疗提供了新的证据,并为制定和优化未来的治疗策略奠定了基础。
研究者介绍
赫捷 院士
- 中国科学院 院士
- 中国国家癌症中心 主任
- 中国医学科学院肿瘤医院 院长
- 胸外科主任医师教授
- PROFESSIONAL ACTIVITIES
- 中华医学会 副会长
- 中华医学会胸心血管外科学分会 主任委员
- 中国医师协会 副会长
- 中国抗癌协会 副理事长
- HONORS AND AWARDS
- 国家科学技术进步奖 一等奖
- 英国皇家外科学院 院士
李印 教授
- 北京协和医学院教授、主任医师、博士研究生导师
- 中国医学科学院肿瘤医院食管外科主任
- 国家癌症中心食管癌诊疗质控中心专家委员会副组长兼秘书长
- 享受国务院特殊津贴专家
- 英国皇家外科学院院士
- 中国抗癌协会食管癌专业委员会副主任委员
- 中国医师协会胸外科医师分会食管外科专家委员会主任委员
- 中国医疗保健国际交流促进会胸外科分会食管癌学组组长
- 中华医学会胸心血管外科学分会食管疾病学组组长
- 中国临床肿瘤学会CSCO食管癌专委会侯任主任委员
- 中国食管疾病协会CSDE主席
- 大中华胸腔镜发展及推动委员会培训专家
- 卫生部胸外科医师定期考核编委会委员
- 《Annuals of Esophagus》杂志主编
- 《中国肺癌杂志》常委编委
参考文献:
[1] Qin, J., Xue, L., Hao, A. et al. Neoadjuvant chemotherapy with or without camrelizumab in resectable esophageal squamous cell carcinoma: the randomized phase 3 ESCORT-NEO/NCCES01 trial. Nat Med (2024). https://doi.org/10.1038/s41591-024-03064-w
[2] Sung, H. et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J. Clin. 71, 209–249 (2021). [3] Han, B. et al. Cancer incidence and mortality in China, 2022. J. Natl Cancer Center 4, 47–53 (2024).
[4] van Hagen, P. et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N. Engl. J. Med. 366, 2074–2084 (2012).
[5] Yang, H. et al. Neoadjuvant chemoradiotherapy followed by surgery versus surgery alone for locally advanced squamous cell carcinoma of the Esophagus (NEOCRTEC5010): A phase III multicenter, randomized, open-label clinical trial. J. Clin. Oncol. 36, 2796–2803 (2018).
[6] Ando, N. et al. A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann. Surg. Oncol. 19, 68–74 (2012).
[7] Tang, H. et al. Neoadjuvant chemoradiotherapy versus neoadjuvant chemotherapy followed by minimally invasive esophagectomy for locally advanced esophageal squamous cell carcinoma: a prospective multicenter randomized clinical trial. Ann. Oncol. 34, 163–172 (2023).
[8] Kato, K. et al. A randomized controlled phase III trial comparing two chemotherapy regimen and chemoradiotherapy regimen as neoadjuvant treatment for locally advanced esophageal cancer, JCOG1109 NExT study. J. Clin. Oncol. 40, 238–238 (2022).
[9] Faron, M. et al. Individual participant data network meta-analysis of neoadjuvant chemotherapy or chemoradiotherapy in esophageal or gastroesophageal junction carcinoma. J. Clin. Oncol. 41, 4535–4547 (2023).
* 此文仅用于向医学人士提供科学信息,不代表本平台观点
链接:http://www.lewenyixue.com/2024/07/05/%E6%9D%8E%E5%8D%B0%E6%95%99%E6%8E%88%E7%89%B5%E5%A4%B4%E5%85%A8%E7%90%83%E9%A6%96%E4%B8%AA%E9%A3%9F%E7%AE%A1%E7%99%8C%E5%9B%B4%E6%9C%AF%E6%9C%9F%E5%85%8D%E7%96%ABII/








赶快来坐沙发