过表达葡萄糖转运蛋白,增强CAR-T细胞抗肿瘤疗效
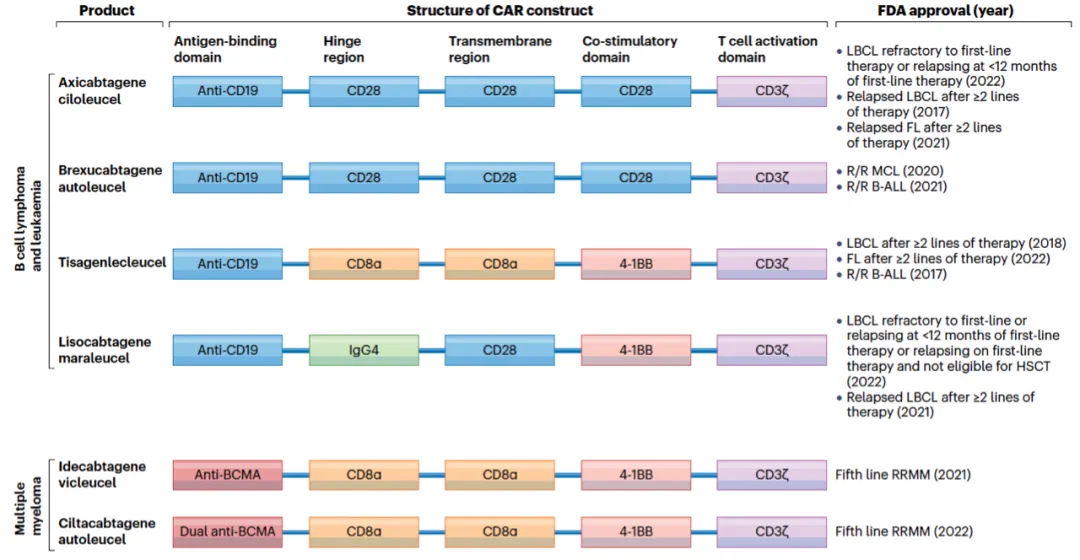
CAR-T细胞疗法是一种革命性的癌症治疗手段,尤其对B细胞恶性肿瘤有显著疗效。 美国FDA已批准了多款以CD28 (19-28z) 或4-1BB (19-BBz) 作为共刺激域的CAR-T细胞疗法。
不同的CAR结构对T细胞代谢有不同的影响,其中 19-28z表现出高糖酵解代谢率,而19-BBz维持线粒体生物合成和T细胞记忆分化 。
葡萄糖在细胞增殖和NFAT信号传导中起重要作用,并通过葡萄糖转运蛋白 (GLUT) 介导实现吸收。 在肿瘤微环境中,肿瘤细胞的高葡萄糖摄取和加速的糖酵解形成了不利于T细胞反应的条件 。
因此,过表达GLUT有可能增强CAR-T细胞的葡萄糖竞争能力,并改善肿瘤控制。
为了验证这一猜测,近日, 纪念斯隆凯特琳癌症中心 Michel Sadelain团队,在 《Molecular Therapy》发表了一篇研究文章, 探索并证实 GLUT过表达 ,可增强CAR-T细胞在肿瘤微环境中的葡萄糖摄取能力,从而提高其抗肿瘤效果。
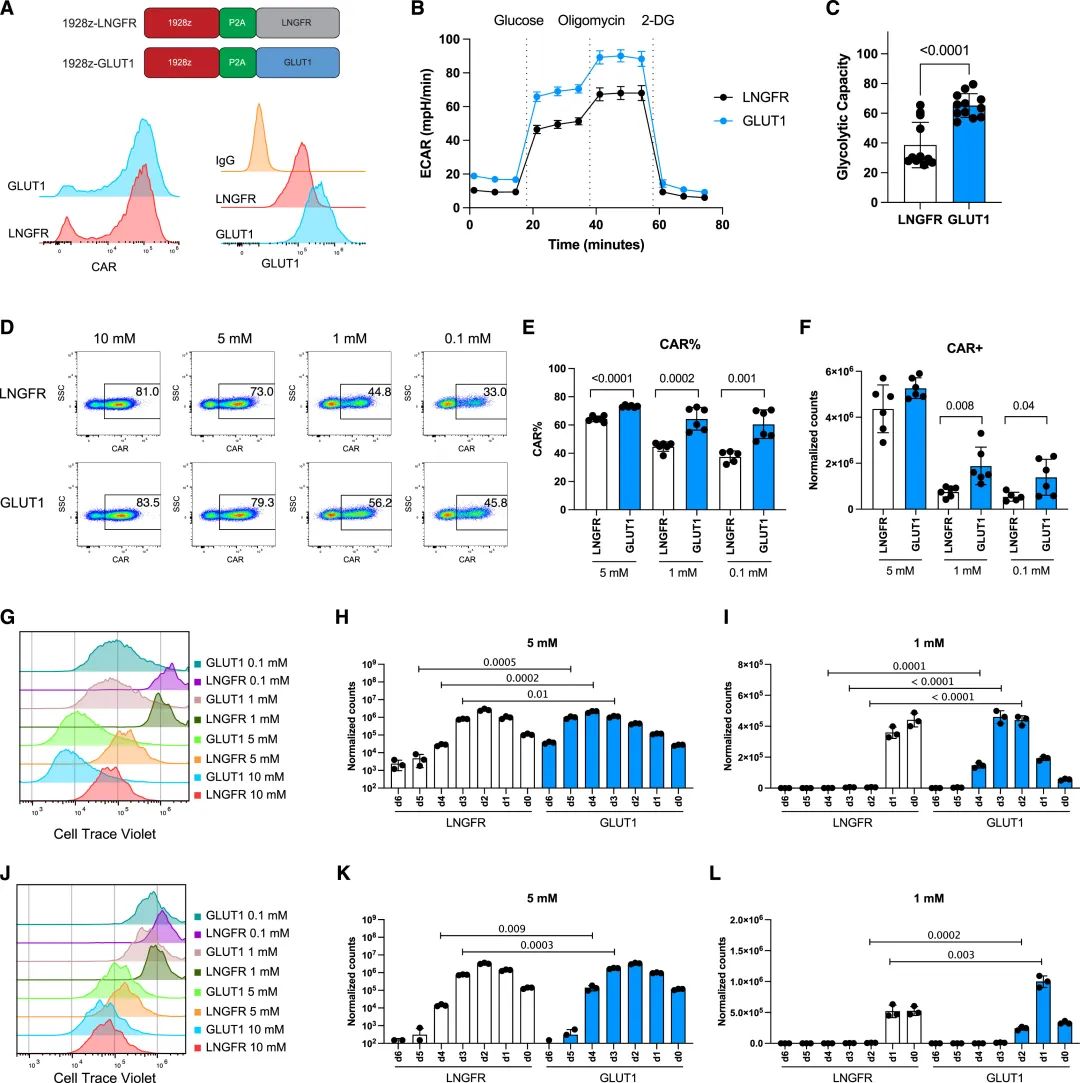
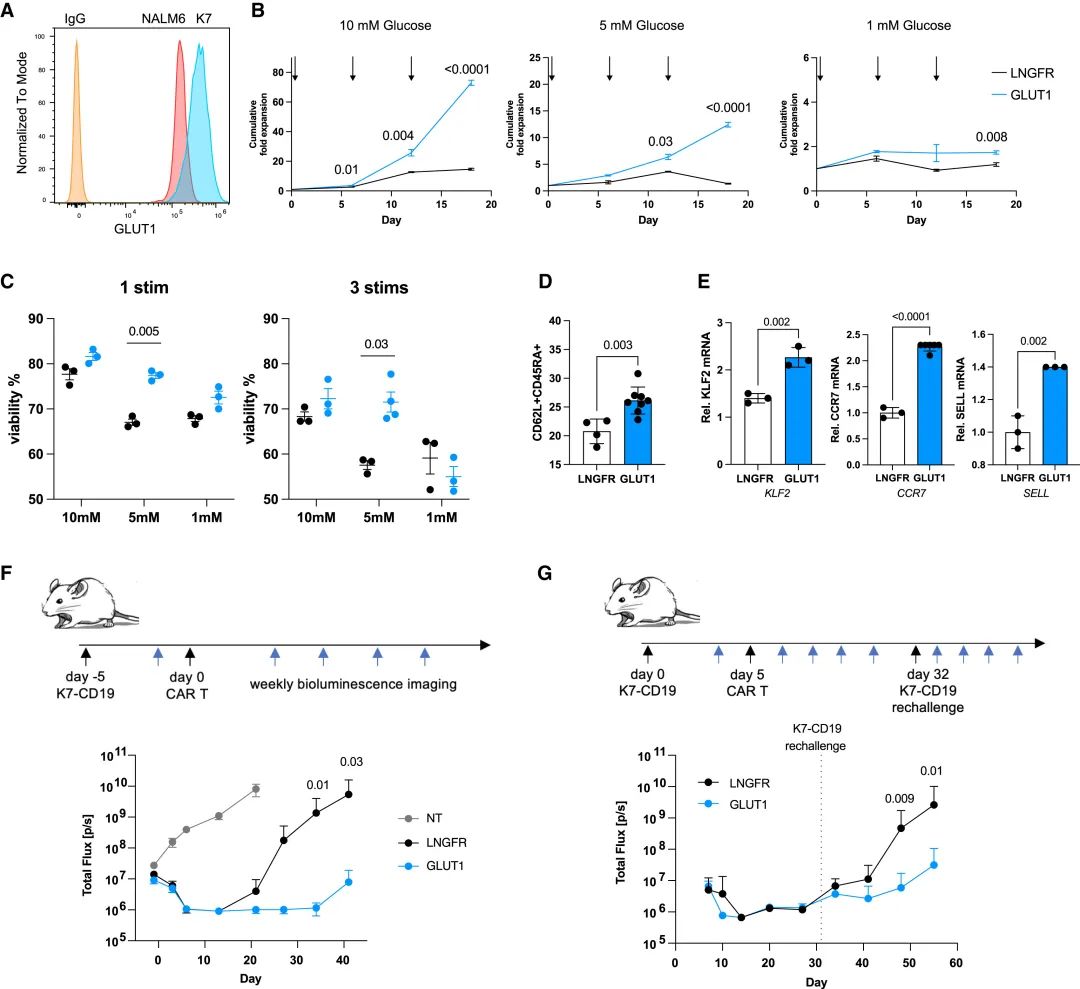
具体来说,他们首先通过构建含有GLUT1的逆转录病毒载体,并转染原代T细胞, 通过western blot和细胞内流式染色分析,证实 GLUT1 成功在CAR-T细胞中实现了过表达。
GLUT1 的过表达改善了葡萄糖限制条件下 CAR-T 细胞的活化维持
在低葡萄糖条件下,与对照组相比,GLUT1过表达的CAR-T细胞展现出更强的糖酵解能力和氧气消耗,这表明它们在能量代谢方面具有显著优势。
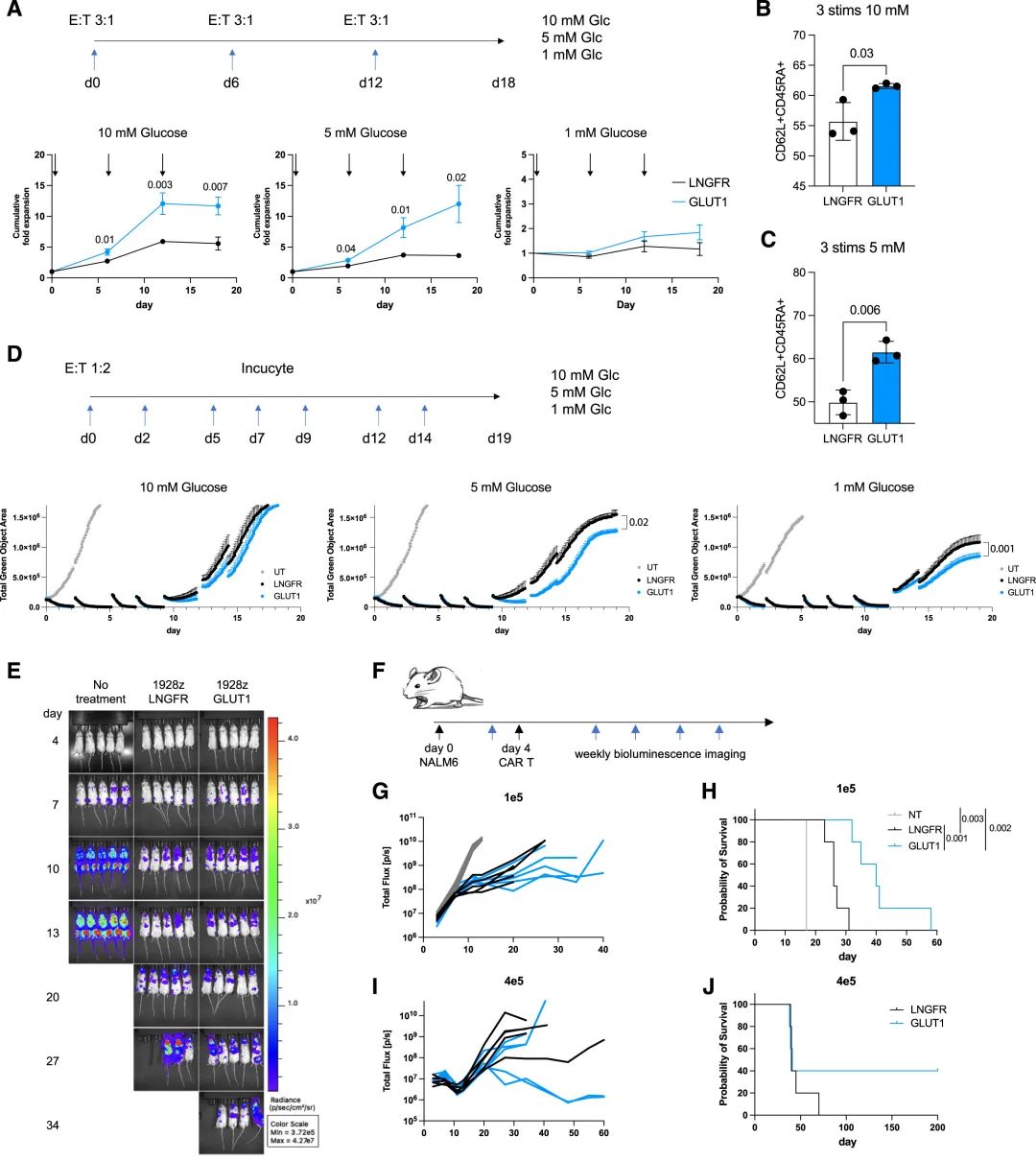
在NALM6白血病模型中,19-28zGLUT1 CAR-T细胞在低葡萄糖条件下能够维持更多的CAR+细胞,并在这些条件下显著增加扩增,这与对照组相比是一个显著的改善。
GLUT1过表达CAR-T细胞在重复刺激后扩增更好,并提高NALM6携带小鼠的生存率
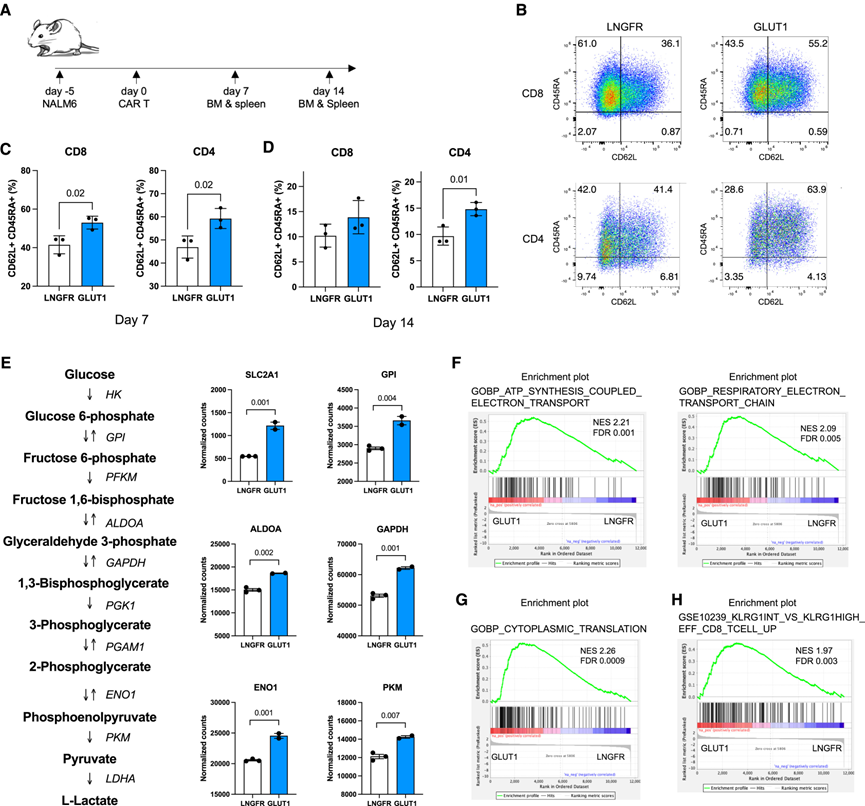
通过对19-28z-GLUT1 CAR-T细胞的RNA测序分析,他们发现GLUT1过表达的细胞富集了参与糖酵解、线粒体呼吸和记忆前体表型的基因,这表明GLUT1过表达可能增强了CAR-T细胞的代谢适应性。
在NALM6白血病小鼠模型中,19-28z-GLUT1 CAR-T细胞处理的小鼠不仅在初次肿瘤反应后显示出延长的生存期,而且在高剂量注射后,部分小鼠实现了长期肿瘤控制。
此外,他们还观察到19-28z-GLUT1 CAR-T细胞在重复刺激后形成了更多的T干细胞样记忆 (Tscm) 细胞,这些细胞与长期肿瘤控制和CAR-T细胞的持久性有关。
GLUT1 过表达促进Tscm形成、增强糖酵解和线粒体OXPHOS
随后,在 肾细胞癌 (RCC) 患者衍生的异种移植模型中,19-28z-GLUT1 CAR-T细胞显示出对肿瘤的更好控制,并在再次挑战肿瘤时维持了这种效果。这表明GLUT1过表达可能增强了CAR-T细胞对肿瘤的长期控制能力。
GLUT1过表达提高RCC肿瘤模型中的CAR-T细胞治疗效果
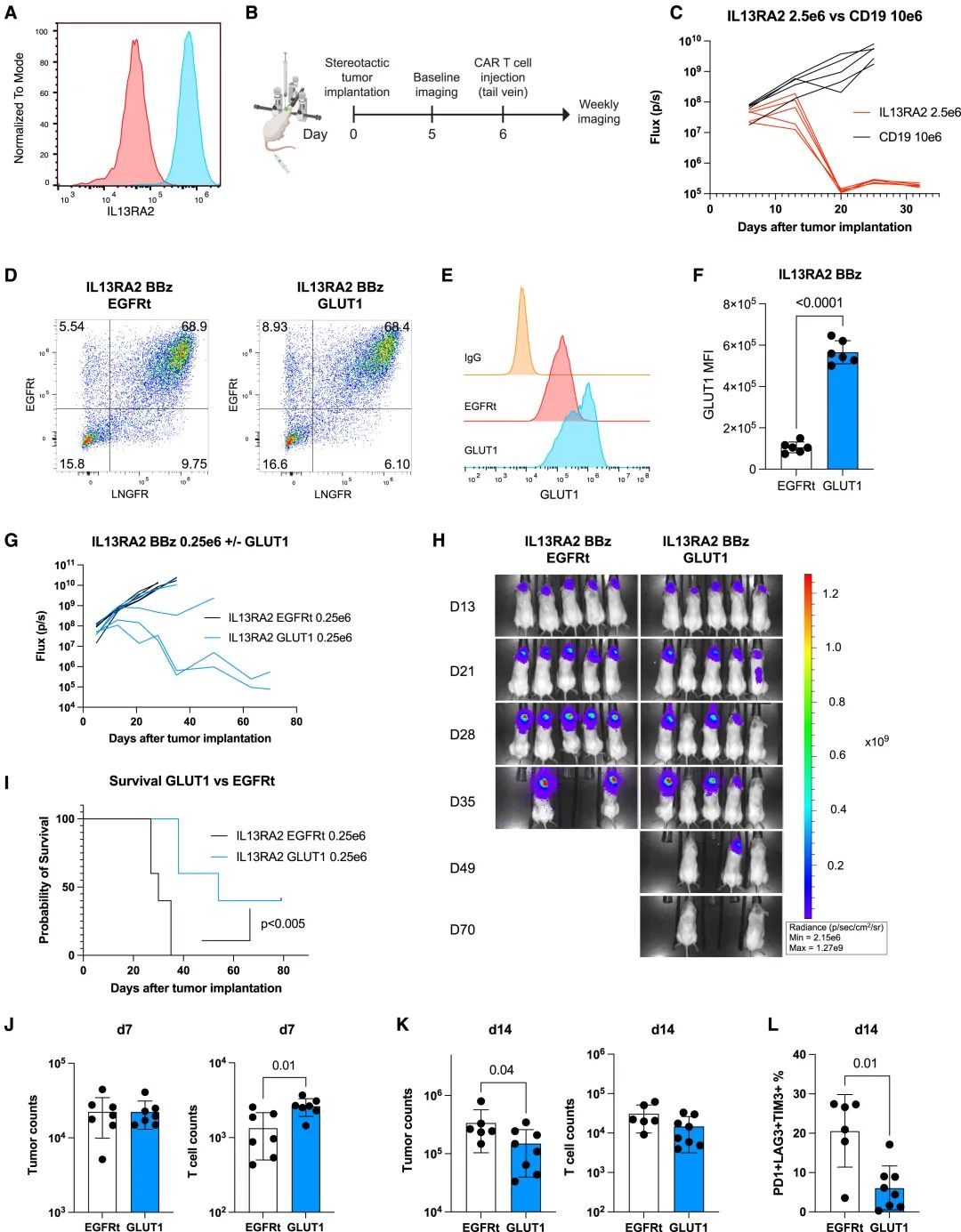
在脑 胶质母细胞瘤 (GBM) 模型中,过表达GLUT1的IL13Ra2-BBz CAR-T细胞显著延长了携带原位GBM小鼠的生存期,并显示出减少的耗竭标志物,这进一步证实了GLUT1过表达在提高CAR-T细胞疗效方面的潜力。
GLUT1过表达提高IL13Rα2-BBz CAR-T细胞在原位GBM小鼠模型中的治疗效果
总之,这项研究强调了GLUT1过表达在CAR-T细胞疗法中的潜在临床应用,尤其是在恶行胶质瘤等葡萄糖受限的实体瘤微环境中。此外,研究结果支持进一步探索GLUT1过表达策略,在针对实体瘤的过继细胞疗法中的应用,为开发更有效的癌症治疗手段提供了新的视角。
https://doi.org/10.1016/j.ymthe.2024.05.006
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/07/05/%E8%BF%87%E8%A1%A8%E8%BE%BE%E8%91%A1%E8%90%84%E7%B3%96%E8%BD%AC%E8%BF%90%E8%9B%8B%E7%99%BD%EF%BC%8C%E5%A2%9E%E5%BC%BACAR-T%E7%BB%86%E8%83%9E/
THE END