【论著】| 贝伐珠单抗辅助PD-1抑制剂治疗胃癌对血清miR-20a-5p和miR-515-3p的影响研究
引用本文
汪 斐,刘 佩,胡 楠. 贝伐珠单抗辅助PD-1抑制剂治疗胃癌对血清miR-20a-5p和miR-515-3p的影响研究[J]. 中国癌症杂志, 2024, 34 (5): 493-500.
第一作者:汪斐,硕士,主治医师。
通信作者:刘佩,硕士,副主任医师。
第一作者简介
汪斐,硕士,南京医科大学第四附属医院肿瘤科医师。主要从事肿瘤内科的临床工作,熟练掌握肿瘤科各种常见的穿刺和操作,擅长肺癌、消化道肿瘤的诊断、免疫治疗、化疗及靶向治疗。

通信作者简介
刘佩,副主任医师,肿瘤学硕士,2009年毕业于南京医科大学,从事肿瘤内科工作至今。南京市医学会肿瘤学分会第一届青委会委员;江苏省整合医学研究会会员;中国医药教育协会腹部肿瘤学分会委员。在肿瘤常见病及多发病诊治方面有着丰富的临床经验,在肺癌、消化道肿瘤等恶性肿瘤方面有深入的研究。熟练掌握临床常见恶性肿瘤的化学治疗、靶向治疗、免疫治疗、灌注化疗、癌痛治疗及对症支持治疗等多种抗肿瘤治疗手段,能够深入解读基因检测报告及指导靶向用药。参与市级课题二项。发表SCI论文二篇,统计源科技核心期刊论文、国家级及省级期刊论文十余篇,副主编肿瘤专著一部,获得实用型专利一项。
贝伐珠单抗辅助PD-1抑制剂治疗胃癌对血清miR-20a-5p和miR-515-3p的影响研究
汪 斐,刘 佩,胡 楠
南京医科大学第四附属医院肿瘤科,江苏 南京 210000
[摘要] 背景与目的:二线化疗方案治疗胃癌疗效欠佳,贝伐珠单抗属于抗血管生成分子靶向抗癌药物,信迪利单抗是一种国产的程序性死亡蛋白-1(programmed death-1,PD-1)抑制剂,两者结合是临床治疗胃癌的新方向。本研究旨在探究贝伐珠单抗辅助PD-1抑制剂治疗胃癌对血清miR-20a-5p和miR-515-3p的影响。 方法:选取2019年1月—2021年7月于南京医科大学第四附属医院就诊的84例胃癌患者进行回顾性研究,根据治疗方案的不同将其分为观察组和对照组(每组各42例),对照组给予二线化疗方案治疗,观察组在对照组基础上给予贝伐珠单抗联合PD-1抑制剂(信迪利单抗)治疗,比较两组的客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)、血清肿瘤标志物、免疫功能指标、血清miR-20a-5p、miR-515-3p及不良反应总发生率。本研究已通过南京医科大学第四附属医院伦理委员会的伦理审批(批件号:20230531--K061)。 结果:观察组的ORR(69.05%)和DCR(85.71%)均高于对照组(40.48%、64.29%)。观察组治疗后的血清糖类抗原12-5(carbohydrate antigen 12-5,CA12-5)、癌胚抗原(carcinoembryonic antigen,CEA)及细胞角蛋白19片段抗原21-1(cytokerantin-19-fragment antigen 21-1,CYFRA21-1)水平均低于对照组。观察组治疗后的CD4 +T淋巴细胞、CD4 +/CD8 +T淋巴细胞比值均高于对照组,CD8 +T淋巴细胞低于对照组,差异均有统计学意义( P<0.05)。观察组治疗后的血清miR-20a-5p、miR-515-3p水平均低于对照组,差异有统计学意义( P<0.05)。观察组(28.57%)的不良反应总发生率与对照组(38.10%)相比,差异无统计学意义( P>0.05)。 结论:贝伐珠单抗辅助信迪利单抗可有效地提高胃癌治疗效率,改善免疫功能,降低血清miR-20a-5p、miR-515-3p及肿瘤标志物表达量,且不会增加不良反应,效果显著。
[关键词]贝伐珠单抗;程序性死亡蛋白-1抑制剂;胃癌;miR-20a-5p;miR-515-3p
[Abstract] Background and purpose:Second-line chemotherapy is not effective in the treatment of gastric cancer. Bevacizumab is a molecularly targeted anticancer drug, and sindilizumab is a domestic programmed death-1 (PD-1) inhibitor. The combination of the two is a new direction for clinical treatment of gastric cancer. This study aimed to analyze the effects of bevacizumab assisted PD-1 inhibitor in the treatment of gastric cancer on serum miR-20a-5p and miR-515-3p. Methods:A retrospective study was conducted on 84 patients with gastric cancer treated in the Fourth Affiliated Hospital of Nanjing Medical University from January 2019 to July 2021, and they were pided into the observation group and the control group with 42 cases each according to different treatment plans. The control group was given second-line chemotherapy, and the observation group was given bevacizumab combined with PD-1 inhibitor (sindilizumab) on the basis of the control group. objective response rate (ORR), disease control rate (DCR), serum tumor markers, immune function indexes, serum miR-20a-5p and miR-515-3p levels and total incidence of toxic and side effects were compared between the two groups. This study has been approved by the Ethics Committee of the Fourth Affiliated Hospital of Nanjing Medical University (approval number: 20230531--K061). Results:The ORR (69.05%) and DCR (85.71%) of the observation group were higher than those of the control group (40.48% and 64.29%), and the difference was statistically significant ( P<0.05). After treatment, serum carbohydrate antigen 12-5 (CA12-5), carcinoembryonic antigen (CEA) and cytokerantin-19-fragment antigen 21-1 (CYFRA21-1) levels were lower in observation group than in control group ( P<0.05). CD4 +T lymphocyte and CD4 +/CD8 +T lymphocyte ratio were higher in observation group than in control group after treatment ( P<0.05), and CD8 +T lymphocyte was lower in observation group than in control group after treatment ( P<0.05). After treatment, the serum levels of miR- 20a-5p and miR-515-3p were lower in the observation group than in the control group ( P<0.05). There was no significant difference in total incidence of adverse effects between the observation group (28.57%) and the control group (38.10%) ( P>0.05). Conclusion:Bevacizumab assisted sindilizumab can effectively improve the treatment efficiency of gastric cancer, improve immune function, and reduce the expression levels of serum miR-20a-5p, miR-515-3p and tumor markers, without increasing toxic and side effects.
[Key words]Bevacizumab; Programmed death-1 inhibitor; Gastric cancer; miR-20a-5p; miR-515-3p
最新数据 [ 1] 显示,目前胃癌发病率在世界范围内居第5位。胃癌发病初期临床症状缺乏特异性,普遍存在上腹部包块、食欲减退、消瘦、疼痛及黑便等,随着肿瘤体积增大,患者会出现黄疸、胸膜炎及幽门梗阻等并发症 [2] 。miRNA具有致癌基因、抑癌基因功能,与胃癌发生、发展、临床病理学特征、化疗敏感性及预后等关系密切,已成为目前临床诊断恶性肿瘤及评估疗效的重要分子标志物之一。既往研究 [3-4] 证实,miR-20a-5p和miR-515-3p异常表达参与胃癌的发生、发展过程,与胃癌临床病理学特征及患者预后密切相关。贝伐珠单抗是一种具有抑制血管生成、阻断血液供应作用的鼠源单克隆免疫球蛋白 G-1(immunoglobulin G-1,IgG-1)抗体,属于分子靶向抗癌药物,可特异性地与血管内皮生长因子结合,抑制血管生成,阻断癌细胞血氧供应,诱导癌细胞凋亡 [5]。近年来,程序性死亡蛋白-1 (programmed death-1,PD-1)抑制剂被应用于恶性肿瘤治疗中,信迪利单抗是一种国产的PD-1抑制剂,具有靶点占位率高、效果持久稳定及亲和力强等优点 [6]。本研究旨在探究贝伐珠单抗辅助PD-1抑制剂治疗胃癌对血清miR-20a-5p和miR-515-3p的影响。
1
资料和方法
1.1 一般资料
选取2019年1月—2021年7月于南京医科大学第四附属医院就诊的84例胃癌患者进行回顾性研究,根据治疗方案的不同将其分为观察组和对照组(每组各42例),两组性别、分化程度、TNM分期、淋巴结转移、病理学类型、年龄、病灶直径及体重指数(body mass index,BMI)等一般资料差异无统计学意义( P>0.05),具有可比性(表1)。本研究已通过南京医科大学第四附属医院伦理委员会的伦理审批(批件号:20230531--K061)。
⑴ 诊断标准:均符合《中国早期胃癌筛查及内镜诊治共识意见(2014年, 长沙)》 [7]中对“胃癌”的诊断标准,均经活组织病理学检查确诊。
⑵ 纳入标准:① 年龄在18~80周岁;② 预计生存期≥3个月;③ 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~1分;④ 临床资料齐全、完整;⑤ 至少存在一个可测量病灶;⑥ 肝、肾等重大脏器功能无异常,无贫血、营养不良等;⑦ 视听、沟通能力正常,配合度良好。
⑶ 排除标准:① 合并胃穿孔、幽门梗阻等疾病者;② 哺乳、备孕或妊娠期女性;③ 合并免疫缺陷者;④ 合并全身严重感染性疾病者;⑤ 同期参与其他研究或中途因疾病变化退出本研究者;⑥ 合并代谢系统疾病者;⑦ 存在药物依赖史、吸毒史或乙醇成瘾史者;⑧ 合并其他恶性肿瘤者;⑨ 合并未能控制的高血压、糖尿病等疾病者;⑩ 肿瘤存在脑部或脊髓转移者。

1.2 方法
对照组给予二线化疗方案治疗:第1、8天,给予多西他赛(江苏恒瑞医药股份有限公司)35 mg/m 2 ,静脉滴注;第1~4天,给予25 mg/m 2 顺铂(江苏豪森药业集团有限公司),静脉滴注,3周为1个疗程,共3个疗程。观察组在对照组基础上给予贝伐珠单抗联合PD-1抑制剂(信迪利单抗)治疗:第1天,给予5 mg/kg贝伐珠单抗(瑞士Roche Pharma公司),静脉滴注,滴注时间应>1.5 h;第1天,给予200 mg信迪利单抗[信达生物制药(苏州)有限公司],静脉滴注,3周为1个疗程,共3个疗程。
1.3 观察指标及评价标准
⑴ 客观缓解率(objective response rate,ORR)和疾病控制率(disease control rate,DCR):病灶消失,且持续4周未出现新病灶为完全缓解(complete remission,CR),病灶比治疗前缩小≥30%,且持续4周未出现新病灶为部分缓解(partial remission,PR),病灶比治疗前缩小<30%或增加<20%是病灶稳定(focal stabilization,SD),病灶比治疗前增加≥20%是疾病进展(disease progression,PD)。ORR=(CR+PR)/例数×100.00%;DCR=(CR+PR+SD)/例数×100.00% [8]。
⑵ 血清肿瘤标志物和免疫功能指标:抽取患者治疗前后5 mL空腹静脉血,采用低速离心机(湖南沪康离心机有限公司),以4 000 r/min的速率离心10 min(离心半径为10 cm),分离上清液后放置在-80 ℃的环境中保存,采用电化学发光免疫分析仪(上海朗逸医疗器械有限公司)检测糖类抗原12-5(carbohydrate antigen 12-5,CA12-5)、癌胚抗原(carcinoembryonic antigen,CEA) 及细胞角蛋白19片段抗原21-1(cytokerantin-19-fragment antigen 21-1,CYFRA21-1),采用流式细胞仪(上海沫锦医疗器械有限公司)检测CD4 +和CD8 +T淋巴细胞,计算CD4 +/CD8 +T淋巴细胞比值。
⑶ 血清miR-20a-5p和miR-515-3p:抽取患者治疗前后5 mL空腹静脉血,以3 000 r/min的速率离心10 min(离心半径为10 cm),分离上清液后保存待检,采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测miR-20a-5p和miR-515-3p的表达量,解冻、溶解血清,试管中加入300 μL血清,摄取总RNA并以紫外分光光度法定量,以反转录试剂盒反转录合成cDNA,以cDNA作为模板,保存在-108 ℃的冰箱中。miR-20a-5p的上游引物序列为5’-ACGTTGTCTAGCTTATCAGACTG-3’,下游引物序列为5’-AATGGTTGTTCTCCACA CTCTC-3’ ,内参 U6的上游引物序列为5’-CTGAGATCGGATAGCTA-3’,下游引物序列为5’-CTGAG ATATGCGATAGC-3’;miR-515-3p的上游引物序列为5’-TTACGGATCGAGCGTAGA-3’,下游引物序列为5’-GGATCGACAGTTAGACGAT-3’,内参 U6的上游引物序列为5’-TGATCGAGACGTAG AGCTGA-3’,下游引物序列为5’-CGAAGTTCG AAGCTGAGC-3’。反应条件:95 ℃ 10 min预变性、74 ℃ 15 s变性、60 ℃退火,共循环38次,每例标本均有3个平行反应复孔,将 U6作为对照,以2 -△△ Ct 法计算miR-20a-5p和miR-515-3p的表达量。
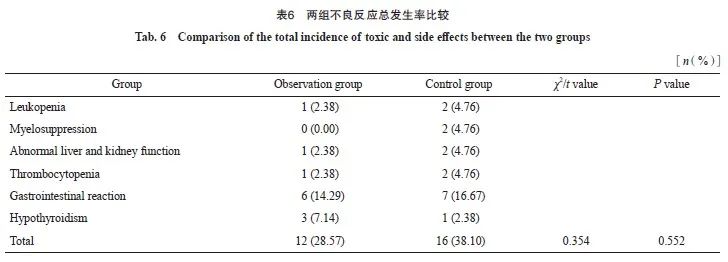
⑷ 不良反应总发生率:统计患者用药期间白细胞减少、骨髓抑制、肝肾功能异常、血小板减少、胃肠道反应及甲状腺功能减退的总发生率。
1.4 统计学处理
采用SPSS 26.0软件对数据进行处理。计量资料符合正态分布,以 x±s 表示,采用 t 检验及 F 检验,计数资料采用 χ 2 检验,若理论频数<1时取精确概率值,等级资料分析采用Ridit分析,以 n (%)表示。 P <0.05为差异有统计学意义。
2
结 果
2.1 两组的ORR和DCR比较
观察组的ORR( 69.05% )和DCR(85.71%)均高于对照组(40.48%和64.29%),差异有统计学意义( P <0.05,表2)。
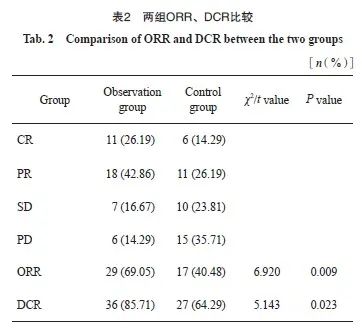
2.2 两组的血清肿瘤标志物比较
观察组治疗前的血清CA12-5、CEA及CYFRA21-1水平与对照组比较,差异无统计学意义( P >0.05);观察组治疗后的血清CA12-5、CEA及CYFRA21-1水平均低于对照组,差异有统计学意义( P <0.05,表3)。
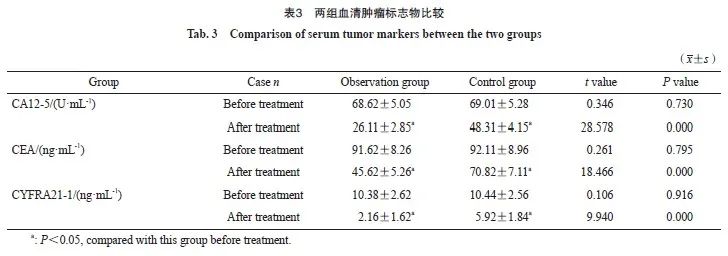
2.3 两组的免疫功能指标比较
观察组治疗前的CD4 + T淋巴细胞、CD8 + T淋巴细胞及CD4 + /CD8 + T淋巴细胞比值与对照组相比,差异无统计学意义( P >0.05);观察组治疗后的CD4 + T淋巴细胞、CD4 + /CD8 + T淋巴细胞比值均高于对照组,CD8 + T淋巴细胞低于对照组,差异均有统计学意义( P <0.05,表4)。
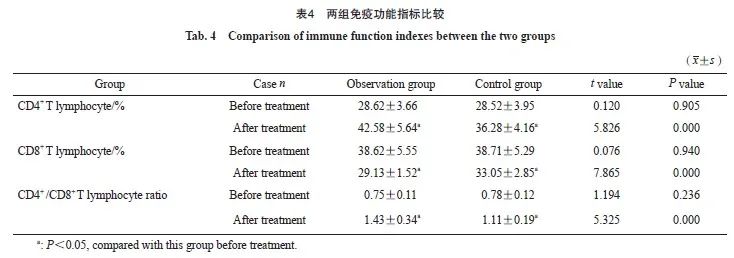
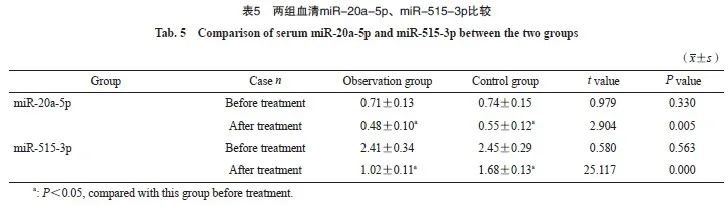
2.4 两组的血清miR-20a-5p和miR-515-3p比较
观察组治疗前的血清miR-20a-5p和miR-515-3p水平与对照组相比,差异无统计学意义( P >0.05);观察组治疗后的血清miR-20a-5p和miR-515-3p水平均低于对照组,差异有统计学意义( P <0.05,表5)。
2.5 两组的不良反应总发生率比较
观察组的不良反应总发生率(28.57%)与对照组(38.10%)相比,差异无统计学意义( P >0.05,表6)。
3
讨 论
目前,临床普遍认为胃癌的发生与幽门螺杆菌感染、地域环境改变、癌前病变、家族遗传及不良饮食习惯等有着极为密切的联系 [7]。近年来,由于环境、饮食结构改变等因素的影响,胃癌发病率显著升高 [9]。调查 [10]显示,世界范围内每年新增的胃癌患者多达100万。由于大部分胃癌患者发病初期临床症状缺乏特异性,极易被患者忽视,当疾病确诊时,基本已经发展到了中晚期,错过了最佳手术治疗时机。晚期胃癌患者的治疗主要以化疗为主,贝伐珠单抗可有效地抑制血管内皮生长因子的活性,通过阻断该细胞信号转导通路,退化肿瘤血管,达到抑制新血管生成,达到最终抑制肿瘤细胞侵袭、转移及生长的目的 [11-12]。但临床研究 [13]发现,单纯二线化疗在恶性肿瘤治疗中总有效率较低,不能有效地控制疾病进展,具有一定的局限性。因此,寻求一种有效、安全的药物以提高胃癌治疗总有效率是目前临床高度关注的内容。
随着对恶性肿瘤的深入研究,免疫检查点抑制剂应用于恶性肿瘤治疗取得了显著效果,且不良反应可控,深受临床认可。信迪利单抗是2018年被国家药品监督管理局批准上市的国产PD-1抑制剂,在肺癌等恶性肿瘤治疗中取得了显著效果 [14]。本研究结果显示,观察组的ORR和DCR均高于对照组。由此可见,贝伐珠单抗辅助信迪利单抗可提高胃癌的临床疗效。分析原因如下:信迪利单抗具有较强的靶向性,可阻断癌细胞表达的程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)结合免疫细胞表面PD-1这一过程,防止癌细胞逃脱免疫监视,通过调节机体免疫系统,提高抗肿瘤疗效 [15-16]。本研究结果显示,观察组治疗后的血清CA12-5、CEA及CYFRA21-1水平均低于对照组。由此可见,贝伐珠单抗辅助信迪利单抗可降低血清肿瘤标志物水平,抑制肿瘤细胞增殖。分析原因如下:信迪利单抗通过阻断肿瘤病灶免疫耐受的相关分支,激活淋巴细胞的抗肿瘤活性,有效杀灭癌细胞,发挥持续、稳定的抗肿瘤效果,抑制CEA等肿瘤标志物产生。本研究结果显示,观察组治疗后的CD4 +T淋巴细胞、CD4 +/CD8 +T淋巴细胞比值均高于对照组,CD8 +T淋巴细胞低于对照组。由此可见,贝伐珠单抗辅助信迪利单抗可纠正免疫失衡。分析原因如下:PD-L1是PD-1的主要配体,PD-1结合PD-L1后,会激活蛋白激酶B,将下游T细胞活化信号阻断,从而削弱机体免疫功能。信迪利单抗对负向免疫调节机制具有抑制作用,可促进免疫细胞应答及增殖,最大限度地降低肿瘤病灶对患者机体免疫微环境的影响,从而削弱肿瘤病灶对免疫系统的抑制作用,改善免疫功能。
有研究 [17]发现,小分子非编码RNA中的miRNA参与恶性肿瘤生长、浸润、分化及转移等病理学过程。miRNA在血清中具有较高的稳定性,耐RNA酶降解性较强,长期保存、反复冻融及煮沸等处理基本不会影响miRNA含量 [18]。血清miR-20a-5p和miR-515-3p作为促癌基因,参与诸多恶性肿瘤细胞分化、炎症反应等生理学过程 [19-20]。本研究结果显示,观察组治疗后的血清miR-20a-5p和miR-515-3p水平均低于对照组。由此可见,贝伐珠单抗辅助信迪利单抗可降低血清miR-20a-5p和miR-515-3p水平。分析原因如下:信迪利单抗可重新启动、激活人体免疫系统,对PD-1受体亲和力较强,通过靶向作用在免疫哨点PD-1发挥免疫调节、抗肿瘤效果,并且信迪利单抗的解离速度较慢,该特性决定了信迪利单抗可发挥持久、稳定的抗肿瘤效果,有效地阻断肿瘤细胞信号转导,促进肿瘤细胞凋亡。信迪利单抗可激活处于抑制状态的抗肿瘤免疫细胞,阻断T淋巴细胞上PD-1受体与配体PD-L1的相互作用,促进T淋巴细胞功能恢复,提高T淋巴细胞对肿瘤细胞的杀伤作用,减少DNA错配修复,从而维持基因组的稳定性。信迪利单抗与贝伐珠单抗联合,两种抗肿瘤药物协同作用,可增强抗肿瘤效果,改善机体微环境,抑制肿瘤细胞浸润、侵袭,从而下调血清miR-20a-5p和miR-515-3p表达量。经贝伐珠单抗辅助信迪利单抗治疗,胃癌患者血清miR-20a-5p、miR-515-3p及肿瘤标志物表达量均较治疗前显著降低,由此说明,贝伐珠单抗辅助信迪利单抗治疗在延缓胃癌患者疾病进展方面具有重要意义。本研究结果显示,观察组不良反应总发生率(28.57%)与对照组(38.10%)比较差异无统计学意义。由此可见,贝伐珠单抗辅助信迪利单抗未增加不良反应发生率,发生的不良反应均可控,具有一定的安全性。由于信迪利单抗具有较强的靶向作用,因此不会增加胃肠道反应、骨髓抑制等不良反应,但信迪利单抗容易引发甲状腺功能减退,应当引起临床重视,在治疗期间应加强对甲状腺功能的动态监测,以便及早发现异常,及早对症处理,最大限度地减轻对患者甲状腺功能的影响。
综上所述,胃癌患者接受贝伐珠单抗辅助信迪利单抗治疗,可有效地提高ORR和DCR,下调血清miR-20a-5p、miR-515-3p及肿瘤标志物表达量,改善免疫功能,且联合治疗未增加不良反应,安全性相对较高,值得参考和借鉴。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
汪斐:实验操作,文章撰写;
刘佩:研究指导,文章修改;
胡楠:数据整理,统计学分析。
[参考文献]
本文责任编辑:李广涛
链接:http://www.lewenyixue.com/2024/06/28/%E3%80%90%E8%AE%BA%E8%91%97%E3%80%91%7C%20%E8%B4%9D%E4%BC%90%E7%8F%A0%E5%8D%95%E6%8A%97%E8%BE%85%E5%8A%A9PD-1%E6%8A%91%E5%88%B6%E5%89%82/









赶快来坐沙发