【论著】| CDC20通过稳定NLRP3的表达促进食管癌细胞增殖的研究
引用本文
关瑞瑞,郝 茜,张雅琦,等. CDC20通过稳定NLRP3的表达促进食管癌细胞增殖的研究[J]. 中国癌症杂志, 2024, 34 (5): 473-484.
基金项目:国家自然科学基金(81972330)。
第一作者:关瑞瑞,硕士。
通信作者:韩涛,博士,教授;周祥,博士,研究员。
第一作者简介
关瑞瑞,新乡医学院第三临床学院药学专业研究生,研究方向食管癌发病机制及防治研究。

通信作者简介
韩涛,新乡医学院健康中原研究院骨肿瘤研究所所长,博士,美国Moffitt Cancer Center 博士后,特聘教授,硕士研究生导师,国家基金委函评专家,河南省“中原英才计划”入选者,河南省高层次人才,河南省青年科技工作者协会理事,九三学社河南省高层次人才工作委员会委员。从事蛋白质翻译后修饰调控肿瘤发生工作,主要聚焦于恶性肿瘤发病机制及靶向治疗研究。目前主持有国家自然科学基金面上项目、青年项目、河南省自然科学优秀青年基金等项目,参与完成国家自然科学基金面上项目两项,美国NIH基金一项等。近年来,以第一作者或通讯作者在 Nature Communications、Cell Death and Disease、Ebiomedicine、Journal of Immunology、Frontiers in Oncology和 Genes等杂志上发表论文20余篇,参编教材1部,申请并获批专利4项,2023年获河南省科学技术进步奖二等奖。目前担任多个SCI杂志审稿人,河南省科技厅和山东省科技厅评审专家。
通信作者简介
周祥,复旦大学生物医学研究院/附属肿瘤医院研究员、博士生导师。复旦大学肿瘤研究所所长助理。获美中抗癌协会-亚洲癌症研究基金会学术奖,国家自然科学基金和上海高水平地方高校创新团队资助。任中国抗癌协会妇瘤标志物协作组常务委员、上海医学会肿瘤靶分子青委会委员、国际氧化还原生物学与医学协会会员等, Journal of Molecular Cell Biology、Cancer Medicine等杂志编委。主要开展细胞应激信号与肿瘤演化机制相关研究,申请和授权多项发明专利,在 Proceedings of the National Academy of Sciences、Cell Reports、Cell Death & Differentiation、Redox Biology、Molecular Cancer、Oncogene等期刊发表论文60余篇。
CDC20通过稳定NLRP3的表达促进食管癌细胞增殖的研究
关瑞瑞 1,2 ,郝 茜 3 ,张雅琦 1,4 ,孙庆港 1,4 ,陈怡恬 1,4 ,李秀敏 2,5 ,周 祥 3 ,韩 涛 1
1.新乡医学院健康中原研究院,新乡市分子癌学重点实验室,河南 新乡 453003;
2.新乡医学院第三附属医院消化内科,河南 新乡 453003;
3.复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032;
4.新乡医学院基础医学院,河南 新乡 453003;
5.新乡医学院第一附属医院消化内科,河南 新乡 453003
[摘要] 背景与目的:食管癌(esophageal carcinoma,ESCA)是死亡率较高的恶性肿瘤之一,其发生、发展的机制不明。CDC20被认为具有癌基因功能,其表达失调与肿瘤的发生、发展密切相关。CDC20在多种肿瘤中表达升高,敲低CDC20能够抑制肿瘤细胞增殖。NLRP3是炎症小体的主要成分之一,炎症小体失调与肿瘤的发生、发展也密切相关。本研究旨在探究CDC20是否通过NLRP3促进ESCA细胞增殖,同时分析其调控机制。 方法:通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库和GTEx公共数据库分析ESCA患者中 CDC20和 NLRP3基因的表达水平。收集新乡医学院第一附属医院收治的80例ESCA患者的临床病理学资料和组织,通过免疫组织化学染色检测NLRP3在ESCA患者中的蛋白表达水平。本研究通过新乡医学院第一附属医院伦理委员会的审批(编号:EC-021-137)。通过短发夹RNA(short hairpin RNA,shRNA)技术检测敲低 CDC20和 NLRP3基因后对食管鳞状细胞癌细胞系EC9706和KYSE150增殖能力的影响。通过免疫共沉淀(Co-immunoprecipitation,Co-IP)、蛋白酶体抑制剂和泛素化实验检测CDC20是否与NLRP3相互作用,以及阐明CDC20是否通过泛素化途径调控NLRP3表达。 结果:TCGA数据库分析结果显示,ESCA组织中CDC20和NLRP3 mRNA表达水平明显高于癌旁组织。免疫组织化学结果也进一步显示,与癌旁组织相比,CDC20、NLRP3在ESCA组织中蛋白表达水平升高。敲低 CDC20和 NLRP3基因可抑制ESCA细胞增殖。Co-IP、蛋白酶体抑制剂和泛素化实验证实CDC20通过NLRP3的LRR区与NLRP3相互作用,且CDC20通过促进NLRP3泛素化稳定其表达。 结论:CDC20和NLRP3在ESCA癌组织中表达上调,且CDC20通过泛素化NLRP3稳定其表达,从而促进ESCA细胞增殖,提示CDC20和NLRP3可能是ESCA潜在的诊断靶向标志物。
[关键词]食管癌;CDC20;NLRP3;泛素化;增殖
[Abstract] Background and purpose:Esophageal carcinoma (ESCA) is one of the malignant tumors with high mortality rate, and the underlying mechanism of its development is largely unknown. CDC20 plays an important role in tumorigenesis, and its dysregulated expression is closely related to tumor occurrence and development. The expression of CDC20 is increased in a variety of tumors, and knocking down CDC20 can inhibit tumor cell proliferation. NLRP3 is the main component of the inflammasome, and inflammasome is also closely related to tumor occurrence and development. Here, our study aimed to investigate whether CDC20 promotes the proliferation of ESCA cells through NLRP3 and its regulatory mechanism. Methods:The expression levels of CDC20 and NLRP3 genes in ESCA patients were analyzed using The Cancer Genome Atlas (TCGA) detabase and GTEx public database. We collected clinical and pathological data and tissues from 80 ESCA patients at the First Affiliated Hospital of Xinxiang Medical College, and detected the protein expression of NLRP3 in ESCA patients through immunohistochemistry staining. This study was approved by the Ethics Committee of the First Affiliated Hospital of Xinxiang Medical College (Number: EC-021-137). We studied the effects of knocking down CDC20 and NLRP3 gene on the proliferation ability of esophageal squamous cell carcinoma cells EC9706 and KYSE150 using short hairpin RNA (shRNA) technology. Co-immunoprecipitation (Co-IP), proteasome inhibitors and ubiquitination experiments were used to detect whether CDC20 interacts with NLRP3, and to elucidate whether CDC20 regulates NLRP3 expression through the ubiquitination pathway. This study was approved by the Ethics Committee of the First Affiliated Hospital of Xinxiang Medical College (Number: EC-021-137). Results:The TCGA database analysis showed that the expression levels of CDC20 and NLRP3 mRNA were significantly higher in the cancer tissues of ESCA patients than in the adjacent tissues. The immunohistochemistry results further showed that compared with adjacent tissues, the protein expression levels of CDC20 and NLRP3 were increased in ESCA tissues. Knocking down CDC20 and NLRP3 genes inhibited the proliferation of ESCA cells. Co-IP, proteasome inhibitors and ubiquitination experiments confirmed that CDC20 interacted with NLRP3 through its leucine-rich repeat (LRR), and CDC20 stabilized its expression by promoting NLRP3 ubiquitination. Conclusion:CDC20 and NLRP3 are upregulated in ESCA tissues, and CDC20 stabilizes their expression through ubiquitination of NLRP3, promoting ESCA cell proliferation. This suggests that CDC20 and NLRP3 may be potential diagnostic targets for ESCA.
[Key words]Esophageal carcinoma; CDC20; NLRP3; Ubiquitination; Proliferation
食管癌(esophageal carcinoma,ESCA)是临床常见的消化系统恶性肿瘤,发病率高、预后差、生存率低 [1]。据统计,中国每年因ESCA死亡的人数约为15万人 [2]。相比其他国家,中国ESCA的发病率偏高。ESCA主要分为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(esophageal adenocarcinoma,EAC) [3],中国主要以ESCC为主。ESCC早期诊断困难,疗效不佳,尽管手术切除和辅助放化疗等治疗方法有所改进,但5年生存率仍仅为15%~20% [4]。通过对ESCA的发生、发展机制进行研究,寻找新的诊断和治疗靶向标志物,从而延长患者生存期及改善患者预后是目前亟待解决的问题。
后期促进复合物/细胞周期体(anaphase promoting complex/cyclosome,APC/C)是一种多亚基E3泛素连接酶,被认为是调节细胞周期和肿瘤发生、发展的主要驱动力 [5-6]。APC/C与共刺激蛋白CDC20结合,形成具有活性的APC CDC20复合物,通过泛素化修饰降解底物,包括细胞周期相关和肿瘤相关癌蛋白等,调控细胞周期进展并影响肿瘤的发生、发展。CDC20被认为具有促进肿瘤发生的作用。有研究 [7]显示, CDC20是一种必需的发育基因,在小鼠中敲除 CDC20基因会引起有丝分裂停滞,导致胚胎死亡。在小鼠皮肤肿瘤模型中条件性敲除内源CDC20能够阻止肿瘤形成 [8]。近年来,有研究 [9-10]显示,CDC20在各种恶性肿瘤中高表达,并与肿瘤的发展有关。CDC20在促进和维持肿瘤细胞增殖中发挥重要作用,CDC20在胶质母细胞瘤中表达上调,在低级别胶质瘤中表达下调 [11]。此外,CDC20的过表达与胶质母细胞瘤的发展高度相关,表明CDC20可作为标志物用于在活检中鉴定胶质母细胞瘤 [12]。CDC20通过降解p21 CIPI/WAF1维持胶质瘤细胞增殖和存活,并且CDC20抑制能够诱导胶质瘤细胞的细胞周期停滞 [13]。Jiang等 [14]研究显示,与正常乳腺上皮细胞相比,CDC20在乳腺癌细胞中呈高表达。与人乳腺癌患者样本中的癌旁组织相比,乳腺癌组织中的CDC20表达更高 [14]。CDC20通过多种途径调节乳腺癌细胞的生长,如重组蛋白通过抑制CDC20降低乳腺癌细胞增殖、迁移和侵袭 [15]。支架/基质附着区结合蛋白1(scaffold/matrix attachment region-binding protein 1,SMAR1)在维持基因组稳定性和细胞周期进程中发挥关键作用,CDC20通过促进SMAR1的蛋白酶体降解从而促进肿瘤细胞增殖 [16]。CDC20还可以通过调节上皮-间充质转化(epithelial-mesenchymal transition,EMT)促进肝细胞癌(hepatocellular carcinoma,HCC)进展,沉默 CDC20可增加E-钙黏蛋白的表达水平,降低N-钙黏蛋白、波形蛋白的表达水平和Ki-67增殖指数,并抑制HCC细胞迁移和侵袭 [17]。CDC20的高表达与上皮性卵巢肿瘤的不良预后密切相关,表明CDC20是卵巢癌预后的生物标志物 [18]。Kim等 [19]研究报道,CDC20在超过70%的胃癌组织中呈高表达,暗示CDC20是胃癌的潜在生物标志物。综上,CDC20在大多数癌症中呈高表达,提示其具有致癌作用,而CDC20在ESCA中的作用及其分子机制等仍不明确。
炎症小体失调与肿瘤的发生、发展也密切相关。炎症小体是细胞内多蛋白质信号转导复合物,其作为对内源性危险信号的炎性免疫应答在细胞溶质区室中形成。炎症小体的形成能够激活天冬氨酸特异性半胱氨酸蛋白酶-1 (caspase-1),引发焦亡,随后裂解促炎细胞因子白细胞介素-1β(interleukin-1β,IL-1β)和IL-1β前体以产生活性形式 [20]。炎症小体复合物由Nod样受体(NOD-like receptor,NLR)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CRAD,ASC)和caspase-1组成。NLRP3是极具特征性的炎症小体之一,属于NLR蛋白家族,是一种三元蛋白质,包含一个氨基末端嘧啶结构域(pyrin domain,PYD)、一个中央NACHT结构域和一个羧基末端富含亮氨酸的重复结构域(leucine-rich repeat,LRR) [21]。NLRP3表达的失调与肿瘤发展、自身免疫性疾病和神经退行性疾病密切相关 [22]。近年来,关于NLRP3在肿瘤中的研究日益增多,有研究 [23]显示,肿瘤组织中NLRP3蛋白水平高于非癌组织,且肿瘤标本中的NLRP3高表达与TNM分期和T分期显著相关。NLRP3表达升高通过参与调控细胞周期蛋白D1表达及诱导IL-1β产生来增强胃癌中的细胞分化,同时激活的IL-1β与其受体结合并激活核因子-κB(nuclear factor-κB,NF-κB),导致细胞增殖、侵袭和癌症发展 [24]。此外头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)与慢性炎症密切相关,NLRP3在HNSCC组织中表达升高,其表达程度与预后相关。HNSCC可通过NLRP3途径诱导活性IL-1β的产生,从而促进肿瘤细胞侵袭和增殖 [25]。近年来,有研究 [26-27]表明,慢性炎症与肺肿瘤进展密切相关。天冬氨酸诱导间皮细胞中的NLRP3活化最终导致肺癌的发生、进展。动物实验显示,肺和脾中NLRP3 mRNA表达水平较高 [28],肺泡巨噬细胞中NLRP3 mRNA表达最高 [29]。NLRP3在ESCC中的作用罕见报道 [30]。2020年Yu等 [31]研究报道,激活NLRP3能够促进ESCA细胞增殖和迁移。上述结果提示NLRP3在ESCA中可能发挥癌基因作用。而在ESCC中,CDC20是否通过影响NLRP3表达促进ESCC细胞增殖尚不清楚,本研究旨在探究CDC20和NLRP3在ESCC中的作用及其机制,以期为ESCC的综合治疗提供新思路。
1
材料和方法
1.1 细胞系和实验试剂
HEK-293T细胞系、ESCA细胞系EC9706、KYSE150均购自美国典型培养物保藏中心,DMEM和RPMI-1640培养基、胰蛋白酶、青-链霉素和磷酸缓冲盐溶液(phosphate-buffered s aline,PBS)均购自美国H yclone公司, 10%胎牛血清购自上海双洳生物科技有限公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自日本同仁化学研究所,PrimeScript反转录试剂盒和实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒均购自日本TaKaRa公司,Super-Bradford蛋白定量试剂购自江苏康为世纪生物科技股份有限公司,NLRP3抗体(19771-1-AP)购自武汉三鹰生物技术有限公司,CDC20(E-7)抗体(sc-13162)购自美国Santa Cruz Biotechnology公司。
1.2 临床标本
1.2.1 资料来源和数据分析
在癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer. gov/)中下载TCGA-ESCA的RNA FPKM数据和患者临床资料,并纳入了GTEx公共数据库(https://www.gtexportal.org/home/datasets)中ESCA的正常组织信息,分析CDC20和NLRP3在ESCA组织与正常组织中的表达差异及临床意义。所纳入的数据集需符合以下标准:① 组织样本均来自ESCA组织或正常组织;② 至少包含10个样本差异分析和预后分析。
1.2.2 临床标本来源
收集新乡医学院第一附属医院收治的80例ESCC患者的癌组织和癌旁组织标本。本研究通过新乡医学院第一附属医院伦理委员会的审批(编号:EC-021-137)。纳入标准:① 术后病理学检查确诊病理学类型为ESCC:② 组织切片结构完整,无脱片。排除标准:① 临床及病历资料有遗漏;② 患者术前进行过放化疗。
1.3 实验方法
1.3.1 质粒构建、细胞培养和转染
质粒构建:NLRP3、ASC和pro-Caspase-1质粒均由武汉大学病毒学国家重点实验室吴建国教授提供。关于Flag-PYRIN、Flag-NACHT和Flag-LRR质粒构建,根据标准分子克隆方法,将PYRIN、NACHT和LRR结构域的相应片段克隆到pcDNA3.1-Flag载体上。PYRIN正向引物序列为5’-GCATGGATCCAAGATGGCAA GCACCCGC-3’,反向引物序列为5’-GCATCTCG AGCTATAAACCCATCCACTCCTCTTC-3’;NACHT正向引物序列为5’-GCATGGATCCCTGG AGTACCTTTCGAGA-3’,反向引物序列为5’-GC ATCTCGAGCTAGATCTTGCAACTTAAT-3’;LRR正向引物序列为5’-GCATGGATCCTCTCAGC AAATCAGGCTG-3’,反向引物序列为5’-GCATC TCGAGCTACCAAGAAGGCTCAAAGAC-3’。
细胞培养和转染:采用含10%胎牛血清、青-链霉素的DMEM或RPMI-1640高糖培养基,将细胞置于37 ℃、CO2体积分数为5%的培养箱中培养。待细胞贴壁生长融合度达80%时,加入胰蛋白酶消化并传代。对于敲低CDC20和NLRP3的慢病毒包装,采用PEI转染HEK-293T细胞的方法。第1天HEK-293T细胞生长融合度为80%~90%,取出1.5 mL Eppendorf试管做好标记,每个Eppendorf试管中加入700 μL无血清培养液、1 µL PMD2和2 µL pspax2;每个Eppendorf试管加入2.5 µL shCDC20或shNLRP3质粒,混匀。再加入转染试剂16.5 µL。静置15 min,将此混合液滴加到HEK-293T细胞培养皿中。
1.3.2 慢病毒感染
慢病毒培养液准备:在前1天HEK-293T细胞转染之后,第2天更换8 mL DMEM培养基;第3天收集病毒培养液放到50 mL离心管4 ℃存放,再更换8 mL DMEM培养基;第4天收集病毒培养液与前1天病毒培养液混合,用0.45 nm过滤器过滤,即制得慢病毒培养液。如不使用需-80 ℃存放,避免反复冻融,所得慢病毒培养液可分成若干离心管存放,5 mL/管。慢病毒感染和筛选:取对数生长期的EC9706和KYSE-150细胞,消化后接种于10 cm培养皿中培养过夜。第2天观察细胞生长融合度为20%~30%时可以准备慢病毒感染。从-80 ℃冰箱中取出提前准备好的慢病毒培养液,在自来水中融化,感染时用5 mL病毒培养液与5 mL RPMI-1640培养基混合,再加入20 µL聚凝胺(与总培养液1∶500),充分混匀,分早晚2次感染,2次间隔时间约12 h;第3天更换8 mL RPMI-1640培养液;第4天对感染细胞传代分皿,分成2批细胞,加入8 µL嘌呤霉素(与总培养液1∶1 000)筛选2或4 d感染成功细胞,筛选2或4 d后分别收集蛋白,采用蛋白质印迹法(Western blot)进行检测。
1.3.3 RTFQ-PCR检测
采用TRIzol试剂提取总RNA 。使用P rimeS cript反转录试剂盒通过反转录获得cDNA。RTFQ-PCR由ABI 7900HT RTFQ-PCR系统进行。 CDC20基因正义引物序列为5’-CGGAAGACCTGCCGTTACATTC-3’,反义引物序列为5’-CAGAGCTTGCA CTCCACAGGTA-3’; NLRP3基因正义引物序列为5’-AAGGGCCATGGACTATTTCC-3’,反义引物序列为5’-GACTCCACCCGATGACAGT-3’; GAPDH基因正义引物序列为5’-TGCACC ACCAACTGCTTAGC-3’,反义引物序列为5’-GGCATGG ACTGTGGTCATGA-3’。
1.3.4 Western blot检测
收集细胞,提取总蛋白,用Super-Bradford蛋白定量试剂盒测定蛋白浓度,取40 µg蛋白进行8%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离,将分离的蛋白电泳转移至PVDF膜上,用5%脱脂牛奶封闭2 h,1×含吐温-20磷酸缓冲盐溶液(phosphate-buffered saline with Tween-20,PBST)洗膜3次,每次10 min,加入稀释的CDC20、NLRP3和vinculin一抗,4 ℃摇床温育过夜。1×PBST洗膜4次,每次10 min,加入辣根过氧化物酶偶联的二抗,室温摇床温育30 min,1×PBST洗膜4次,每次10 min,用电化学发光(electrochemical luminescence,ECL)试剂显色。
1.3.5 CCK-8实验
用对照短发夹RNA(short hairpin RNA,shRNA)(shscr)或shCDC20、shNLRP3慢病毒构建体感染的EC9706和KYSE150细胞,在补充有10%FBS的RPMI-1640培养基中,通过CCK-8实验进行细胞增殖测定。所有操作按照试剂盒说明书进行,测定450 nm处的吸光度( D)值。
1.3.6 免疫组织化学检测
所选取的ESCC石蜡标本在切片之后用免疫组织化学SP法进行染色,染色及切片扫描实验由武汉塞维尔生物科技有限公司进行。结果由2名经验丰富的病理科医师进行双盲阅片。NLRP3阳性表达为细胞质上呈现棕黄色颗粒,CDC20阳性表达为细胞质和细胞核上呈现棕黄色颗粒,以细胞质为主,每例镜下随机采集10个细胞视野,以镜下阳性细胞百分比和染色强度给予评分。染色肿瘤细胞的阳性百分比定义为:0,无染色;1,<20%;2,20%~75%;3,>75%。染色肿瘤细胞的强度评分标准为:0,阴性;1,弱(淡黄色);2,中度(棕黄色);3,强染色(棕褐色)。染色指数=阳性百分比×强度评分。
1.3.7 免疫共沉淀(Co-immunoprecipitation,Co-IP)实验
在HEK-293T细胞中,同时转染HA-CDC20 、Flag-NLRP3、Flag-ASC1、Flag-Caspase1和EV(对照组)质粒,验证CDC20与NLRP3、ASC1和Caspase1之间的相互作用。具体为:第1天在10 cm细胞培养皿中,HEK-293T细胞密度为70%~80%,同时转染HA-CDC20、Flag-NLRP3、Flag-ASC1、Flag-caspase-1和EV(对照组)质粒,第2天早上更换6 mL DMEM培养基,晚上加6 μL MG132,第3天收集蛋白样品,1 mg总细胞裂解物与8 µL琼脂糖单克隆抗HA抗体4 ℃摇床温育4 h。免疫复合物用NETN缓冲液(20 mmol/L Tris,pH=8.0,100 mmol/L NaCl,1 mmol/L EDTA,0.5%NP-40)洗涤4次,采用Western blot检测结果。
在HEK-293T细胞中,同时转染HA-CDC20、Flag-NLRP3、Flag-Pyrin、Flag-NACHT、Flag-LRR和EV(对照组)质粒,验证CDC20与NLRP3中的哪一个区域相互作用。具体为:第1天在10 cm细胞培养皿中,HEK-293T细胞密度为70%~80%,同时转染HA-CDC20、 Flag-NLRP3、Flag-Pyrin、Flag-NACHT、Flag-LRR和EV(对照组)质粒,第2天早上更换6 mL DMEM培养基,晚上加6 μL MG132,第3天收集蛋白样品,1 mg总细胞裂解物与8 µL琼脂糖单克隆抗Flag抗体(>0.6 μg/μL)4 ℃摇床温育4 h。免疫复合物用NETN缓冲液(20 mmol/L Tris,pH=8.0,100 mmol/L NaCl,1 mmol/L EDTA,0.5%NP-40)洗涤4次,采用Western blot检测结果。
1.3.8 泛素化实验
蛋白酶体抑制剂实验(即MG132实验):用对照shRNA(shscr)或shCDC20慢病毒构建体感染的EC9706和KYSE150细胞,分为2组,1组为对照组,另1组则加入MG-132(与培养液1∶1 000)继续培养,12~18 h后统一收集蛋白样品,进行Western blot检测。泛素化实验:用对照shRNA(shscr)或shCDC20慢病毒构建体感染的EC9706细胞,加入MG132(与培养液1∶1 000)继续培养12~18 h后统一收集蛋白样品,分为WCL组和NLRP3-IP组,NLRP3-IP组的细胞裂解物与NLRP3抗体4 ℃摇床温育4 h,再加入Protein A/G 4 ℃摇床温育1~2 h,免疫复合物用NETN缓冲液(20 mmol/L Tris,pH=8.0,100 mmol/L NaCl,1 mmol/L EDTA,0.5%NP-40)洗涤4次,采用Western blot检测结果。
1.4 统计学处理
采用SPSS 25.0软件对数据进行统计学分析。TCGA数据库中ESCA组织和癌旁组织中CDC20和NLRP3 RNA表达水平分析采用两独立样本Wlicoxn秩和检验。免疫组织化学实验结果比较ESCC组织和癌旁组织中CDC20和NLRP3蛋白水平采用独立样本 t 检验。NLRP3和CDC20在ESCC中的表达差异以及与患者临床病理学特征的关联性采用 χ 2 检验,相关性分析采用Spearman秩相关检验。两组之间的CDC20和NLRP3与免疫细胞分析采用Wlicoxn秩和检验,多组比较采用Kruskal-Wallis单因子方差分析。细胞学实验采用单因素方差分析和双因素方差分析比较不同组之间的差异性。 P <0.05为差异有统计学意义。
2
结 果
2.1 CDC20和NLRP3在ESCA组织中表达升高
为明确CDC20、NLRP3在ESCA中的表达水平,首先对TCGA数据库中ESCA组织和癌旁组织中CDC20和NLRP3 mRNA表达水平进行分析。结果显示,相比癌旁组织,CDC20在ESCA组织中表达升高,约为癌旁组织的5倍( P <0.000 1,图1A)。NLRP3在ESCA组织中表达也升高,约为癌旁组织的1.25倍( P <0.000 1,图1B)。
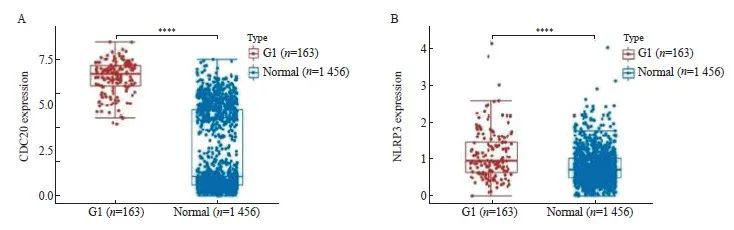
图1 CDC20、NLRP3在ESCA组织中表达上调
Fig. 1 The expression of CDC20 and NLRP3 was up-regulated in ESCA tissues
TCGA database results showed that CDC20 (A) and NLRP3 (B) were highly expressed in ESCA tissues. ****: P<0.000 1, compared with adjacent
tissue.
2.2 免疫组织化学检测CDC20和NLRP3表达及相关性
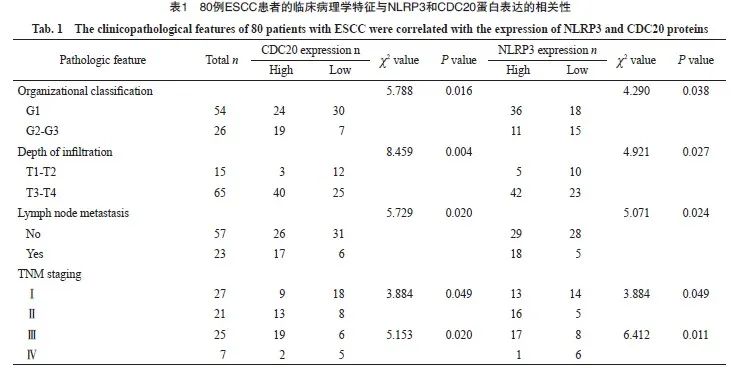
为进一步验证CDC20和NLRP3蛋白的表达水平在ESCC中的变化,随后使用80例ESCC患者的癌组织和癌旁组织标本进行了免疫组织化学实验,并且也系统分析了不同分化程度的ESCC中CDC20和NLRP3蛋白的表达水平。结果显示,相比癌旁组织,CDC20(图2A、2C)和NLRP3(图2B、2D)蛋白的表达水平在ESCC组织中显著升高(图2)。相比NLPR3 mRNA水平变化仅有1.25倍(图1B),其蛋白水平升高约2倍(图2B、2D)。此外,通过进一步分析不同TNM期的患者免疫组织化学结果,发现随着TNM分期的升高,CDC20和NLRP3蛋白表达水平也升高(图2E和2F)。但到Ⅳ期后,CDC20和NLRP3蛋白的表达水平并没有继续升高,推测可能是这个分期的病例数太少。上述结果提示NLRP3翻译或翻译后修饰很可能在ESCC中其发挥重要作用。此外,通过分析80例ESCC患者的临床资料发现,NLRP3和CDC20蛋白的高表达与分化程度、浸润深度、淋巴结转移和TNM分期有关(表1, P <0.05),NLRP3和CDC20在ESCA中的表达水平呈低度正相关(H=0.43, P <0.000 1,图2G)。

图2 免疫组织化学法检测ESCC组织及癌旁组织中NLRP3、CDC20蛋白表达及二者相关性分析
Fig. 2 Immunohistochemical detection of NLRP3 and CDC20 protein expression in ESCC tissues and adjacent tissues, as well as correlation analysis between NLRP3 and CDC20 protein
A, B: CDC20 (A) and NLRP3 (B) is highly expressed in ESCC tissues (SP staining, ×40). C, D: Comparison of CDC20 (C) and NLRP3 (D) scores between ESCC tissues and adjacent tissues generated in (A, B). E, F: The protein expression levels of CDC20 (E) and NLRP3 (F) in ESCC with different degrees of differentiation (Ⅰ-Ⅳ phase). G: Positive correlation between CDC20 and NLRP3 expression in ESCC tissues. ***: P<0.001, compared with cancer tissues.
2.3 ESCA中CDC20和NLRP3的表达水平与免疫浸润细胞相关
NLRP3和CDC20高表达可能与浸润深度、淋巴结转移等有关(表1)。但NLRP3和CDC20与哪些免疫细胞浸润相关仍未知,因此本研究进一步利用肿瘤免疫评估资源(Tumor IMmune Estimation Resource,TIMER)数据库分析了在ESCA中CDC20和NLRP3的表达水平与肿瘤微环境(tumor microenvironment,TME)中的免疫浸润细胞的相关性,结果显示,CDC20表达与肿瘤纯度( r =0.173, P <0.05)呈显著正相关关系,NLRP3表达与B细胞( r =0.246, P <0.01)、CD8 + T细胞( r =0.144, P <0.05)、CD4 + T细胞( r =0.313, P <0.01)、巨噬细胞( r =0.461, P <0.01)、中性粒细胞( r =0.455, P <0.01)及树突状细胞( r =0.283, P <0.01)的免疫细胞浸润水平呈显著正相关关系(图3A、3B)。进一步分析基于CDC20和NLRP3特征的体细胞拷贝数改变对免疫细胞浸润的影响,分析得出,CDC20显著影响了ESCA中CD4 + T细胞、中性粒细胞及树突状细胞的浸润水平,NLRP3显著影响了ESCA中CD8 + T细胞、中性粒细胞及树突状细胞的浸润水平(图3C、3D)。上述结果表明,CDC20和NLRP3对ESCA患者的TME具有关键调节作用,此外,本研究结果还显示,CDC20与NLRP3的免疫浸润细胞呈负相关关系( r =-0.012, P <0.05,图3E),表明CDC20和NLRP3之间可能存在相互协调的作用。
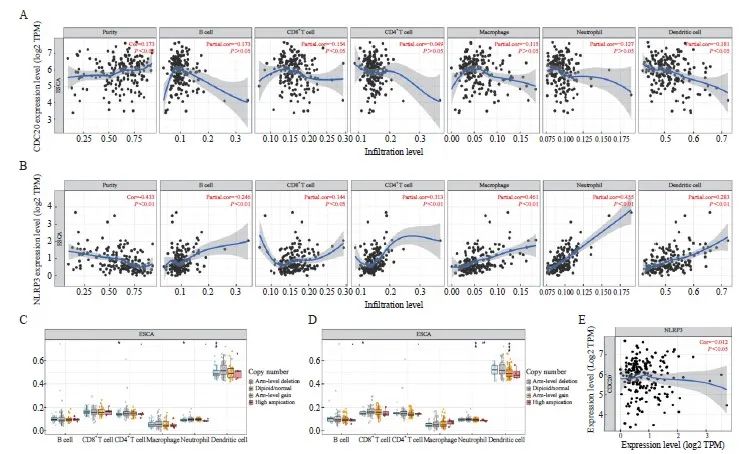
图3 分析CDC20、NLRP3与免疫浸润细胞的相关性
Fig. 3 Analysis of the correlation between CDC20, NLRP3 and immune infiltrating cells
A, B: The TIMER system assessed the correlation between CDC20 (A), NLRP3 (B) and the level of infiltration of different immune cells (CD8 +T cells, CD4 +T cells, macrophages, B cells, dendritic cells and neutrophils) in ESCA. C, D: Effect of CAN on the level of immune cell infiltration in ESCA based on CDC20 (C) and NLRP3 (D) characteristics. E: Relationship between CDC20 and NLRP3 in TME. *: P<0.05; **: P<0.01; ***: P<0.001.
2.4 CDC20蛋白稳定NLRP3表达
TIMER数据库分析结果显示,CDC20和NLRP3之间可能存在相互协调的作用。通过对NLRP3氨基酸序列进行分析,发现其存在与CDC20结合的Dbox区,因此推测CDC20可能与NLRP3发生相互作用。Co-IP实验结果显示,CDC20蛋白与NLRP3蛋白结合,而不是与炎症小体中的其他成分(ASC1和caspase-1)结合(图4A)。NLRP3由PYD、NACHT和LRR组成(图4B),本研究进一步构建了NLRP3 PYD、NACHT和LRR区,结果显示,CDC20通过LRR区与NLPR3结合(图4C)。考虑到CDC20是APC/C复合物的泛素化酶共刺激因子,主要通过识别底物并导致其泛素化降解等 [5] ,接着敲低 CDC 20,结果显示,敲低 CDC 20后,NLPR3蛋白表达水平在EC9706(图4D、4F)和KYSE150中均降低(图4E、4G)。然而,RTFQ-PCR结果显示,NLRP3 mRNA并未发生变化(图4H、4I),暗示CDC20可能通过调控NLRP3翻译后修饰稳定其表达。首先采用经典的蛋白酶体抑制剂MG132测试CDC20是否通过蛋白酶体途径调控NLRP3。结果显示,当敲低 CDC 20,同时用MG132处理后,NLRP3水平未降低,且比未处理之前显著升高(图4J~4M)。随后的泛素化实验结果也显示,敲低CDC20降低了NLRP3的泛素化水平(图4N)。上述结果表明,CDC20通过与NLRP3结合并泛素化NLRP3稳定其表达。
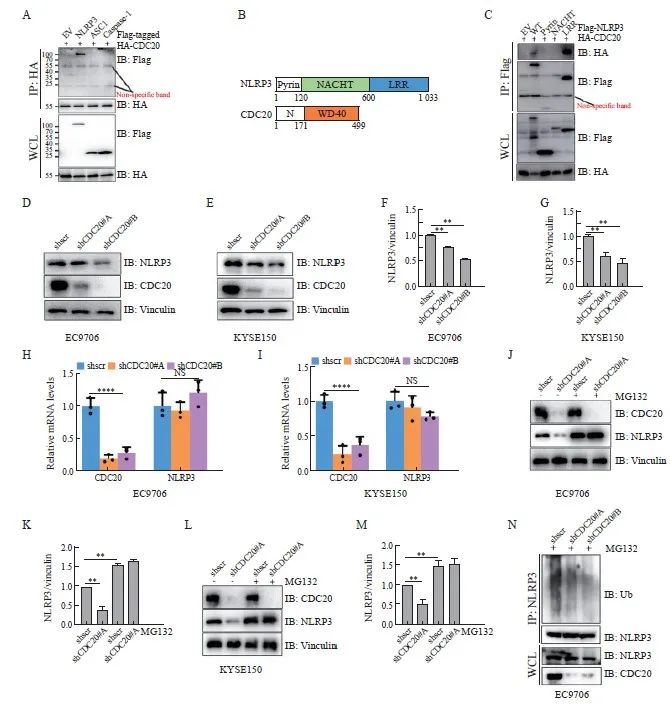
图4 CDC20正调节NLRP3表达
Fig. 4 CDC20 protein positively regulates NLRP3 expression
A: Co-IP showed that CDC20 proteins bind to NLRP3 proteins. B: Schematic diagram of domain structure for CDC20 and NLRP3. C: Co-IP shows that the binding region of CDC20 and NLRP3 is located in the LRR region. D, E: WB showed that knockdown of CDC20 in EC9706 (D) and KYSE150 (E) cells resulted in decreased levels of NLPR3 protein expression. F, G: Image J analysis of NLRP3 protein generated in (D, E). H, I: qRT-PCR analysis the mRNA level of EC9706 (H), KYSE150 (E) cells generated in (D, E). J, L: WB results showed that knockdown of CDC20 and treatment with MG132 in EC9706 (J) and KYSE150 (L) cells resulted in elevated levels of NLRP3 protein compared to shscr. K-M: Image J analysis of NLRP3 protein generated in (J, L). N: WB results showed that knockdown of CDC20 decreased the ubiquitination level of NLRP3 in EC9706. **: P<0.01; ****: P<0.000 1.
2.5 敲低 CDC 20和NLRP3抑制ESCC细胞增殖
上述研究已发现CDC20可以稳定NLRP3的表达以及两者之间可能存在相互协调的作用。因此我们接着探索CDC20和NLRP3是否在ESCA中发挥相同的作用。通过在EC9706细胞和KYSE150细胞中敲低 CDC 20,CCK-8实验结果显示,敲低 CDC 20后(图5C、5D),与对照组(shscr)相比,EC9706细胞(图5A)和KYSE150(图5B)细胞增殖能力明显降低。同样,在EC9706细胞和KYSE150细胞中敲低 NLRP 3后(图5G、5H),EC9706细胞(图5E)和KYSE150细胞(图5F)增殖能力也明显下降。此外,在ESCA细胞系中敲低 CDC 20后,NLRP3蛋白表达下调(图4D、4E)。上述结果表明。敲低 CDC 20和 NLRP 3可显著抑制ESCA细胞增殖。

图5 在ESCA细胞系中敲低CDC20和NLRP3后细胞增殖能力减弱
Fig. 5 Cell proliferation weas reduced after knockdown of CDC20 and NLRP3 in ESCA cell lines
A, B: Cell proliferation analysis showed significant reduction in cell proliferation after CDC20 knockdown in EC9706 (A) and KYSE150 (B). C, D: Western blot analysis of EC9706 (C) and KYSE150 (D) cells infected with control (shscr) or the indicated shCDC20 lentiviral shRNA constructs. E, F: Cell proliferation analysis showed significant reduction in cell proliferation after NLRP3 knockdown in EC9706 (E), KYSE150 (F). G, H: WB analysis of EC9706 (G) and KYSE150 (H) cells infected with control (shscr) or the indicated shNLRP3 lentiviral shRNA constructs. *: P<0.05; **: P<0.01; ****: P<0.000 1.
3
讨 论
ESCA是一种恶性程度很高的恶性肿瘤,总治愈率<10%。在临床上,超过50%的病例表现为全身性疾病,难以治愈。在具有局部病变的患者中,大多数患者在初次治疗后会复发,治愈率为12%~35% [32]。目前,手术、化疗和放疗是ESCC的主要治疗选择,然而生存率低且易复发,导致患者生存质量下降,寻找新的靶向标志物和开发新的治疗策略迫在眉睫 [33]。本研究结果显示,CDC20和NLRP3在ESCA中高表达,敲低 CDC20和 NLRP3能够抑制ESCA细胞增殖,进一步研究发现,CDC20通过泛素化NLRP3稳定其表达促进ESCA细胞增殖,这些结果与 CDC20在肿瘤中发挥癌基因作用的报道一致。
NLRP3是炎症小体的主要组成部分,炎症及持续感染可能会导致各种恶性肿瘤,炎症能够影响癌症的血管生成和侵袭。然而,炎症小体是否参与免疫系统在肿瘤中的作用仍不清楚 [34- 35]。肿瘤的发生、发展涉及多个复杂的生物学过程,TME在ESCC的发生、发展中发挥重要作用。在肿瘤发生的早期,TME中的免疫细胞等可以形成有抑瘤作用的炎性环境。肿瘤浸润性T淋巴细胞是抗肿瘤免疫反应中最重要的效应细胞,也是决定恶性肿瘤患者预后的重要因素 [36-37]。在TME浸润的淋巴细胞中CD8 +T细胞约占60%,是杀伤肿瘤细胞最主要的武器,其浸润丰度与患者预后密切相关。我们的前期研究 [36]也发现,CD8 +T细胞高浸润ESCC患者的总生存期更长,暗示CD8 +T细胞可能成为评估ESCC患者预后的一个潜在的免疫指标。且经COX回归分析检测,发现仅用CD8 +T细胞浸润丰度为指标尚不足以预测ESCC患者的预后,提示可能存在其他影响因素。本研究发现NLRP3和CDC20与肿瘤分化程度、浸润深度、淋巴结转移和TNM分期有关联。 本研究结果显示,CDC20表达与肿瘤纯度呈显著正相关关系,NLRP3表达与B细胞、CD8 + T细胞、CD4 + T细胞、巨噬细胞、中性粒细胞及树突状细胞的免疫细胞浸润水平呈显著正相关关系。 进一步研究还发现CDC20显著影响ESCA中CD4 + T细胞、中性粒细胞及树突状细胞的浸润水平,NLRP3显著影响ESCA中CD8 + T细胞、中性粒细胞及树突状细胞的浸润水平。 上述结果表明,CDC20和NLRP3对ESCA患者的TME具有关键调节作用,且CDC20与NLRP3之间可能存在相互协调的作用。 这些结果与我们的前期研究 [36] 的结果一致,提示ESCC的发生、发展及患者预后与多个免疫指标相关。
CDC20是细胞周期的重要调节因子,且肿瘤发生与细胞周期失调密切相关。本研究结果也证实了CDC20与NLRP3的直接相互作用,且敲低 CDC20能够降低NLRP3的表达。此外,泛素化实验证实了CDC20通过泛素-蛋白酶体途径调节NLRP3的稳定性。但CDC20如何泛素化以及通过哪些泛素化位点发挥作用,仍待进一步研究。此外,关于细胞周期失调是否会引起炎症反应及参与免疫调节仍未知,也值得进一步探讨。
总之,本研究揭示了在ESCC中CDC20通过稳定NLRP3促进ESCC细胞增殖,且发现CDC20与NLRP3以及多种免疫细胞,如CD8 +T细胞与CD4 +T细胞之间存在相关性,因此CDC20和NLRP3可能是潜在的ESCA诊断靶向标志物。本研究结果也提示,将CDC20或NLRP3与免疫治疗联合应用等对延长患者生存期和改善预后、提高生活质量可能具有一定意义。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
关瑞瑞:完成实验,撰写文章;
郝茜,张雅琦:参与实验;
孙庆港,陈怡恬:生信分析,参与实验;
李秀敏:参与文章修改;
周祥,韩涛:实验设计和监督,指导文章修改。
[参考文献]
本文责任编辑:李广涛
链接:http://www.lewenyixue.com/2024/06/24/%E3%80%90%E8%AE%BA%E8%91%97%E3%80%91%7C%20CDC20%E9%80%9A%E8%BF%87%E7%A8%B3%E5%AE%9ANLRP3/









赶快来坐沙发