儿童高级别胶质瘤(pHGG)是一种异质性很强的肿瘤类型,由组蛋白和相关的基因突变驱动,肿瘤类型、生长部位以及发病年龄与具体的突变位点相关。目前缺乏有效的治疗方法,亟需更加有效的、针对不同分型的精准治疗方法。
大约一半的高级别胶质瘤以及大多数的弥漫性中线胶质瘤的发生与H3组蛋白变异有关,但单独的组蛋白变异并不足以引起肿瘤发生,需要包括p53、ATRX等在内的伴侣基因同时发生突变。考虑到这些伴侣基因在靶向药物治疗方面,相较于组蛋白变异、有着更大的潜力,明确这些伴侣基因在不同分型肿瘤发生过程中的具体情况,至关重要。
近日,由剑桥大学和麦吉尔大学 Manav Pathania, Claudia L. Kleinman 以及 Nada Jabado 联合团队发表于 Cancer Discovery 题为 A Compendium of Syngeneic, Transplantable Pediatric High-Grade Glioma Models Reveals Subtype-Specific Therapeutic Vulnerabilities 的文章, 通过构建16种新型组蛋白变异驱动的胶质瘤体内模型,研究了多种伴侣基因在不同分型的胶质瘤发生过程中的具体影响,并进一步探索了潜在的治疗方案。

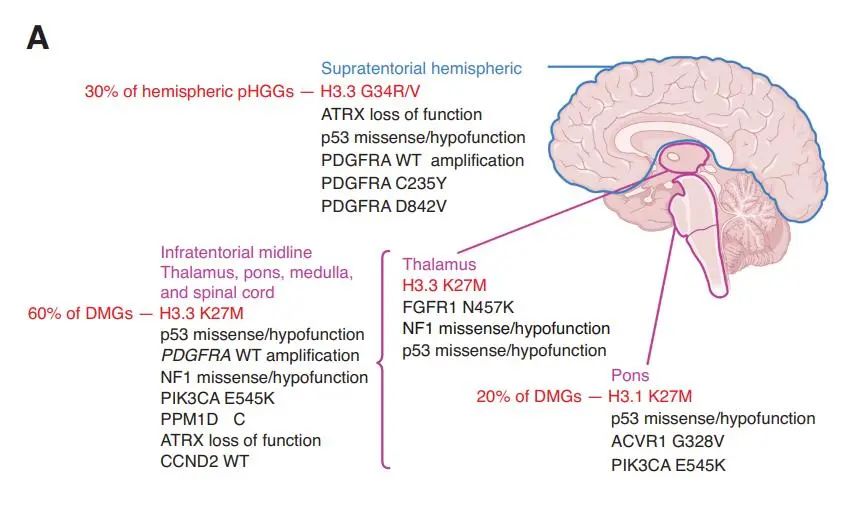
半数儿童高级别胶质瘤以及大部分的弥漫性中线胶质瘤(DMG)都携带了H3组蛋白变体H3.1和H3.3,具体为K27位点上甲硫氨酸取代赖氨酸(K27M),或是G34位点上精氨酸/缬氨酸取代甘氨酸(G34R/V)。单独的组蛋白变异并不足以引起肿瘤发生,需要包括p53、ATRX等在内的伴侣基因同时发生突变。不同胶质瘤分型的组蛋白变异和伴侣基因情况如下图所示。
研究团队首先通过基于子宫内电穿孔(in utero electroporation, IUE)的技术,向胚胎的神经干细胞微环境中递送了不同的突变组合。
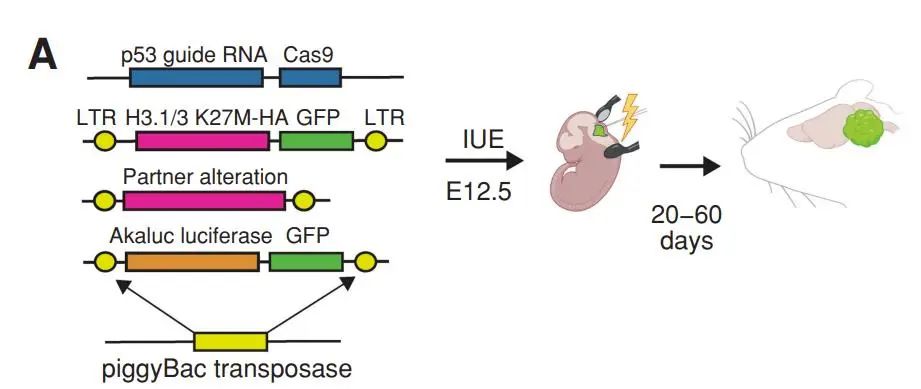
不同突变组合的神经干细胞微环境驱动形成胶质瘤的小鼠模型构建
首先构建出来的是携带H3.3G34R、ATRXLOF以及p53LOF (GPA),联合 PDGFRAWT (GPAP)、 PDGFRAC235Y (GPAC)或PDGFRAD842V (GPAD)的小鼠模型。不同PDGFRA分型的肿瘤行为有所差异,但和相应的临床表现相符。在首先构建出来的由H3.3G34R和PDGFRAC235Y驱动的胶质瘤模型中,研究团队观察到神经节隆起可以作为肿瘤细胞的微环境前体。
此外,来源于携带突变的小鼠的胶质瘤神经球细胞系中,研究团队进行了一系列小分子抑制剂的筛选。最终发现对于传统PDGFRA抑制剂并不敏感的GPAC分型的肿瘤细胞系,表现出了对于FGFR抑制剂英菲替尼高度敏感,提示了潜在的治疗策略。
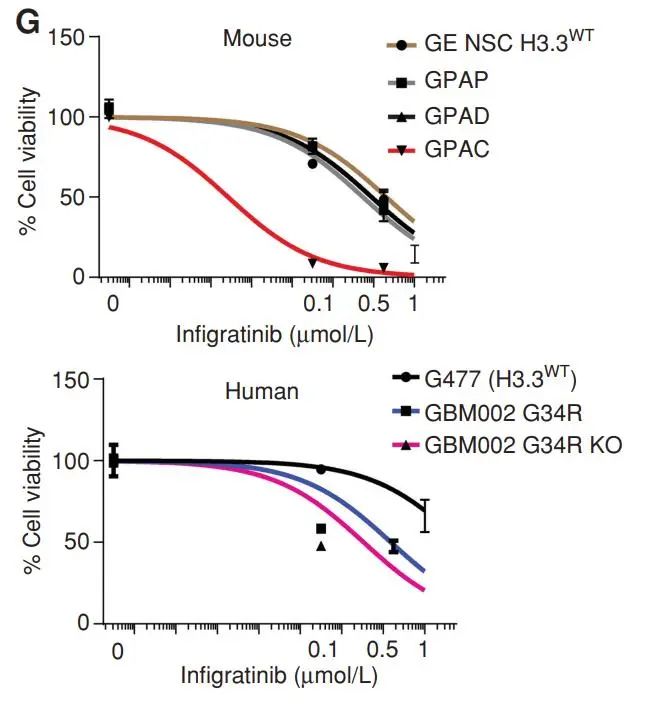
携带不同突变的细胞系对英菲替尼的反应情况(GBM002:患者来源的携带G34R突变的细胞)
随后,研究团队沿用先前的方法,研究了最具代表性的不同的分子伴侣,协同携带K27M的组蛋白变体,对于肿瘤发生的影响。值得注意的是,这一新型造模方法不需要在肿瘤发生过程中额外持续性激活PDGF/PDGFRA通路,使得具体分型的致病机制得以观察。
结果提示, 单独的携带K27M的组蛋白变体并不足以使肿瘤发生。然而,一旦合并p53缺失等几种分子伴侣异常(如下图所示),便可导致高外显率的肿瘤发生。

导致高外显率的胶质瘤发生的具体分子分型(绿、红、蓝、紫每种颜色代表一种组合)
对疾病模型小鼠进行持续性观察提示,不同分子分型的脑瘤,在外生性生长、颅神经侵犯以及脑脊液播散等行为学方面的表现不尽相同。单细胞核转录组测序结果提示小鼠模型与人类肿瘤中的细胞类型高度关联。
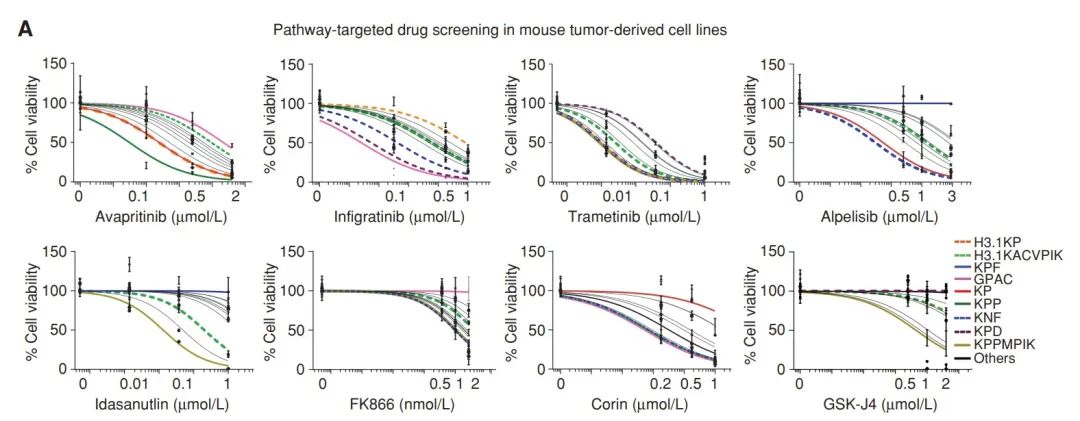
最后,研究人员将先前小鼠模型中的肿瘤组织,移植到遗传背景相同且具有免疫能力的小鼠中,进行了一系列治疗相关的探索。结果提示,H3.3G34R/PDGFRAC235Y对于FGFR抑制剂英菲替尼高度敏感,PDGFRAWT以及 PIK3CAE545K/PPM1DΔC则对于PIK3CA抑制剂阿培利司和MEK 抑制剂曲美替尼联合用药敏感。
此外,KPD (PDGFRAD842V)分型与KPP (PDGFRAWT)分型在英菲替尼等4种药物中均表现出了不同的敏感性,提示 PDGFRA基因型在精准治疗上潜在的指导意义。
总之, 该研究提出了一种不需要在肿瘤发生过程中额外持续性激活PDGF/PDGFRA通路的新型造模方法,使得胶质瘤不同分型的致病机制得以观察。 研究团队进一步利用该技术, 探索了多种组蛋白变异及相关分子伴侣组合对于胶质瘤发生的作用,并后续通过先前造模得到的肿瘤组织,进一步构建了相关模型,并进行了相关靶向药的筛选。
无论是改良的疾病模型构建方法,还是对于不同分子分型以及不同靶向药的细致分析,对于胶质瘤的诊治进步而言都非常重要。
撰文

责编

制作
排版 | Sheila 校对 | uu
▼滑动查看更多▼
Pediatric high-grade gliomas (pHGG) are lethal, incurable brain tumors frequently driven by clonal mutations in histone genes. They often harbor a range of additional genetic alterations that correlate with different ages, anatomic locations, and tumor subtypes. We developed models representing 16 pHGG subtypes driven by different combinations of alterations targeted to specific brain regions. Tumors developed with varying latencies and cell lines derived from these models engrafted in syngeneic, immunocompetent mice with high penetrance. Targeted drug screening revealed unexpected selective vulnerabilities-H3.3G34R/PDGFRAC235Y to FGFR inhibition, H3.3K27M/PDGFRAWT to PDGFRA inhibition, and H3.3K27M/PDGFRAWT and H3.3K27M/PPM1DΔC/PIK3CAE545K to combined inhibition of MEK and PIK3CA. Moreover, H3.3K27M tumors with PIK3CA, NF1, and FGFR1 mutations were more invasive and harbored distinct additional phenotypes, such as exophytic spread, cranial nerve invasion, and spinal dissemination. Collectively, these models reveal that different partner alterations produce distinct effects on pHGG cellular composition, latency, invasiveness, and treatment sensitivity.
DOI: 10.1158/2159-8290.CD-23-0004
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/05/15/Cancer%20Discov%20%7C%20%E6%96%B0%E5%9E%8B%E7%96%BE%E7%97%85/







