打破细菌癌症疗法的瓶颈:肿瘤控制与T细胞功能的“双刃剑”效应
导语: 细菌癌症疗法 以其独特的肿瘤靶向性和免疫调节能力,为结直肠癌治疗带来新希望。然而, T 细胞在其中的作用机制尚不明确,这是否意味着我们错过了某种关键的免疫调节机制?最近,一项研究揭开了谜底。
在结直肠癌( CRC )的治疗中,尽管手术切除、化疗、放疗以及靶向治疗等手段广泛应用,但这些传统方法在提高患者长期生存率和生活质量方面仍显不足。近年来,免疫检查点抑制剂( ICB )在多种肿瘤治疗中取得突破性进展,但在 CRC 患者中的应用效果却不尽如人意。由于 CRC 肿瘤微环境常表现为免疫“冷”状态,即肿瘤细胞周围缺乏足够的免疫细胞浸润,导致 ICB 治疗在 CRC 患者中的响应率较低。此外, CRC 的异质性也使得单一治疗手段难以取得理想效果。
细菌癌症疗法作为一种新兴的免疫治疗手段,因其独特的肿瘤靶向性和免疫调节能力而备受关注。沙门氏菌( STm )作为其中的代表性菌株,凭借其代谢适应性强、能够快速适应肿瘤微环境并特异性靶向肿瘤细胞的特点,成为研究热点。既往研究表明, STm 可通过代谢竞争消耗肿瘤细胞生长所需的营养物质,如氨基酸、糖类和三羧酸循环中间体,从而抑制肿瘤生长。然而, STm 治疗的疗效在不同患者间存在显著差异,其具体机制尚不明确。并且,尽管 STm 能够诱导肿瘤微环境中的免疫细胞浸润和炎症因子分泌,但 T 细胞在 STm 治疗中的作用机制却鲜有研究。

T 细胞作为免疫反应的核心细胞,在肿瘤免疫中发挥着关键作用,但既往研究多认为 T 细胞在 STm 治疗中作用有限,甚至被认为是“冗余”的。这一现象背后隐藏着何种免疫学机制? 2024 年 11 月, EMBO Molecular Medicine 杂志发表了一篇题为“ Salmonella cancer therapy metabolically disrupts tumours at the collateral cost of T cell immunity ”的研究,深入探讨了 STm 治疗过程中 T 细胞的代谢性缺陷及其与肿瘤控制之间的复杂关系,揭示了 STm 通过代谢调控抑制 T 细胞功能的机制, 并证实这种代谢调控同时对肿瘤干细胞特性具有直接抑制作用 。
本研究是一项多模型联合的实验研究,旨在深入解析 STm 在细菌癌症疗法中对 T 细胞功能的影响及其潜在机制。研究纳入了多种实验模型,包括小鼠模型、肿瘤类器官平台以及体外细胞共培养系统。首先,研究者利用携带远端 T 细胞受体( TCR )和 IFN γ报告基因的小鼠( Nr4a3-Tocky-Ifn γ -YFP ),结合 CRC 模型,模拟 STm 治疗过程中的 T 细胞动态变化。
实验分组包括接受 STm 治疗的小鼠和对照组( PBS 处理)。干预措施为通过口服给予小鼠 STm 突变株( STm Δ aroA ),模拟临床治疗场景。主要评价指标包括 T 细胞的激活状态、细胞因子分泌、增殖能力以及肿瘤微环境中的代谢变化;次要评价指标涵盖肿瘤体积、肿瘤干细胞标志物表达等。通过这种多模型联合的设计,研究不仅能够在体内环境中观察 T 细胞的整体反应,还能在体外精确解析 STm 对 T 细胞代谢和功能的直接影响。
在体内实验中,研究人员发现STm治疗的小鼠肿瘤组织中浸润的T细胞表现出多种激活缺陷。包括IFN-γ产生与TCR信号解耦,即IFN-γ的产生不再依赖于TCR信号的激活。通过流式细胞术分析,STm处理组中IFN-γ+Nr4a3-Timer阴性T细胞的比例显著高于PBS对照组(P=0.0002),表明T细胞的激活与TCR信号传导存在脱节(图1)。
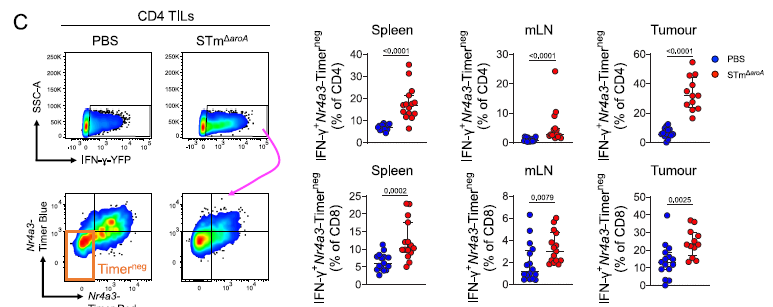
注:左侧代表性流式细胞术图显示 IFN- γ + T 细胞的分选和 Nr4a3-Timer 表达的亚分析(蓝色或红色形式);右侧分析 CD4 或 CD8 T 细胞中 IFN- γ + 和 Timer 阴性细胞的比例。
图 1 减毒沙门氏菌癌症疗法诱导 T 细胞异常激活,使 IFN- γ与 TCR 信号解耦
此外, T 细胞的多功能性降低,表现为同时分泌多种细胞因子(如 IL-2 、 IFN- γ、 TNF- α)的 T 细胞数量减少(图 2D )。这表明, STm 治疗虽然能够诱导 T 细胞产生 IFN- γ,但这种激活是不完整的,且与 TCR 信号的正常传导存在脱节。
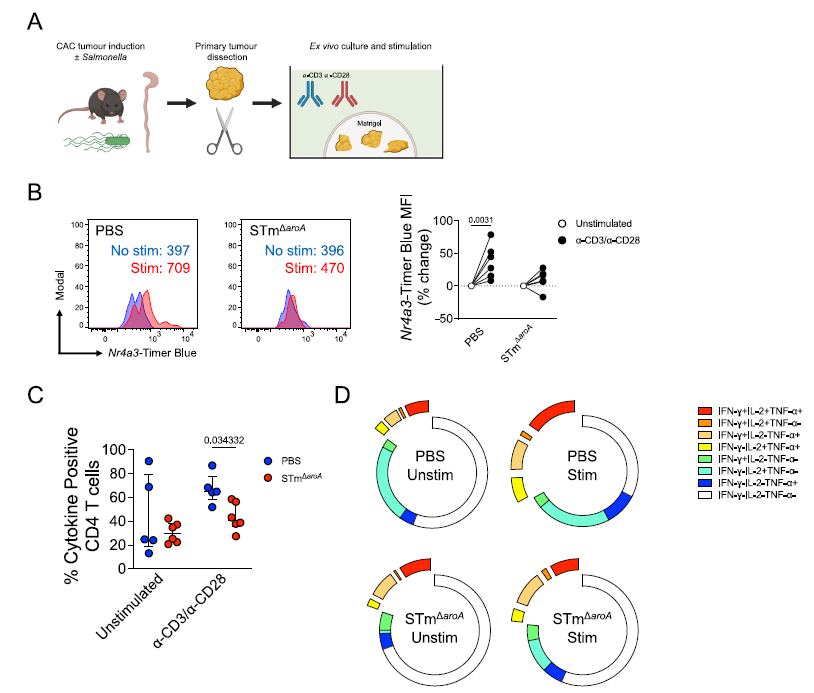
注: (A) 在 CAC 模型中解剖原发性肿瘤,随后在 Matrigel 中培养以进行体外同步激活; (B) 原发性 TILs 用α -CD3/ α -CD28 抗体(分别为 1 和 5 μ g/mL )刺激 16 小时,然后通过流式细胞术评估 CD4 T 细胞的 Nr4a3-Timer 表达,指示 TCR 驱动的 T 细胞激活; (C) 肿瘤碎片在存在布雷菲尔丁 A ( 10 μ g/mL )的情况下,用α -CD3/ α -CD28 抗体激活 6 小时,并通过细胞内细胞因子染色( ICS ; IL-2 、 IFN γ、 TNF α)测量同时的细胞因子产生; (D) 对每种可能的细胞因子组合进行布尔分析,显示所有四个条件的合并结果。
图 2 经沙门氏菌处理的小鼠肿瘤浸润淋巴细胞( TILs )功能受损
进一步的体外实验显示, STm 感染的肿瘤微环境能够显著抑制 T 细胞的代谢重编程。在肿瘤类器官平台和体外细胞共培养实验中,研究人员发现 STm 感染的肿瘤微环境中 T 细胞的 c-Myc 蛋白表达显著降低(图 3 )。 c-Myc 是细胞代谢的关键调控因子,其表达的降低导致 T 细胞无法正常上调糖酵解和氧化磷酸化相关酶的表达,进而影响了 T 细胞的增殖和细胞因子分泌能力。
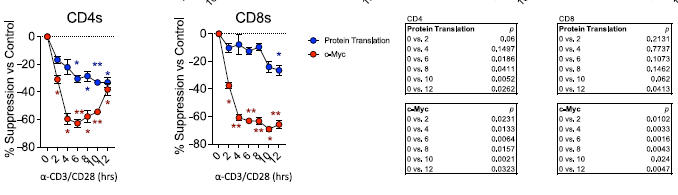
图 3 沙门氏菌感染的肿瘤微环境中 T 细胞 c-Myc 蛋白表达显著降低
研究人员还发现, STm 通过其天冬氨酸酶( ansB )耗竭肿瘤微环境中的天冬氨酸,从而抑制 c-Myc 蛋白的表达(图 4 )。这一发现不仅解释了 T 细胞在 STm 治疗中的功能障碍,还揭示了 STm 通过代谢调控直接抑制肿瘤干细胞特性的重要机制。
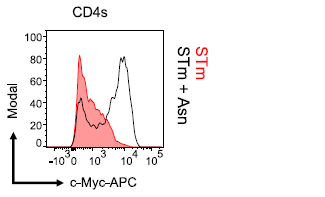
图 4 天冬氨酸补充恢复 T 细胞中 c-Myc 蛋白表达
这些结果表明, STm 对 T 细胞功能的抑制和对肿瘤的直接控制之间存在一种“双刃剑”效应 。 一方面, STm 通过耗竭天冬氨酸抑制 T 细胞的代谢和功能,从而避免 T 细胞介导的免疫反应对其自身造成损害;另一方面,这种代谢调控机制也直接抑制了肿瘤干细胞的特性,从而实现对肿瘤的控制。
总结
本文通过多模型联合的实验设计,深入解析了沙门氏菌在细菌癌症疗法中对 T 细胞功能的影响及其潜在机制。研究揭示了 STm 通过代谢调控抑制 T 细胞功能的同时,也直接抑制肿瘤干细胞特性,这一发现为优化 BCT 策略提供了新的思路。尽管恢复 T 细胞功能可能削弱 STm 对肿瘤的直接控制,但该研究为未来开发更有效的联合治疗方案奠定了基础,具有重要的临床转化潜力。
参考文献
COPLAND A, MACKIE GM, SCARFE L, et al. Salmonella cancer therapy metabolically disrupts tumours at the collateral cost of T cell immunity[J]. EMBO Mol Med. 2024, 16(12):3057-3088. DOI: 10.1038/s44321-024-00159-2.
链接:http://www.lewenyixue.com/2025/04/14/%E6%89%93%E7%A0%B4%E7%BB%86%E8%8F%8C%E7%99%8C%E7%97%87%E7%96%97%E6%B3%95%E7%9A%84%E7%93%B6%E9%A2%88%EF%BC%9A%E8%82%BF%E7%98%A4%E6%8E%A7%E5%88%B6%E4%B8%8ET%E7%BB%86%E8%83%9E/





赶快来坐沙发