Cancer Cell | 复旦大学团队揭示小细胞肺癌的肿瘤异质性和免疫生态位
撰文: Even
IF=48.8
推荐度: 
亮点:
1、 包含 165 名 SCLC 患者的 CODEX 和多组学资料的空间图谱
2、 细胞邻域提示肿瘤表型转变和 TME 变化
3、 ColonyMap 算法检测 MT2 生态位与高生存率高度相关
4、 基于 M1 样巨噬细胞的 MT2 生态位预测免疫治疗反应的改善
近日,复旦大学附属肿瘤医院胸外科的陈海泉教授团队同复旦大学生命科学院曹志伟教授团队在 Cancer Cell 上发表题为 : Integrative spatial analysis reveals tumor heterogeneity and immune colony niche related to clinical outcomes in small cell lung cancer 的研究性论文。团队描绘了小细胞肺癌( SCLC )的综合单细胞分辨空间图谱,空间分析确定了与侵袭模式和转移轨迹相关的特异性多阳性肿瘤细胞富集区。 ColonyMap 算法进一步揭示了空间聚集性免疫生态位 (MT2) ,其特征是具有预测免疫治疗反应的潜力。
小细胞肺癌( SCLC )是一种具有高度侵袭性的恶性肿瘤,特点是生长迅速、早期扩散以及较差的长期预后。与其他癌症(如非小细胞肺癌( NSCLC )和乳腺癌)在生物标志物引导的个体化治疗策略有所不同, SCLC 长期以来被视为一种同质性疾病。近期的大规模基因表达分析揭示了 SCLC 的分子亚型和肿瘤间异质性,基于四个谱系决定性转录因子( ASCL1 、 NEUROD1 、 POU2F3 和 YAP1 )。一项最新的蛋白组学研究发现了来自 112 例 SCLC 患者的四个不同亚型,并在细胞系及患者来源异种移植( PDX )模型中验证了它们可能的不同治疗易感性。
除了肿瘤间的差异, SCLC 的肿瘤内异质性也通过时序单细胞转录组( scRNA-seq )分析进行了研究,揭示了单个肿瘤中存在多种分子亚型,这可能与治疗选择相关。尽管基因组和转录组分析已大大提升了对 SCLC 异质性的理解,并提出了有前景的治疗选择,但肿瘤内外的空间异质性、细胞组织及其与患者预后的关系仍然未被探索。
近年来,随着高通量成像技术(如 CODEX )的发展,研究者可以在固定的组织中同时捕捉单细胞的分子信息和空间位置信息,从而为 SCLC 提供空间解析视角的数据,并帮助揭示肿瘤 - 免疫相互作用及其对预后和治疗反应的影响。然而,目前对于 SCLC 肿瘤 - 免疫相互作用与预后和治疗反应结合的空间图谱资源仍然较为匮乏。
在这里,本研究通过使用共检测索引( CODEX )和多组学分析,描绘了 165 名 SCLC 患者的空间景观,生成了 267 幅高维图像,涵盖了超过 930 万个细胞。结合 CODEX 和基因组数据,研究揭示了 ASCL1+ ( SCLC-A )亚型中肿瘤细胞邻域的多重阳性特征,表现为高 SLFN11 表达并与不良预后相关。
研究进一步开发了细胞群体检测算法( ColonyMap ),揭示了一个空间上的免疫生态位,其中包括抗肿瘤巨噬细胞、 CD8+ T 细胞和自然杀伤 T 细胞( MT2 ),这一细胞群与较好的生存率高度相关,并能预测独立队列中免疫疗法反应的改善。这项研究为研究 SCLC 的空间异质性提供了宝贵的资源,并为患者分层和个性化治疗提供了重要的见解。
1 、 SCLC 中空间分辨单细胞表型图谱

图1. SCLC 中空间分辨单细胞表型图谱
为了全面分析小细胞肺癌( SCLC )的细胞组成、空间组织和分子异质性,作者创建了一个多组学图谱,涵盖了所有临床病理特征的原发性 SCLC 肿瘤( Fudan University [FU]-SCLC 队列),并结合长期随访数据。
本研究使用了肿瘤治疗前的组织样本,进行了全外显子组测序( WES )、大规模 RNA 测序( RNA-seq )和 CODEX 技术,辅以空间分子成像( SMI ) CosMx 和免疫组化( IHC )验证。 CODEX 采用了 35 重抗体面板,能够同时定量包括分子亚型转录因子( TFs )在内的多种蛋白,分析 SCLC 异质性。作者从 129 个肿瘤样本和 16 个配对正常组织中获得了 267 张高维组织病理图像,检测了 9337647 个细胞,利用监督性谱系分配方法根据经典标记对细胞表型进行分类。
研究发现,几乎所有肿瘤( 129 个肿瘤中的 120 个)至少取样了两个核心区域,这使得能够研究肿瘤内部的空间异质性。肿瘤组成在不同核心之间的保存较好,但 TME 细胞表型的异质性较大。例如, YAP1+ 肿瘤细胞( TCs )之间的相关性较弱,可能是因为 YAP1 在肿瘤和间质组织中的非特异性表达模式。然而, CD68+ 巨噬细胞在同一肿瘤的不同核心之间表现出较强的保存性,表明其在肿瘤浸润中的重要作用。综上所述, SCLC 的肿瘤和免疫微环境在不同区域之间存在异质性,而空间组学技术相比传统的批量测序,在域分割和组织结构映射上提供了显著优势。
2 、 CODEX 揭示 SCLC 的肿瘤异质性

图 2. CODEX 揭示 SCLC 的肿瘤异质性
作者进一步探索小细胞肺癌( SCLC )的分子和肿瘤免疫微环境( TME )异质性,利用 CODEX 技术和多组学分析,对 165 名 SCLC 患者的肿瘤样本进行了空间景观绘制,生成了 267 幅高维图像,涵盖了超过 930 万个细胞。研究发现, ASCL1+ 肿瘤细胞( TCs )占所有肿瘤细胞的 50% 以上,而巨噬细胞在免疫细胞中最为丰富。令人惊讶的是,超过 10% 的肿瘤细胞( 916 , 348 个细胞)被识别为多阳性肿瘤细胞( MPTCs )。
为了更好地划分这些亚型,研究采用了类似于肺腺癌病理分型的方法,将不同的肿瘤细胞群体按主导分子亚型进行分类。分析表明, SCLC-A 亚型中的肿瘤核心超过 40% 含有 MPTCs ,进一步揭示了 SCLC 肿瘤内的空间分子异质性。
通过 RNA 测序数据,发现 SCLC-A 亚型与 SCLC-N/Y 亚型相比, NE 分化相关基因的表达明显下降,而非 NE 分化相关基因表达则呈现相反的趋势,提示这些亚型可能代表了 SCLC 的去分化过程。 SCLC-Y 亚型显示出最大的免疫细胞浸润,主要由髓系细胞,尤其是巨噬细胞的转变驱动。值得注意的是, SCLC-P 亚型显示出 FOXP3+Treg 细胞群体的显著增加,且该亚型的患者预后最差。总之, CODEX 揭示了几种 SCLC 亚型的分子标记表达和免疫细胞组成的异质性。
3 、 ColonyMap 检测 SCLC 的空间细胞集落

图 3. ColonyMap 检测 SCLC 的空间细胞集落
为了更好地研究小细胞肺癌( SCLC )肿瘤免疫微环境( TME )中的空间异质性和细胞相互作用,本研究开发了 ColonyMap 算法,通过分析 CODEX 和空间分子成像( SMI CosMx )数据,精准地检测了细胞群体(即细胞群落)及其相互作用。细胞群落是指在肿瘤或免疫微环境中,聚集的同类型细胞,它们可能表现出不同的生理功能。
在 SCLC 队列中, ColonyMap 成功识别了肿瘤和免疫边界,与传统的 H&E 染色和 CODEX 图像相比,具有较高的准确性。通过对不同亚型的 SCLC 进行分析,研究发现 ASCL1+ 肿瘤细胞( TCs )与血管邻近,并且具有较强的肿瘤 - 血管相互作用,这一现象与较差的无复发生存期( RFS )和总生存期( OS )相关。研究还揭示了 SCLC 不同亚型之间的细胞群落相互作用差异, SCLC-A 和混合型 SCLC-A 表现出更多的肿瘤 - 肿瘤相互作用,而 SCLC-Y 则更多地呈现免疫 - 免疫相互作用。 ColonyMap 算法为研究肿瘤免疫微环境中的细胞群体和相互作用提供了新的思路,可能成为发现临床相关亚结构的有效工具。
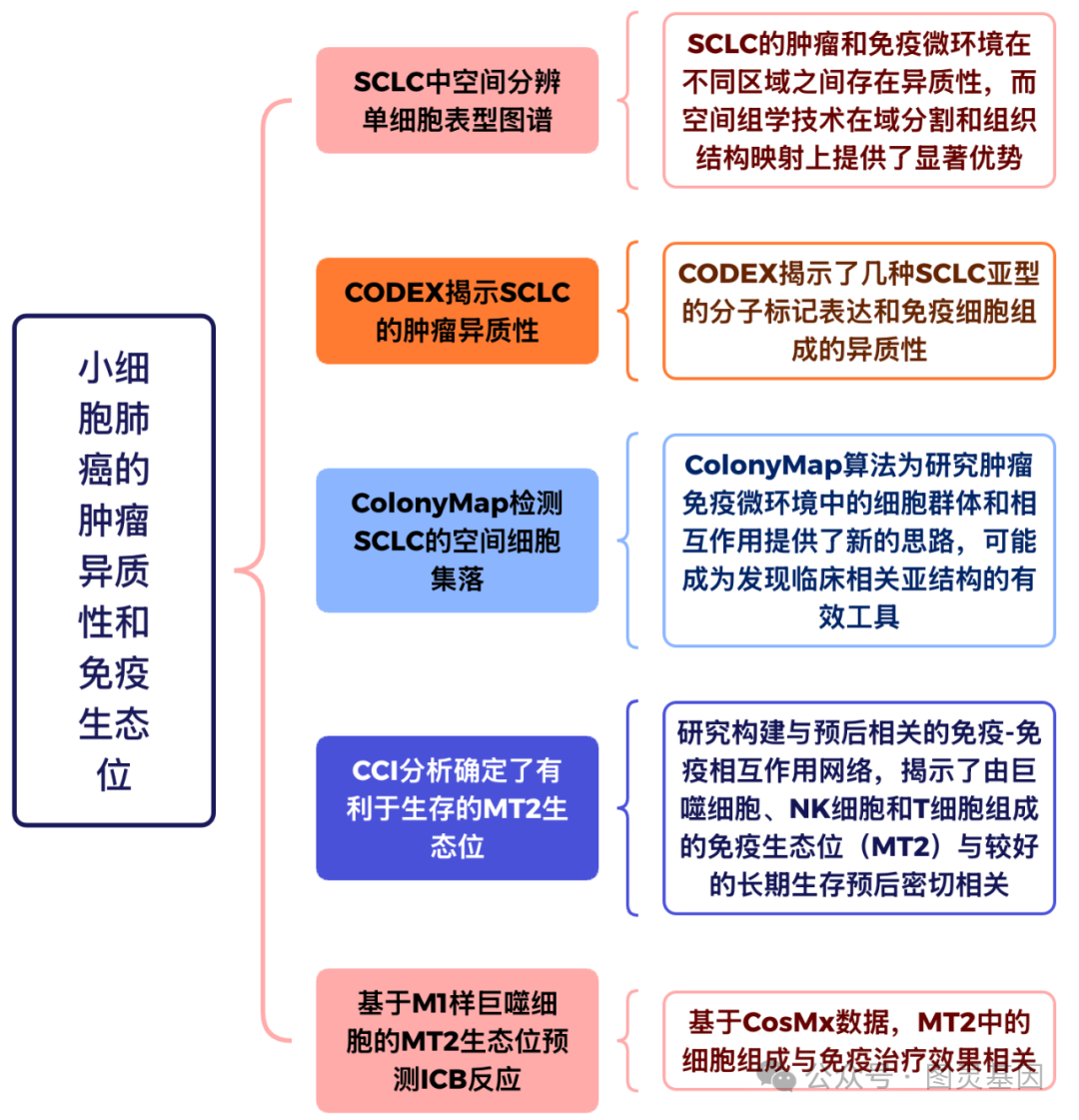
4 、 CCI 分析确定了有利于生存的 MT2 生态位
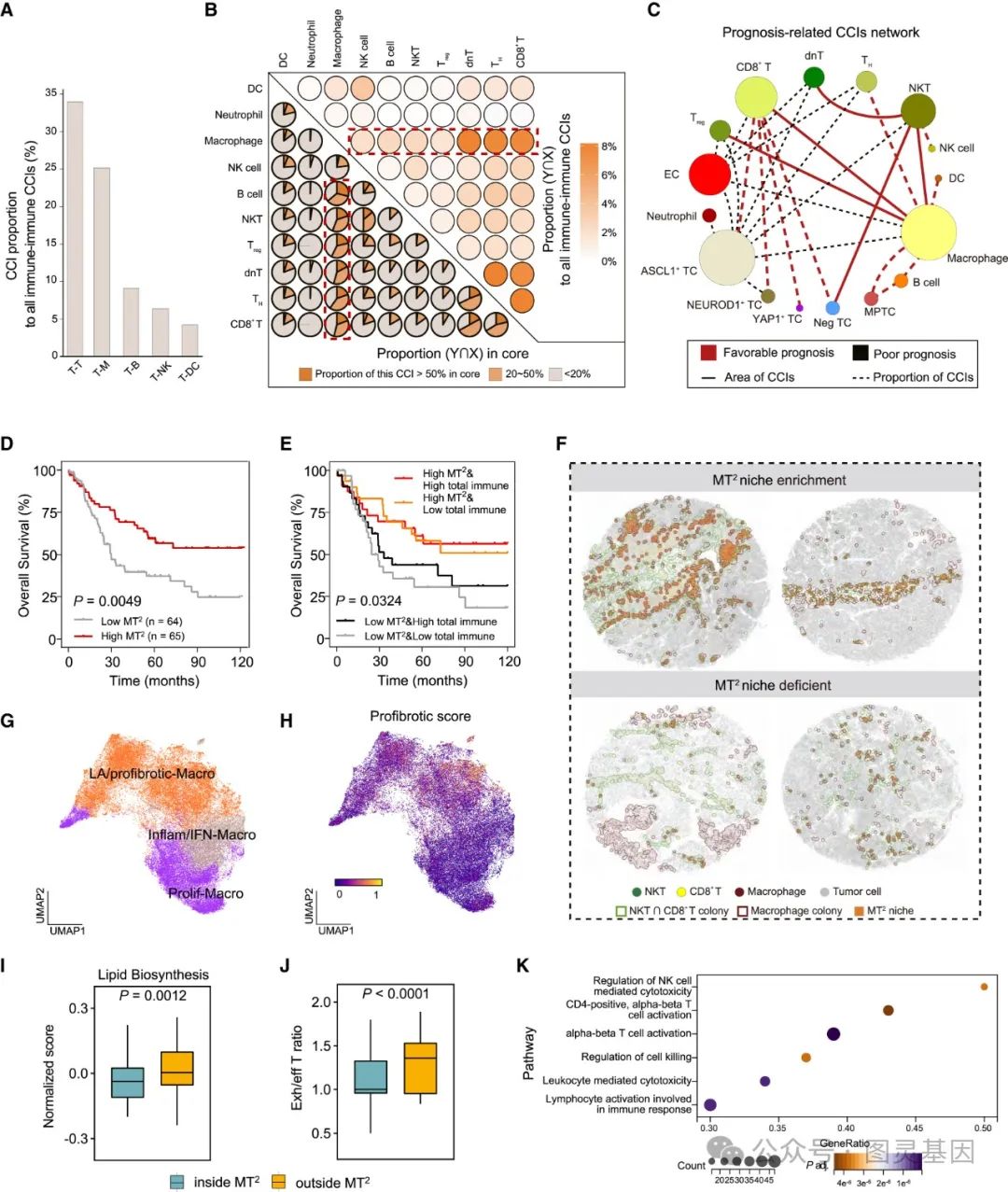
图 4. CCI 分析确定了有利于生存的 MT2 生态位
作者首先分析了 T 细胞与其他免疫细胞的相互作用,发现 T 细胞与巨噬细胞之间的免疫 - 免疫相互作用最为丰富。与树突状细胞( DC )之间的相互作用较少,部分原因是 DCs 的数量较低。利用 ColonyMap 算法,研究构建了一个与预后相关的免疫 - 免疫相互作用网络,揭示了由巨噬细胞、 NK 细胞和 CD8+ T 细胞组成的免疫生态位( MT2 )与较好的长期生存预后密切相关。 MT2 的面积较大的患者表现出显著更好的生存率,而免疫浸润水平并未明显影响患者的预后。
此外, MT2 通常集中在肿瘤群落的边界处,且 MT2 内的巨噬细胞具有较强的抗原呈递能力, CD8+ T 细胞则表现出较低的免疫检查点标志物,提示 MT2 内 T 细胞疲劳和免疫抑制较轻。通过基因集富集分析( GSEA )发现, MT2 高表达组的基因主要富集在巨噬细胞激活、 M1/M2 巨噬细胞极化以及改善淋巴细胞趋化功能等路径上,进一步解释了 MT2 与预后良好的关系。总体而言,本文提出的免疫 - 免疫相互作用和 MT2 生态位的分析为 SCLC 免疫微环境的研究提供了新的方法和视角。
5 、 基于 M1 样巨噬细胞的 MT2 生态位预测 ICB 反应
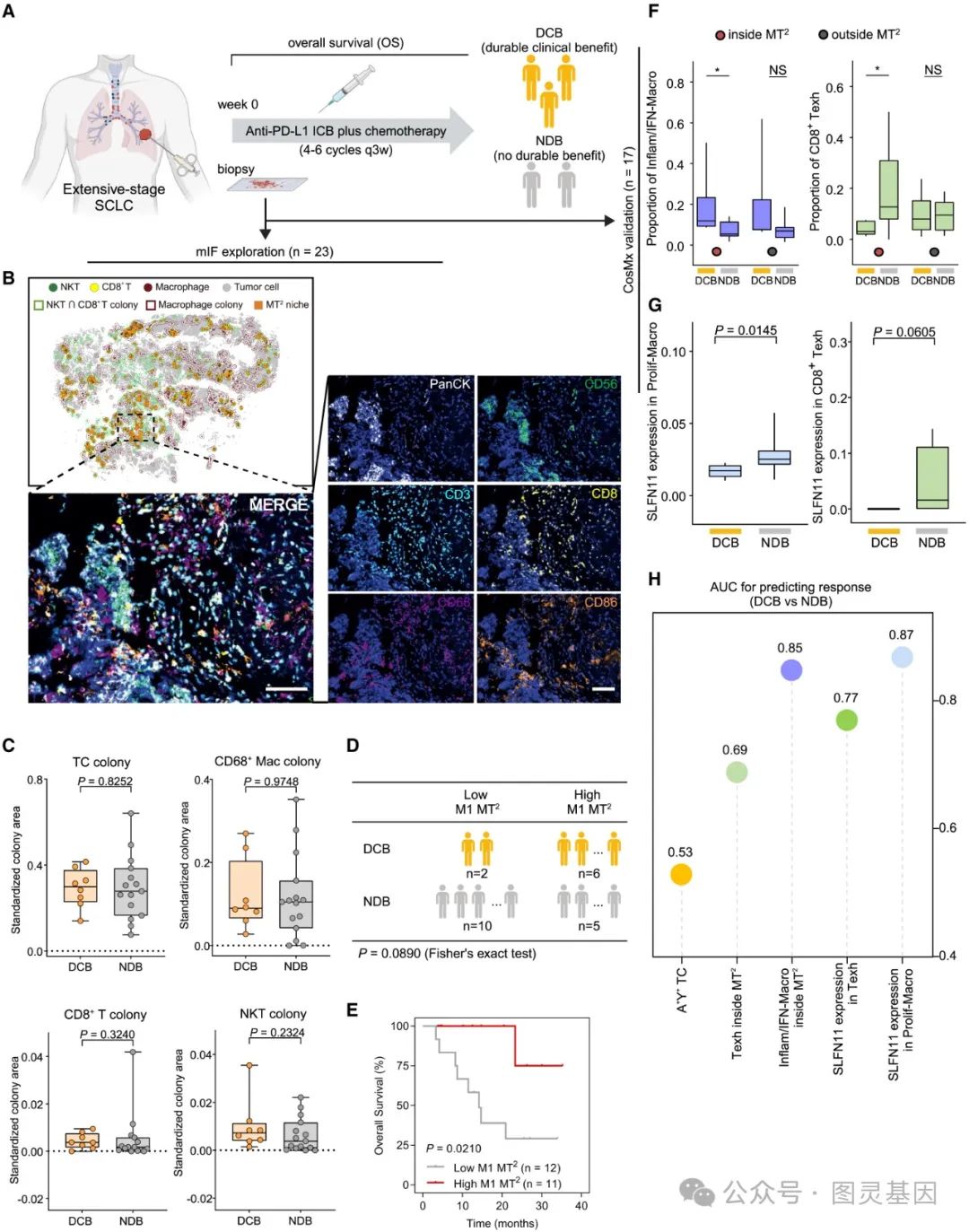
图 5. 基于 M1 样巨噬细胞的 MT2 生态位预测 ICB 反应
作者分析了 23 名接受抗 PD-L1 免疫治疗的广泛期 SCLC ( ES-SCLC )患者的队列数据。通过治疗前组织活检获取样本,并采用多重免疫荧光( mIF )和 CosMx 技术对肿瘤切片进行空间映射和群落分析。患者根据临床医生的评估分为持久临床获益( DCB )组和无持久获益( NDB )组,同时根据长期生存率评估 ICB 疗效。在最长 33.93 个月的随访中, 8 名患者获得 DCB , 15 名患者为 NDB 。
研究结果显示,不同的细胞群落和 MT2 微环境在 mIF 图像中被成功识别,证明了 ColonyMap 方法的稳健性。然而,免疫细胞群落比例和 MT2 面积在 DCB 和 NDB 组之间无显著差异。当患者进一步分为高 M1-MT2 组和低 M1-MT2 组时,高 M1-MT2 组中 DCB 患者比例显著增加。预后分析显示,高 M1-MT2 比例与免疫治疗后的延长生存期显著相关。基于 CosMx 数据, MT2 中的细胞组成与免疫治疗效果相关。 DCB 组中 M1 型炎症 / 干扰素巨噬细胞的比例显著高于 NDB 组,而 NDB 组中增殖性巨噬细胞和耗竭的 CD8+ T 细胞显著增加。此外, M1 型巨噬细胞比例和 SLFN11 表达被证明在预测 ICB 治疗效果方面具有较高的性能。
总之,作者提出了 SCLC 中第一个由 CODEX 和多组学信息组成的深度空间解析数据集。先前的组学研究主要集中在 SCLC 的分子和细胞分析上,而作者的高维图像和开发的 ColonyMap 揭示了肿瘤、血管和免疫细胞集落如何在空间中相互作用,以及免疫结构壁龛如何与临床结果相关。鉴于 SCLC 患者的治疗选择有限以及免疫治疗的异质性反应,在探索特异性免疫细胞相互作用 ( 如 M1-MT2 生态位 ) 是否可以作为 SCLC 患者的预后和预测因素方面尚未开发翻译价值。此外,随着推进治疗策略的临床试验的进展,本方法可能有助于为 SCLC 患者分层制定可靠的指南,以提高治疗反应。
作者介绍

曹志伟,复旦大学教授,研究聚焦于抗体设计与多组分协同用药的计算模型,建立了抗原表位预测 - 免疫交叉反应计算 - 抗体虚拟筛选平台,并在国际上率先建立了 “ 复方 - 中药 - 成分 - 代谢 - 靶点 ” 数据资源共享平台,研发了分子靶点发现与多成分协同药效预测模型,实现了中药作用机制自动解析。
参考文献
Chen, Haiquan et al. “Integrative spatial analysis reveals tumor heterogeneity and immune colony niche related to clinical outcomes in small cell lung cancer.” Cancer cell, S1535-6108(25)00030-3. 14 Feb. 2025, doi:10.1016/j.ccell.2025.01.012
2024年热文TOP10
1 、 Cell | 樊代明院士团队揭示补充牛磺酸增强T 细胞抗肿瘤疗效机制
4 、 Nature | 刚拿诺奖的David Baker 新作:从零合成EndoTags 蛋白,放大内吞信号,靶向降解蛋白
5 、 Cell | 复旦大学建立中性粒细胞图谱并阐明其抗肿瘤过程中的抗原呈递作用
7 、 Mol Cancer | 徐州医科大学发现M6A 修饰介导上调FASN 调节脂肪酸代谢,促进结直肠癌生长
8 、 Nat Cancer | 复旦邵志敏团队:中国乳腺癌多组学特征
9 、 Nature | 感觉神经直接与肿瘤相互作用帮助癌症扩散
10 、 Cancer Cell | 上海交大团队发现表观遗传导致CAFs 异质性促进胰腺癌



分析包括细胞亚类识别,计数,区域分布特征分析,与多模态数据结合,可建模预测肿瘤分子亚型,分子表达,表达区域,癌症预后分析,突变驱动因素分析等
链接:http://www.lewenyixue.com/2025/04/11/Cancer%20Cell%20%EF%BD%9C%20%E5%A4%8D%E6%97%A6%E5%A4%A7%E5%AD%A6%E5%9B%A2%E9%98%9F/







赶快来坐沙发