除了ICANS,CAR-T哪些神经毒性值得关注?柳叶刀子刊发表EBMT建议
神经系统并发症是接受CAR-T 细胞治疗患者的重要问题,其中免疫效应细胞相关神经毒性综合征 (ICANS) 已有管理共识指南。然而这些指南是基于 CD19 CAR-T 细胞治疗 B 细胞恶性肿瘤的早期临床经验,尚无已发表的管理其他不典型神经系统并发症的最佳实践建议,这些并发症通常在 CAR-T 细胞输注后发生,并引起具有临床意义的神经毒性。由于其他CAR-T 细胞靶点的探索(例如 BCMA)、可及性的提高、临床开发新的适应症(包括 CNS 实体瘤)和长期随访,这些不典型神经系统并发症可能将更普遍。
《The Lancet Oncology》近日发表综述,欧洲血液和骨髓移植学会 (EBMT) 实践协调和指南委员会就使用已上市CD19 和 BCMA CAR-T 细胞治疗后发生的 CAR-T 相关神经系统并发症以及 CAR-T 治疗实体瘤和血液肿瘤临床试验中新出现的神经毒性的管理提出建议,旨在指导临床医生对这些并发症进行诊断、检测、监测和治疗。本文和近期另一篇文章可以互补 综述:CAR-T的神经毒性。
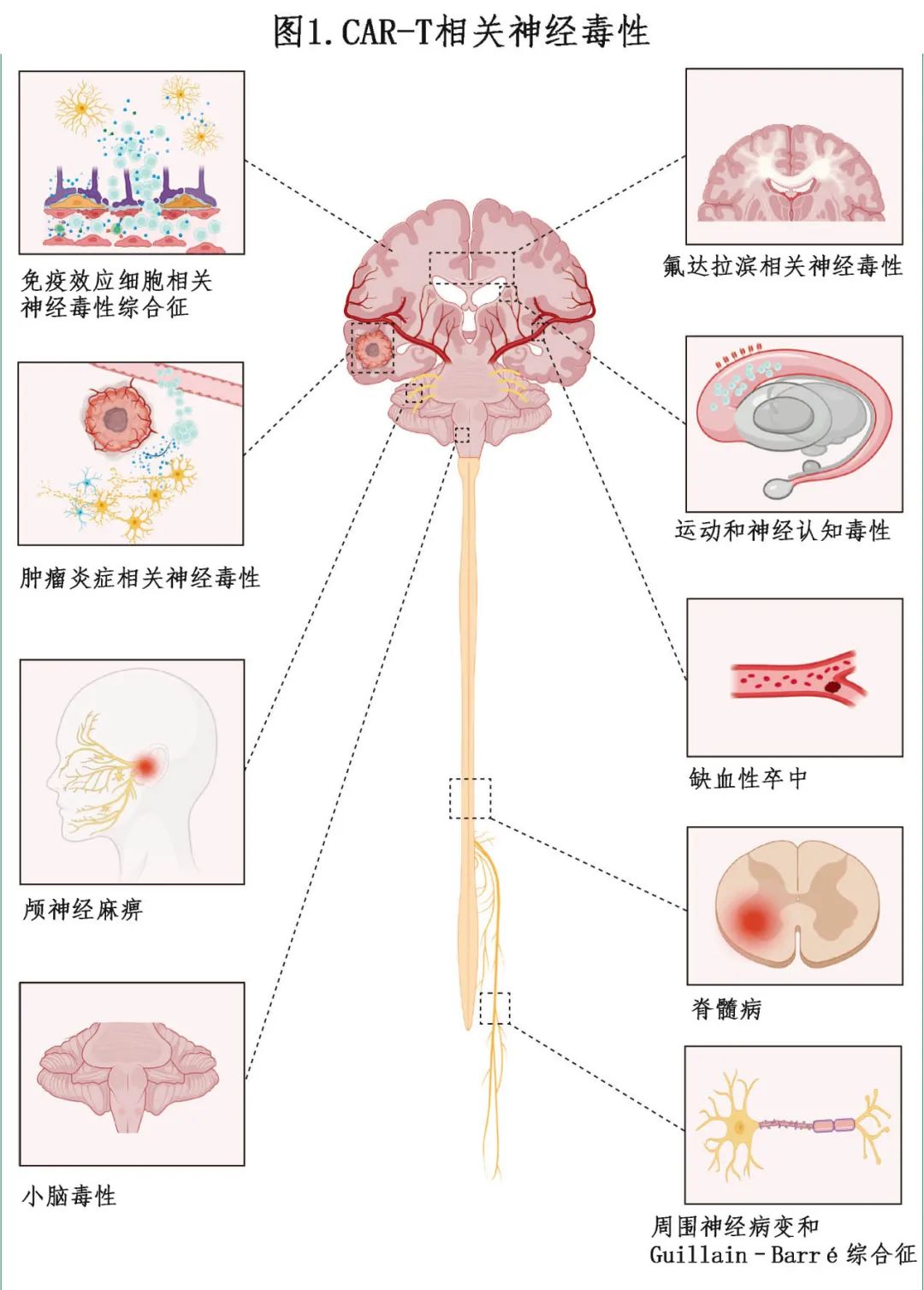
本综述涵盖的神经毒性具体包括: 运动和神经认知毒性(MNT)、颅神经麻痹、肿瘤炎症相关神经毒性(TIAN)、缺血性卒中、脊髓病、周围神经病变、Guillain–Barré综合征、氟达拉滨相关神经毒性 等(本综述不涉及ICANS和CNS感染)(图1,panel)。
MNT在某些情况下类似于帕金森病,可能发生在接受BCMA CAR-T细胞治疗多发性骨髓瘤的患者中,包括idecabtagene vicleucel(ide-cel)、ciltacabtagene autoleucel(cilta-cel)和其他研究性产品。由于BCMA结合剂在中枢神经系统(CNS)中的靶向活性,这种毒性被认为是一种类别效应(class effect)。在一名死于MNT的患者尸检中发现了基底神经节中的T细胞浸润和BCMA表达,并且在人类大脑基因表达图谱中发现了基底神经节尾状核中的BCMA RNA表达。报告的病例对左旋多巴没有反应,并且在使用ioflupane进行的多巴胺活性转运体(DaT)单光子发射CT扫描中表现正常。脑[¹ ⁸ F]氟脱氧葡萄糖([¹ ⁸ F]FDG)-PET脑成像可以显示基底神经节或额叶的低代谢。MRI脑扫描可能无异常,但最近的一个病例研究在MRI上发现了新的双侧尾状核头部、壳核和苍白球的高信号。使用高剂量全身清淋化疗,包括环磷酰胺和氟达拉滨(它们能穿过血脑屏障)已报告临床改善。
危险因素
MNT病例与外周血和脑脊液(CSF)中CAR-T细胞的高扩增有关,表明当BCMA CAR-T细胞扩展并迁移到CNS时,毒性就会发展。在CARTITUDE研究中实施的措施以降低MNT的风险包括在CAR-T细胞输注前进行桥接治疗以减少肿瘤负荷,早期干预细胞因子释放综合征和ICANS,以及增加对神经并发症的监测。需要更多数据来证实这些措施的有效性。
临床表现
在接受BCMA CAR-T细胞疗法后,患者可能会出现新的运动障碍、认知障碍或人格改变(或这些症状的组合),通常发生在细胞因子释放综合征和ICANS恢复之后,中位发病时间为36天(范围14-914)。神经检查中的症状和体征可能包括震颤、齿轮样僵硬、运动功能障碍、小字症、精神障碍、冷漠、注意力减退、记忆障碍、表情平淡、声音低沉、步态障碍和面部表情减少。应进行协调和步态检查、书写评估以及情感、震颤和语言的评估,以检测MNT。
诊断
应获得神经科咨询并排除其他诊断。应测量外周血中的绝对淋巴细胞计数和CAR-T细胞计数。如果患者严重淋巴细胞减少或CAR-T细胞缺失,MNT不太可能发生(除非之前已经发生了强烈的扩增),应寻求其他诊断。DaT-SCAN和短期左旋多巴治疗以评估反应可能有助于将其与特发性帕金森病区分开来。[¹ ⁸ F]FDG-PET成像可以显示低代谢区域,尽管这些变化可能微妙且非特异性,分析依赖于与神经对照组的比较。MRI脑部扫描在MNT患者中可能正常或显示基底神经节的信号异常。然而,建议进行脑部MRI以排除其他病理情况。
治疗
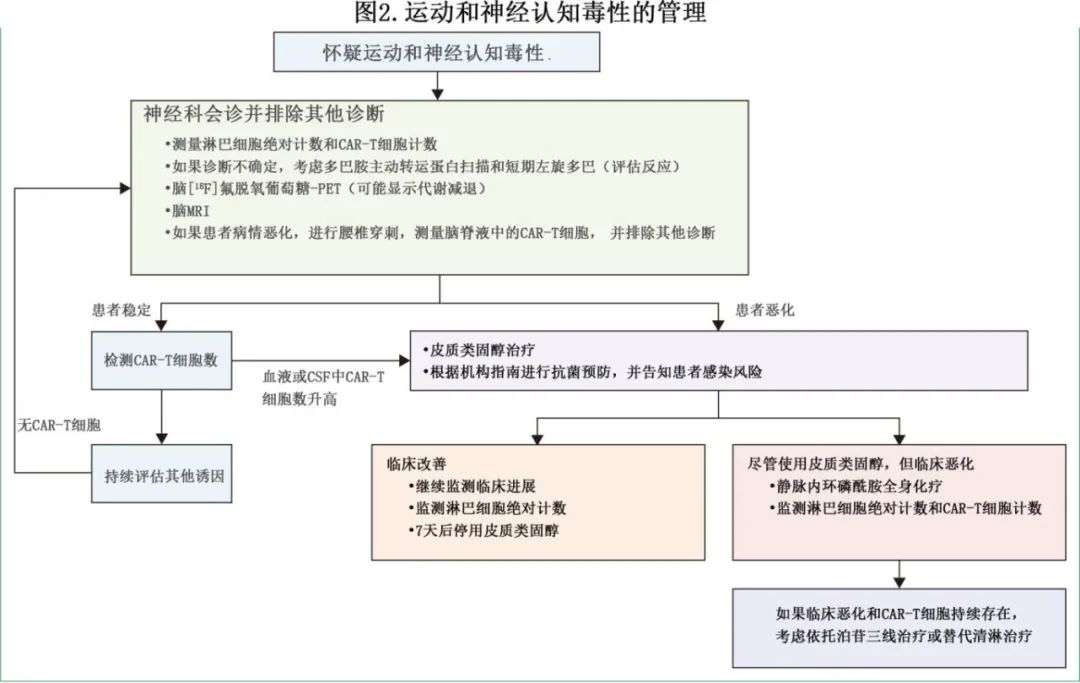
MNT的治疗应参考图2。
一线治疗应使用地塞米松,剂量为10-20mg,每天两到四次,持续3-5天,并根据机构指南进行抗感染预防。应避免长期使用皮质类固醇。对于症状恶化且CAR-T细胞持续存在的患者,二线治疗应使用高剂量全身静脉注射环磷酰胺(建议剂量为每平方米2g)。
对于神经系统症状恶化且CAR-T细胞持续存在的患者,三线治疗可能包括依托泊苷或替代清淋性化疗。
尽管鞘内化疗可能无法有效穿透脑实质,但在CSF中存在持续CAR-T细胞的迅速恶化患者中可以考虑使用。
在接受BCMA CAR-T细胞疗法治疗多发性骨髓瘤的患者中,颅神经麻痹更为常见,但在接受CD19 CAR-T细胞疗法治疗原发性纵隔B细胞淋巴瘤和B急性淋巴细胞性白血病的患者中也有报道。在一项使用ciltacabtagene autoleucel治疗的332例患者中,有21例(6%)患者出现脑神经麻痹,突出显示了该并发症是CAR-T细胞疗法的一个显著但并不常见的不良事件。
危险因素
导致颅神经麻痹的根本机制尚不清楚,尽管炎症似乎起着重要作用。患有颅神经麻痹的患者显示出统计学上显著更高的CAR-T细胞扩增和暴露量。此外,在这些患者中观察到IL-10的峰值浓度升高以及IL-10和IL-2Rα的暴露浓度更高。在接受ciltacabtagene autoleucel输注后,颅神经麻痹的发生率在既往治疗线数较少的患者中更高(1-3线为9.1%,n=16),而在那些有更广泛治疗史的患者中较低(中位数为6线既往治疗,n=3,3.1%),这可能表明在早期治疗线中T细胞的健康度更好。
临床表现
颅神经麻痹主要涉及第七脑神经(面神经),双侧受累的情况大约占29%。其他颅神经受累的情况较少见,仅发生在14%的病例中,通常影响第三或第五脑神经。这种并发症通常早期出现,中位发病时间为CAR-T细胞输注后22天。
诊断
在出现颅神经麻痹的患者中,应进行全面的诊断评估,包括进行脑部MRI(使用和不使用钆造影剂)和脑脊液分析,以排除感染性或恶性原因,如软脑膜受累或浆细胞瘤压迫神经。
治疗
与特发性面神经麻痹的管理类似,建议短期使用皮质类固醇,例如每天两次25mg泼尼松,持续10天。在ciltacabtagene autoleucel的临床研究中,大多数(91%)患者接受了皮质类固醇治疗,90%的病例在中位66天内脑神经麻痹得到恢复。更高剂量或长期使用皮质类固醇并未缩短恢复时间,并可能增加感染风险。
尽管该情况通常为低级别,但也可能会给患者带来相当大的焦虑。告知患者大多数情况下该并发症可完全恢复也至关重要。
TIAN是一种局部神经毒性综合征,它不同于ICANS和其他与免疫疗法相关自身免疫性脑病或神经病变,已在CAR-T细胞疗法治疗中枢神经系统肿瘤的临床前模型和早期临床试验中证实是一种潜在并发症。临床表现取决于肿瘤位置,症状是由炎症引起的神经元功能障碍,可能伴有或不伴有肿瘤部位的水肿,在某些情况下可能导致脑脊液流出受阻和颅内压升高。值得注意的是,TIAN和ICANS综合征可能重叠。由肿瘤学家、血液学家、神经学家、神经外科医生和重症监护专家组成的多学科团队应该参与患者的管理,并根据分类和分级系统来确定TIAN的等级和类型(详见Mahdi J, Dietrich J, Straathof K, et al. Tumor inflammationassociated neurotoxicity. Nat Med 2023; 29: 803–10.)。
危险因素
TIAN 的发生率或严重程度取决于肿瘤部位和大小,并可能因 CAR-T 细胞产品和给药途径而异。
临床表现
TIAN包括两种不同的神经毒性特征,它们可能会重叠。1型TIAN或机械性神经毒性反映与炎症相关的组织水肿或肿块效应以及脑脊液流出受阻,导致颅内压升高(即,≥20 mm Hg)。临床表现可能从轻微(例如,孤立性头痛)到潜在的生命威胁(例如,脑疝综合征),其症状或体征取决于肿瘤的位置。2型TIAN通常表现为先前存在的神经系统症状的短暂恶化,反映肿瘤周围的炎症或电生理功能障碍。
诊断
应考虑并适当管理其他或并发的诊断,包括感染、ICANS和肿瘤进展。神经检查仍是TIAN最敏感的诊断工具,但神经影像学也可以发挥作用。在1型TIAN中,神经影像学可能显示阻塞性脑积水或脑室扩大,但表现可能正常,因此临床评估应驱动管理决策。在2型TIAN中,脑部MRI没有诊断性,但可以显示肿瘤周围T2信号增加,而没有阻塞或脑积水。
治疗
1型TIAN患者如果出现早期颅内压升高的临床症状,需要紧急干预以移除脑脊液并降低颅内压;方法包括脑脊液引流、皮质类固醇和高渗透治疗。对脑脊液引流无反应的高等级TIAN是神经紧急情况,可能需要神经外科干预。患有后颅窝肿瘤的患者发生1型TIAN和脑疝综合征的风险最高;应考虑预先放置Ommaya储液器以监测颅内压和移除脑脊液。
对于2型TIAN,可能只需要观察并进行连续的神经检查;也可能需要使用皮质类固醇,可能与anakinra或其他药物联合使用,以减少局部水肿的有害影响,例如在关键的脑干下部或颈椎脊髓部位。
在CD19和BCMA CAR-T细胞疗法的患者中已经报告了缺血性卒中的病例,单中心研究的估计发生率为1-3%,在FDA的不良事件报告系统中的病例报告和回顾性分析中也有记录。这些事件可能由于无症状表现而被低估。在一项针对190例接受弥漫性大B细胞淋巴瘤和多发性骨髓瘤治疗的患者的研究中,基于输注前后的脑部MRI,确定了四例患有严重ICANS的患者出现新无症状急性缺血性组中。同样,在一项针对42例B细胞淋巴瘤患者的研究中也观察到一例ICANS患者的脑梗塞,其侧重于放射学检查。尽管这些卒中通常在治疗后早期发生,但在输注后90天以上的晚期脑血管事件(包括中风)也在85例患者中有4例(5%)被报告。实际上,缺血性卒中是非复发性死亡的显著原因。在包括957例接受CD19 CAR-T细胞治疗的大B细胞淋巴瘤患者的法国DESCAR-T登记组,非复发性死亡发生在48例患者中,其中缺血性卒中占三例(6%)死亡,ICANS占两例(4%)。一项大型系统评价和荟萃分析涵盖截至2024年3月在CAR-T细胞疗法治疗淋巴瘤和多发性骨髓瘤的非复发性死亡报告,涵盖18项临床试验和28项真实世界研究中的7604例患者,确定了574例非复发性死亡(点估计值6.8%),其中九例(2%)是由于卒中或缺血性脑损伤。
危险因素
卒中可发生于现患或既往患重度 ICAN 的患者中。可能不存在诱发条件(例如,基础心血管风险因素或既往卒中史)。
临床表现
卒中通常表现为突然的神经功能缺损,如单侧面部下垂、手臂无力、感觉障碍、偏盲或言语困难和其他症状,取决于涉及的大脑半球。症状可在数秒至数分钟内出现。然而由于重度ICANS,在进行的 MRI 中也描述了无症状性卒中。
诊断
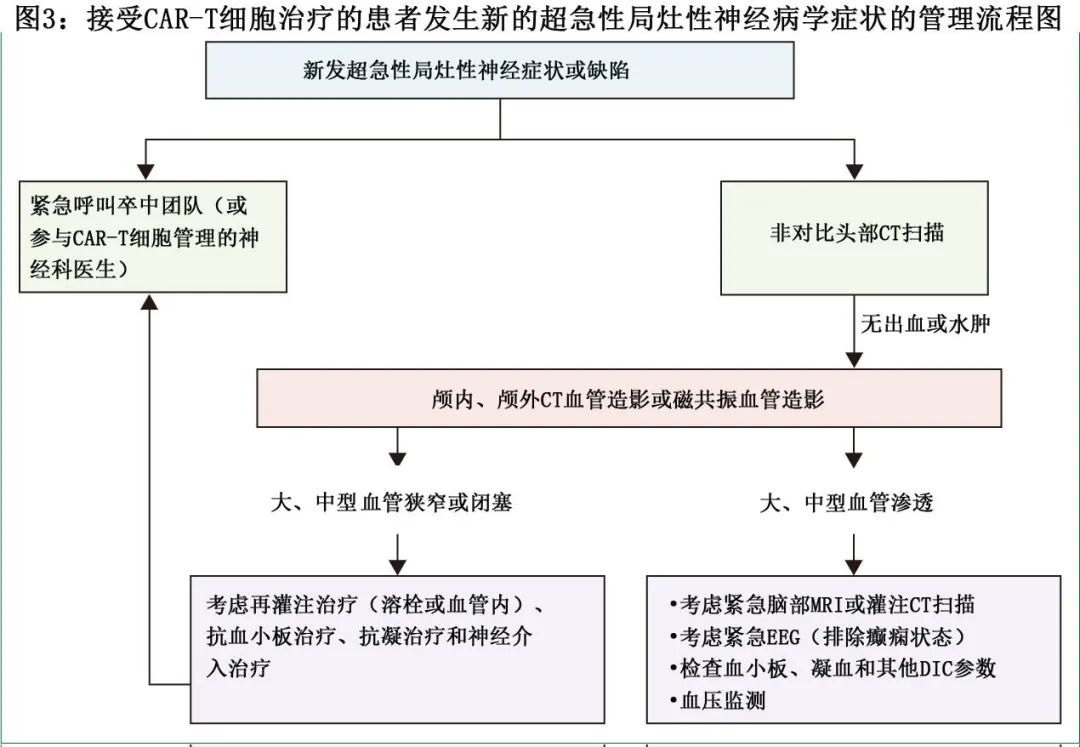
在所有接受CAR-T细胞治疗的患者中,如果出现新发急性局部神经功能缺损,必须考虑急性卒中的可能性。应启动住院卒中团队,特别是在ICANS无症状或从ICANS恢复的患者中。当怀疑急性卒中时,应立即进行无对比剂头部CT扫描以排除出血。然而应进行CT血管造影或磁共振血管造影,以评估颅内和颅外血管(或两者)中的动脉狭窄或闭塞。值得注意的是,尽管经颅多普勒可以揭示许多ICANS患者的血流速度增加,特别是有局部神经功能缺损的患者,但这种增加通常发生在没有结构性发现的情况下。在这些情况下,紧急脑部MRI或灌注CT扫描,甚至脑电图,可以帮助排除其他诊断(图3)。
治疗
早期识别卒中需要严格监测血压。最初允许高血压(允许性高血压)以维持脑灌注至关重要。相反,在血压非常低的患者中,可能需要仔细的液体管理或使用升压药以维持足够的脑灌注。是否开始或加强抗血小板治疗、抗凝治疗、溶栓治疗或神经介入治疗的决定应个体化,并与神经科顾问或卒中团队讨论。这些缺血性事件的临床意义和管理可能代表CAR-T细胞治疗后出现的新兴毒性,需要进一步的研究(图3)。
目前至少有24例CAR-T细胞介导的急性脊髓病的病例报告,其中包括20例淋巴瘤成年患者和4例B细胞急性淋巴细胞白血病儿童患者,所有这些病例均由Deschênes-Simard及其同事最近进行了总结。急性脊髓病的假定机制包括炎症介质毒性、脊髓梗死、短暂性脑缺血发作(TIA)、靶向非肿瘤毒性、既往放疗以及感染。
危险因素
大多数患者在发生脊髓病之前都经历重度ICANS。有研究表明,女性患者(与男性患者相比)和年轻患者(与老年患者相比)更容易受到影响,尤其是与炎症微环境相关的淋巴瘤患者,例如原发性纵隔B细胞淋巴瘤和EB病毒阳性的弥漫大B细胞淋巴瘤。
临床表现
急性脊髓病通常与ICANS发作同时发生或在其发作后不久出现,发生在CAR-T细胞输注后的第5至27天之间。该病表现为一种急性且严重的综合征,包括弛缓性截瘫、四肢瘫痪、膀胱失控和感觉减退,并伴有感觉障碍的平面。然而在病情严重的患者中,临床怀疑这种疾病可能会比较困难。
诊断
诊断检测包括进行有无钆剂的脑部和脊髓磁共振成像(MRI),以评估脊髓炎症,但影像学检查有时可能表现正常。在没有禁忌证的情况下,应进行腰椎穿刺以检查CSF。理想的腰椎穿刺应包括测量脑脊液压力、细胞分类计数和流式细胞术、蛋白质浓度检测,以及实验室检查以排除感染。脑脊液检测还应包括寡克隆带和抗体检测,如抗神经元抗体、水通道蛋白4(AQP-4)抗体和髓鞘少突胶质细胞糖蛋白(MOG)抗体。此外,建议进行血清学检测以排除代谢原因,如维生素B12、叶酸、维生素E、铜和硫胺素缺乏。
治疗
与自身免疫性脊髓炎的其他病例类似,如果怀疑有感染原因,应同时开始高剂量静脉注射糖皮质激素治疗和经验性抗微生物治疗。在伴有ICANS的情况下,可以使用Anakinra,并且对于严重的或难治性脊髓炎也可以考虑使用。静脉注射免疫球蛋白或血浆置换在严重ICANS和CAR-T细胞介导的脊髓炎中的作用尚不明确,但对于之前接受过免疫检查点抑制剂治疗且对高剂量糖皮质激素治疗无效的患者,应考虑这些治疗。
在接受用于治疗弥漫性大B细胞淋巴瘤的tisagenlecleucel和用于治疗多发性骨髓瘤的ciltacabtagene autoleucel的患者中,由CAR-T细胞引起的周围神经病变越来越受到临床关注。在CARTITUDE-1研究中,97例患者中有6例(6%)出现周围神经病变,这些病变包括感觉性、运动性或混合性感觉运动神经病变,中位发病时间为62天(范围4-136天)。其中2例患者为3级神经病变,且6例患者中有3例周围神经病变未缓解。
此外,另有研究报告了一例接受ciltacabtagene autoleucel治疗的患者发生Guillain-Barré综合征,这是一种免疫介导的急性周围性多发神经根神经病变。在另一例患者中,Guillain-Barré综合征与淋巴瘤复发同时发生,该患者在接受tisagenlecleucel输注后,通过高剂量化疗和自体干细胞移植治疗淋巴瘤复发,神经系统症状有所改善。然而该结果并不能完全排除该病例中神经病变的副肿瘤性(paraneoplastic)起源。
该并发症的病理生理学尚不清楚。直接攻击周围神经似乎不太可能,因为目前尚未报告CD19或BCMA在周围神经成分上的表达或交叉反应。此外,Guillain-Barré综合征也出现在其他非CD19或BCMA CAR-T细胞的细胞免疫疗法中,例如在滑膜肉瘤中接受NY-ESO-1反应性T细胞受体基因工程改造的淋巴细胞过继转移治疗的患者中。一种更合理的机制可能是涉及周围神经附近的旁观者炎症引起的间接损伤。在一名接受tisagenlecleucel治疗后发生严重Guillain-Barré综合征的患者的肌肉活检中,显示以T细胞为主的血管周围淋巴细胞浸润和严重的神经源性肌肉纤维损伤。
危险因素
尚未发现危险因素。既存自身免疫性神经病的患者已安全地接受 CAR T 细胞治疗,输注后其神经系统症状实际上可能改善,尽管目前数据很少。
临床表现
Guillain-Barré综合征通常表现为背痛和进行性、对称性肌肉无力,这种无力从腿部开始并向上蔓延,伴随反射消失、感觉改变、自主神经功能障碍,以及在严重情况下可能出现的呼吸衰竭。部分患者可能会表现出与Guillain-Barré综合征的Miller-Fisher变异型相一致的症状,包括多发性神经根神经炎、脑病和言语障碍。目前尚不清楚,某些患者的周围神经病变或面神经麻痹是否可能代表Guillain-Barré综合征或其变异型。
诊断
诊断检查应包括神经传导和针电肌图检查,这些检查可以揭示脱髓鞘型Guillain-Barré综合征中的传导减缓或传导阻滞,从而有助于支持外周神经受损的诊断。然而,在临床发病后的最初几天内,检查结果可能并无异常,而且神经传导检查正常并不能排除该诊断。聚焦于线性神经根对比增强的脊髓MRI可以提供支持性发现。理想情况下,在完成MRI检查后进行腰椎穿刺以进行CSF分析,测量蛋白浓度和细胞计数(细胞学和细胞计量学),可能会显示出蛋白-细胞分离模式,尽管也可能出现轻度白细胞增多,特别是涉及CAR-T细胞。此外,还应考虑进行其他实验室检查,以排除感染性、副肿瘤性或中毒代谢性原因。如果怀疑Miller–Fisher综合征,应进行抗GQ1b抗神经节苷脂抗体检测。
治疗
这些周围神经综合征通常对使用糖皮质激素和为期5天的大剂量静脉注射免疫球蛋白治疗有反应,但更严重的病例可能表现出渐进的、通常不完全的恢复。专家建议首先根据影像学和电诊断检查对周围神经病变进行分类,然后使用针对性治疗(例如,对急性脱髓鞘性多神经病变使用静脉注射免疫球蛋白)。
氟达拉滨是输注CD19和BCMA CAR-T细胞或其他T细胞之前最常用的清淋药物之一。然而,已有多个病例报告在CAR-T细胞输注后出现氟达拉滨诱导的神经毒性。
危险因素
危险因素包括高龄、肾功能减退、既往接受过氟达拉滨为基础的移植以及既往存在神经系统疾病。对于肾功能受损的患者,需要调整氟达拉滨的剂量。
临床表现
氟达拉滨相关的神经毒性通常表现为迟发性发作,在最后一次给药后20至60天内发生。神经系统症状可能包括视觉障碍、失明、脑病、痴呆和运动功能障碍(包括四肢瘫痪),这些症状常常会进展为昏迷,最终导致死亡。
诊断
当怀疑出现神经毒性时,患者应接受脑部MRI检查。影像学检查可能显示与急性中毒性脑白质病一致的典型改变,表现为T2加权成像和液体衰减反转恢复序列上脑室周围白质的高信号病灶,伴有弥散受限但无增强。然而,神经系统功能缺损的严重程度与MRI上观察到的轻微异常之间可能存在差异。氟达拉滨诱导的神经毒性是一种排除性诊断,其管理需要进行广泛的检查,包括CSF分析,以排除中枢神经系统感染,特别是由人类多瘤病毒2(又称John Cunningham病毒)再激活引起的进行性多灶性脑白质病。此外,在鉴别诊断中还应考虑其他自身免疫性或副肿瘤性原因。
治疗
氟达拉滨相关神经毒性的治疗主要限于皮质类固醇和支持治疗,但其预后较差,且常为致命性。神经病理学检查通常发现以枕叶为主的坏死性脑白质病。氟达拉滨相关神经毒性通常具有迟发性和进展性。尽管CAR-T细胞治疗和氟达拉滨的神经毒性之间存在重叠,但根据临床表现和时间顺序区分它们至关重要。
其他罕见的神经毒性也可能发生,包括自主神经功能障碍,如短暂且可逆的窦性心动过缓或直立性低血压,通常发生在ICANS的背景下。此外,有报告称持续性重度姿势性震颤类似于特发性震颤,且通过普萘洛尔治疗有效。在接受GPRC5D CAR-T细胞治疗后,小脑功能障碍也是一种不常见的并发症,其潜在原因可能与下橄榄核中GPRC5D的低表达有关。随着新的CAR靶点不断涌现,类似的神经毒性也可能出现,因此建议在临床实践中保持高度警惕。
CAR-T细胞治疗的幸存者经常报告长期的心理困扰和生活质量的大幅下降。
临床表现
在两项前瞻性队列研究中,大约20%至40%的患者在接受CAR-T细胞治疗后出现了神经精神学结果,如焦虑、抑郁和主观认知障碍。这些心理痛苦在CAR-T细胞治疗后3至6个月有所减轻,但仍有相当比例的患者在治疗后6至12个月仍受到影响。
危险因素
导致这些神经精神学并发症的一个关键因素可能是与CAR-T细胞治疗相关的强烈免疫激活。CRS可触发神经炎症过程,从而导致主观认知缺陷和情绪障碍。既往研究发现,较高的白细胞介素-6(IL-6)水平与较高的抑郁发生率之间存在关联。除了生物学因素外,患者常常报告存在对肿瘤复发的持续性恐惧,这种恐惧在接受CAR-T细胞治疗后较为常见,并可能加剧焦虑和抑郁的情绪。接受该治疗的患者通常需要住院2至3周,以应对可能危及生命的毒性反应,如CRS和ICANS,这可能导致严重的心理症状。在某些情况下,同时使用的药物,如左乙拉西坦(常用于CAR-T细胞受者的癫痫预防或治疗),可能会进一步加重情绪障碍。此外,其他常用的联合药物,如糖皮质激素、抗抑郁药和阿片类药物,也可能影响或加剧心理障碍,从而进一步复杂化临床表现。
诊断和治疗
所有计划接受CAR-T细胞治疗的患者都应接受由合格心理治疗师或同等专业人员进行的常规术前心理评估或咨询,该评估应重点关注患者对治疗的想法和感受,并确定其是否需要持续支持。可以使用经过验证的工具来测量焦虑情况(例如,广泛性焦虑障碍7项量表[GAD-7])。早期的心理干预和通过患者报告的结果进行定期监测对于管理这些复杂的心理结果至关重要。使用经过验证的患者报告结果工具,并结合已建立的指标来解读这些结果,这一点非常重要。这种方法是改善症状管理、提高生活质量以及减少医疗资源使用的一种有效策略。然而,在某些特定的临床环境中,如CAR-T细胞治疗(患者在接受治疗后可能有一套独特的症状和毒性反应),使用通用的患者报告结果测量工具可能无法提供具有临床意义的信息。在长期无复发的环境中,患者支持小组可以提供情感和道德支持。
建议采用多学科护理模式,涉及心理健康专业人员和社会工作者,以解决患者的身体和情感负担。
EBMT实践协调与指南委员会为CAR-T细胞治疗后的非ICANS神经学并发症提供了指导,这些指导将建立一种更标准化的诊断和管理这些并发症的方法,从而改善治疗结果,并提高临床结果的可比性。本综述还将提高对CAR-T细胞治疗后非ICANS神经学并发症的认识,并激发该领域的转化和临床研究工作,这对于建立更有力的循证基础是必要的。
然而,当前的建议存在一些局限性。最重要的是,关于某些神经学并发症的病理生理学、发病率以及治疗反应的证据较为薄弱。对于接受CAR-T细胞治疗后出现非典型神经学并发症患者的长期结果数据也很稀缺。干预措施主要基于病例系列和专家意见,而非来自临床试验的已发表证据。鉴于参与的专家数量相对较少,可能存在偏差,其他专家可能会得出不同的结论。事实上,作者已经通过邀请来自不同医学背景的专家,并确保地理区域和性别的多样性,来部分解决这一困难。
未来临床研究应探讨干预措施的最佳剂量和时机,并研究针对CAR-T细胞治疗后这些非典型神经学并发症的新疗法。还需要进一步研究以探索CAR-T细胞治疗的长期心理影响,识别有效管理神经精神症状的干预措施,并理解免疫激活与认知和情绪障碍之间联系的生物学机制。鉴于EBMT数据库正在收集有关CAR-T细胞相关并发症的数据,通过扩展研究工作来改善循证基础是EBMT未来的一项重要任务。
参考文献
Lancet Oncol . 2025 Apr;26(4):e203-e213. doi: 10.1016/S1470-2045(24)00715-0.
链接:http://www.lewenyixue.com/2025/04/11/%E9%99%A4%E4%BA%86ICANS%EF%BC%8CCAR-T%E5%93%AA%E4%BA%9B%E7%A5%9E%E7%BB%8F%E6%AF%92%E6%80%A7%E5%80%BC/







赶快来坐沙发